应用生物信息学分析结核分枝杆菌表位串联蛋白W541的结构和功能
2022-12-01李鹏川梁艳张林西吴雪琼
李鹏川 梁艳 张林西 吴雪琼
迄今为止,卡介苗是世界上唯一获得许可的结核病疫苗,但它对结核分枝杆菌潜伏感染(latent tuberculosis infection,LTBI)人群不能产生有效的预防和保护作用[1]。因此,研究针对LTBI人群的疫苗对于结核病的控制十分重要。目前国内外新型结核病疫苗的种类主要有灭活疫苗、活疫苗和亚单位疫苗。亚单位疫苗只用结核分枝杆菌(Mycombacteriumtuberculosis, MTB)的一部分成份引起机体产生免疫保护反应,主要包括DNA疫苗、重组蛋白疫苗或多肽疫苗(加佐剂)、多肽以外的其他纯化的主要成份(如枝菌酸、糖脂,等),可作为卡介苗的加强疫苗。
W541是由MTB增殖期抗原Ag85A和Ag85B及潜伏相关抗原Rv3407和Rv1733c四种抗原串联起来的新型多抗原表位融合DNA疫苗编码的蛋白。Ag85复合物是MTB和卡介苗的主要分泌性蛋白,在H37Rv标准株中占分泌蛋白总量的30%,是一组重要的分枝杆菌分泌蛋白。Ag85复合物是由Ag85A、Ag85B和Ag85C 3个蛋白组成。有研究表明,Ag85A和Ag85B可诱导较强的辅助性T淋巴细胞1型(Th1型)免疫反应,诱导γ干扰素(IFN-γ)、白细胞介素2(IL-2)和肿瘤坏死因子α(TNF-α)升高,而Ag85C却无此效应。有研究发现,Rv3407是存在于H37Rv菌株全细胞裂解液中的1个LTBI激活相关的蛋白;对Rv3407蛋白抗原表位进行预测,发现它是1个T细胞和B细胞抗原表位都较丰富的蛋白抗原[2];Rv3407 DNA疫苗可明显诱导小鼠体液和Th1型细胞免疫应答,对小鼠结核模型具有明显的免疫治疗作用[3]。Rv1733c是MTB在休眠期表达量比较高的一种保守的跨膜蛋白。Black等[4]在南非、冈比亚和乌干达等3个结核病高负担国家中研究了7个经典的MTB重组蛋白抗原和51个休眠调节子编码的MTB重组蛋白抗原刺激人机体产生的免疫应答情况,发现Rv1733c抗原是被识别频率最高的一个潜伏相关蛋白抗原,并且应用酶联免疫吸附试验检测全血中分泌的IFN-γ量也较高;Rv1733c DNA疫苗对小鼠结核模型有一定的治疗作用[5]。因此,笔者选择这4种蛋白的抗原表位串联构建重组蛋白和DNA疫苗,应用生物信息学方法对MTB W541蛋白的结构及功能进行预测分析,为研究新型结核病疫苗提供理论依据。
材料和方法
一、W541蛋白的氨基酸序列
本实验室构建的多表位串联DNA疫苗编码蛋白W541的氨基酸序列为:FSRPGLPVEYLQVP
SPSMGRDIKVQFQSGGANSPALYLLDGLRAQD
DFSGWDINTPAFEWYDQSGLSVVMPVGGQSSF
YSDWYQPACGKAGCQTYKWETFLTSELPGWL
QANRHVKPTGSAVVGLSMAASSALTLAIYHP
QQFVYAGAMSGLLDPSQAMGPTLIGLAMGDA
GGYKASDMWGPKEDPAWQRNDPLLNVGKLIA
NNTRVWVYCGNGKPSDLGGNNLPAKFLEGFV
RTSNIKFQDAYNAGGGHNGVFDFPDSGTHSW
EYWGAQLNAMKPDLQRALGATPNTGPAPQG
AGSGGGSGGRRLMIGTAAAVVLPGLVGLAGG
AATAGAFSRPGLPVEYLQVPSPSMGRDIKVQF
QSGGNNSPAVYLLDGLRAQDDYNGWDINTPA
FEWYYQSGLSIVMPVGGQSSFYSDWYSPACGK
AGCQTYKWETFLTSELPQWLSANRAVKPTGS
AAIGLSMAGSSAMILAAYHPQQFIYAGSLSAL
LDPSQGMGPSLIGLAMGDAGGYKAADMWGPS
SDPAWERNDPTQQIPKLVANNTRLWVYCGNG
TPNELGGANIPAEFLENFVRSSNLKFQDAYNA
AGGHNAVFNFPPNGTHSWEYWGAQLNAMKG
DLQGPGPGLRQHASRYLARVEAGGPGPGSGV
LIPARRPQNLLDVTAEPARGRKRTLSDVLNEM
RGPGPGIPFAAAAGTAVQDSRSHVYAHQAQT
RHP。
二、W541蛋白的序列分析
分别应用在线软件ProtParam(https://web.expasy.org/Protparam)预测分析蛋白的理化性质;应用Protscale(https://web.expasy.org/protscale)预测分析蛋白的亲(疏)水性;应用TMHMM(TMHMM Server v.2.0)(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测分析蛋白的跨膜区域。
三、W541蛋白的二级和三级结构预测
应用在线软件SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对该蛋白的二级结构进行预测分析;应用SWISS-MODEL(http://swissmodel.expasy.org)分析其三级结构,并进行同源建模。
四、W541蛋白质亚细胞定位预测
应用PSORT Prediction (https://psort.hgc.jp/)和SingnalP 5.0 Server(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)预测分析W541蛋白的亚细胞定位及信号肽。
五、W541蛋白质翻译后的修饰预测
应用NetNGlyc 1.0 Server(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)和NetOGlyc 4.0 Server(https://services.healthtech.dtu.dk/service.php?NetOGlyc-4.0)预测蛋白的糖基化修饰位点;应用NetPhos 3.1 Server(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)预测蛋白的磷酸化位点。
六、W541蛋白抗原表位的预测
1.B细胞表位的预测:应用在线软件IEDB(http://tools.iedb.org/bcell/)对该蛋白的B细胞抗原表位进行预测。输入氨基酸序列,通过KarpIus&Schulz分析柔韧性、Kolaskar和Tongaonkar预测抗原性、Emini预测抗原表面可及性、Parker预测亲水性,Chou和Fasman法预测氨基酸编码蛋白质的β转角,对B细胞表位进行联合预测分析;最后选取亲水性与表面可及性良好、柔韧性强、抗原性好、最好为卷曲和转角这种可能性大的区域作为候选B细胞表位,尽量避开a螺旋、β折叠结构。
2.Th表位的预测:(1)应用SYFPEITHI超基序法预测Th表位,登陆网址(http://www.syfpeithi.de/),点击EPITOPEPREDICTION进入表位预测界面,输入W541蛋白氨基酸序列,对MHC类型为HLA-DRB1*0101、HLA-DRB1*0301(DR17)、HLA-DRB1*0401(DR4Dw4)、HLA-DRB1*0701、HLA-DRB1*1101、HLA-DRB1*1501(DR2b)进行远程预测,选多肽长度为15aa,取分值≥18分的序列为候选Th表位。(2)应用RANKPEP软件预测Th表位,登陆网址(http://imed.med.ucm.es/Tools/rankpep.html),输入W541蛋白氨基酸序列,在MHCII中选择亚型为HLA-DR1(DRB1*0101)、HLA-DR17(DRB1*0301)、HLA-DR4(DRB1*0401)、HLA-DR7(DRB1*0701)、HLA-DR8(DRB1*0801)、HLA-DR11(DRB1*1101)及HLA-DR15(DRB1*1501)的限制性Th细胞表位进行预测,记录有红色标记的为候选表位序列。综合分析上述两种软件的预测结果,将得分均较高的序列选为候选Th表位。
3.CTL表位的预测:(1)应用SYFPEITHI超基序法预测CTL表位,登陆网址(http://www.syfpeithi.de/),点击EPITOPEPREDICTION进入表位预测界面,输入W541蛋白氨基酸序列,选择HLA-A*02:01、HLA-A*03、HLA-B*07:02三类进行远程预测,选多肽长度为9aa,取分值≥18分的序列。(2)应用RANKPEP软件预测CTL表位,登陆网址(http://imed.med.ucm.es/Tools/rankpep.html),输入W541蛋白氨基酸序列,在MHCI中选择HLA-A*02:01(A2)、HLA-A*03:01(A3)、HLA-B*07:02 (B7)三类限制表型进行远程预测,记录有红色标记的为候选表位序列。(3)应用NetMHC软件预测CTL表位,登陆网址(http://www.cbs.dtu.dk/services/NetMHC/),输入W541蛋白氨基酸序列,选多肽长度为9aa,对MHC Ⅰ类型为HLA-A*02:01(A2)、HLA-A*03:01(A3)、HLA-B*07:02(B7)三类进行远程预测,记录有红色标记的为候选表位序列。(4)应用NetCTL软件预测CTL表位,登陆网址(http://www.cbs.dtu.dk/services/NetCTL/),输入W541 DNA疫苗氨基酸序列,选择A2、A3、B7三类表型,记录综合预测值(COMB)≥0.75的9肽为候选CTL表位。(5)应用IEDB软件预测CTL表位,登陆网址(http://www.iedb.org/),输入W541蛋白氨基酸序列,选多肽长度为9aa,对MHC Ⅰ类型为HLA-A*02:01(A2)、HLA-A*03:01(A3)、HLA-B*07:02(B7)三类进行远程预测,记录得分>0.5分的为候选表位序列。综合分析上述5种软件的预测结果,将得分均较高的序列选为候选CTL表位。
七、W541蛋白相互作用网络分析
应用STRING在线软件(https://www.string-db.org/)预测蛋白相互作用网络。
八、W541蛋白与人类蛋白的同源性分析
采用EXPASY在线软件(https://web.expasy.org/blast/)BLAST分析蛋白氨基酸序列与人类蛋白的同源性。
结 果
一、W541的序列分析
1. W541蛋白的理化性质分析:分子式为C3329H5035N923O993S24,原子总数为10 304个,由C、H、N、O、S 5种元素组成,相对分子质量为74.64463,理论等电点为6.29。共由704个氨基酸构成(图1),该蛋白中带正电荷的氨基酸残基(Arg+Lys)总数为48,带负电荷的氨基酸残基(Asp+Glu)总数为52。计算出不稳定指数为45.37,而将该蛋白质归类为不稳定蛋白质。脂溶性指数为68.85,消光系数为152 095或151 720。亲水性总平均值(GRAVY)为-0.294,属于亲水性蛋白质(图2)。
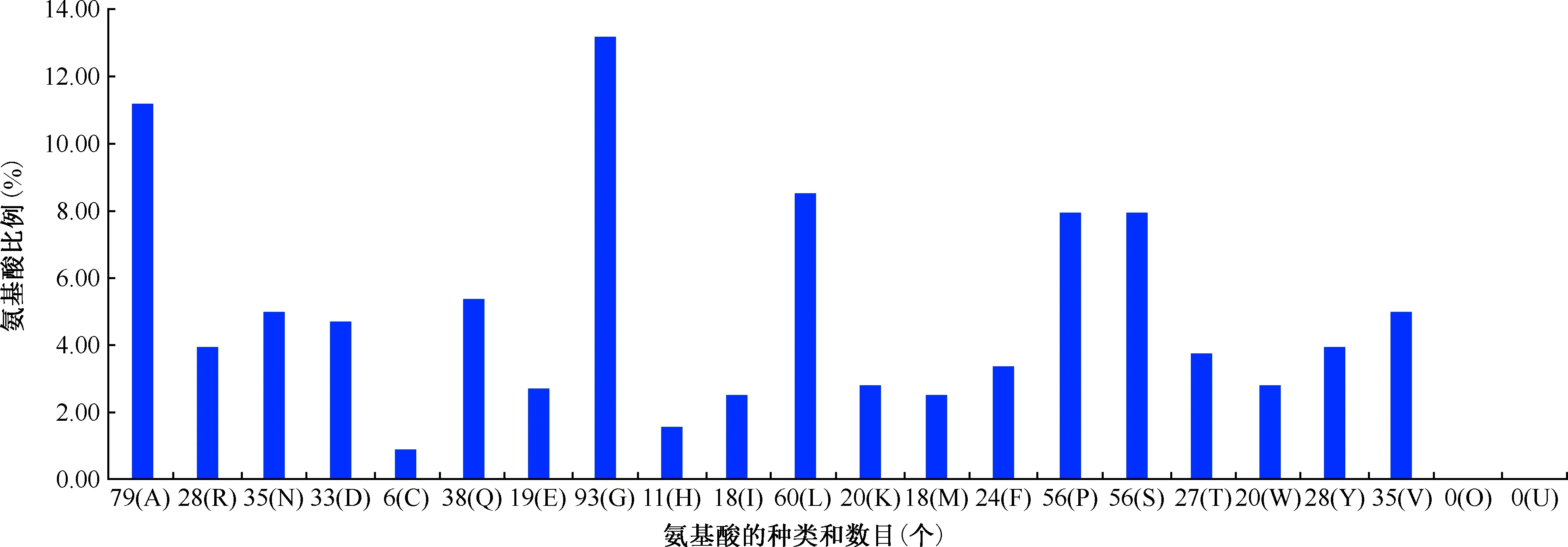
图1 MTB W541氨基酸的种类、数目及比例
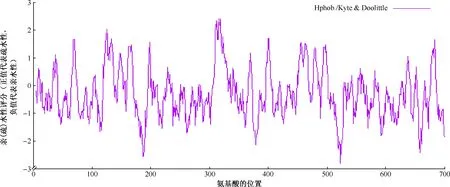
图2 MTB W541蛋白的亲(疏)水性
2.应用TMHMM软件预测跨膜结构:结果显示该蛋白跨膜螺旋氨基酸数为7.8724(该指标>18提示很有可能为跨膜蛋白),N端前60个氨基酸中跨膜氨基酸数为0.0007,N端位于膜胞质侧的总概率为0.05535。综合分析表明W541蛋白位于膜外,没有跨膜结构(图3)。
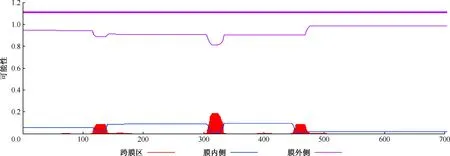
注 横坐标代表蛋白氨基酸残基序号,纵坐标的数值代表每个氨基酸位于膜内侧、膜外侧或跨膜螺旋区的概率值
二、W541的二级和三级结构分析
应用SOPMA软件预测W541蛋白的二级结构结果见图4。该蛋白二级结构中含α-螺旋(Hh)190个(占26.99%),β-折叠(Ee)134个(占19.03%),β-转角(Tt)81个(占11.51%),无规则卷曲(Cc)299个(占42.47%)。W541蛋白中α-螺旋、β-折叠和β-转角的总含量为 57.53%,提示该蛋白的二级结构可能较稳定。
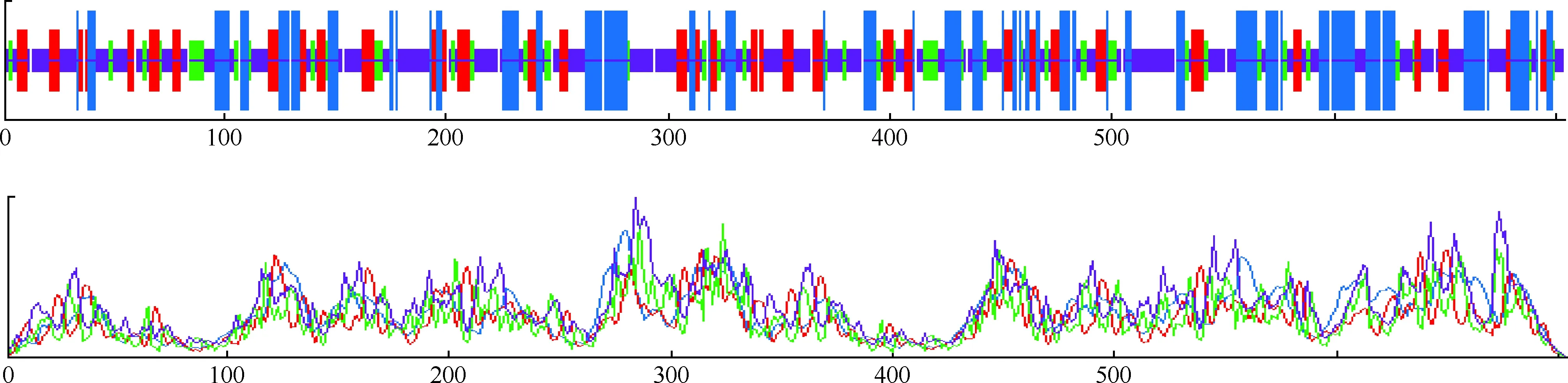
图4 MTB W541蛋白的二级结构预测
应用SWISS-MODEL服务器总共构建出3个W541蛋白三级结构模型图,本文选择模型1(图5A),其序列与MTB Ag85C蛋白的一致性为67.01%,可信度范围为0.32,待测蛋白与膜蛋白的匹配度区间为-0.82。应用MolProbity(MolProbity version 4.4)对该三级结构模型进行评估(图5B),结果显示90%以上的氨基酸残基位于可信区域内,Ramachandran异常值为0.72%,只有一个氨基酸残基SER33A出现C-β偏差而位于白色区域,证明该模型结构较可靠。
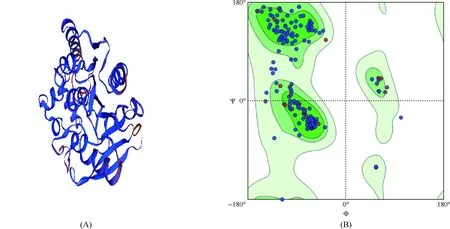
注 深绿色代表氨基酸残基在最大允许区域,中绿色代表氨基酸残基在允许区域,浅绿色代表氨基酸残基在一般允许区域,白色为不允许区域。深绿色与中、浅绿色区域一致。(A)MTB W541蛋白同源建模的三级结构图;(B)建模评价拉曼(Ramachandran)图
三、 W541蛋白质亚细胞定位注释
应用SignalP和PSORT软件分析均显示该蛋白无信号肽(图6)。应用PSORT软件对蛋白质进行亚细胞定位分析,显示该氨基酸为细菌膜蛋白质。

图6 MTB W541蛋白的信号肽预测
四、W541蛋白质翻译后的修饰
1.蛋白磷酸化位点的预测:应用NetPhos 3.1服务器预测出W541蛋白磷酸化位点62个,其中丝氨酸磷酸化位点35个,苏氨酸磷酸化位点15个,酪氨酸磷酸化位点12个(图7)。
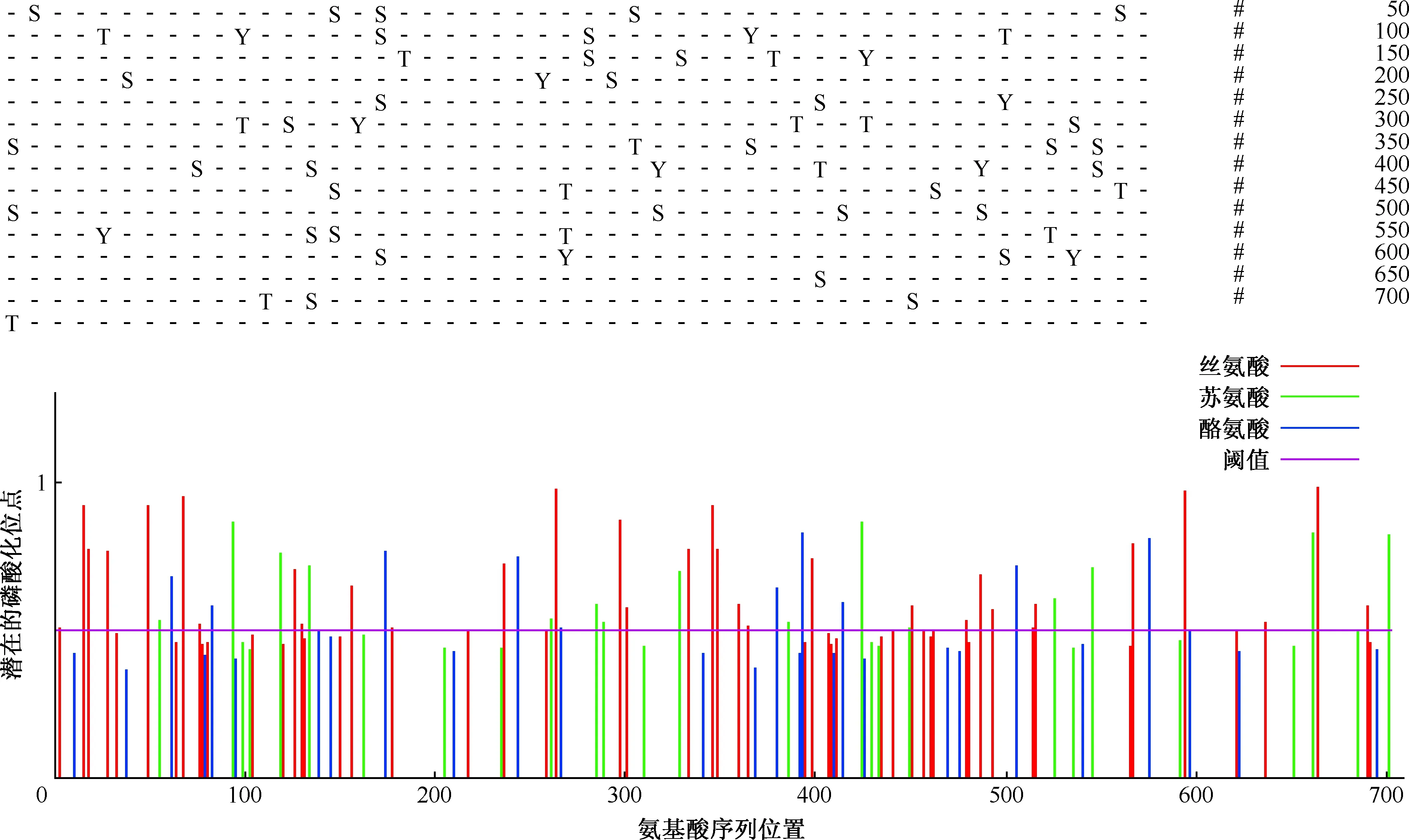
图7 MTB W541蛋白的磷酸化位点预测
2.蛋白糖基化位点的预测:应用NetNGlyc 1.0 服务器预测出W541蛋白可能存在2个N型糖基化修饰位点,分别位于203和590(图8);应用NetOGlyc 4.0 服务器预测出W541蛋白可能存在4个 O型糖基化修饰位点,分别位于285、288、297和652位点。

图8 MTB W541糖基化位点预测
五、 W541蛋白的表位预测
1.W541抗原蛋白的B细胞表位预测:通过IEDB软件对W541蛋白的B细胞表位进行预测,柔韧性越强越有利于抗原与抗体结合,柔韧性参数以基线1.0为参照,高于1.0的氨基酸区段柔韧性强,是易形成抗原表位的区域,可及性高于基线1.0的区段易形成B细胞表位,再通过结合线性表位、β转角、抗原性这3个方面筛选,筛选得出B细胞表位有4~16、34~42、64~72等23个(表1)。

表1 IEDB软件预测MTB W541蛋白的B细胞抗原表位
2.W541的Th细胞表位:利用SYFPEITHI和RANKPEP在线软件预测,分值较高的Th细胞抗原表位结果见表2、3,其中HLA-DRB1*0101、HLA-DRB1*0401及HLA-DRB1*1501表型的表位数目较多。结合HLA-DRB1*0301、HLA-DRB1*0701、HLA-DRB1*01101、表型中分值较高的表位、无法预测的HLA-DRB1*0801表型中的表位及两种预测软件的结果综合分析,判定该蛋白的优势候选Th表位主要集中在94~108、226~240、304~318等氨基酸区段。

表2 MTB W541抗原的Th表位
3.W541的CTL细胞表位:运用SYFPEITHI、RANKPEP、NetMHC和IEDB 4种生物信息学软件对W541进行预测,分值较高的CTL细胞抗原表位结果见表4、5。综合分析得出该蛋白的CTL表位数量主要集中分布于HLA-A2和HLA-B7限制性T细胞表位,少部分位于HLA-A3限制性T细胞表位,推测其最佳候选CTL表位可能位于MPVGGQSSF(70~78),AMGDAGGYK(167~175),KLIANNTRV(199~207)等氨基酸区段。

表3 MTB W541抗原的候选Th表位

续表3
表4 MTB W541蛋白的CTL表位
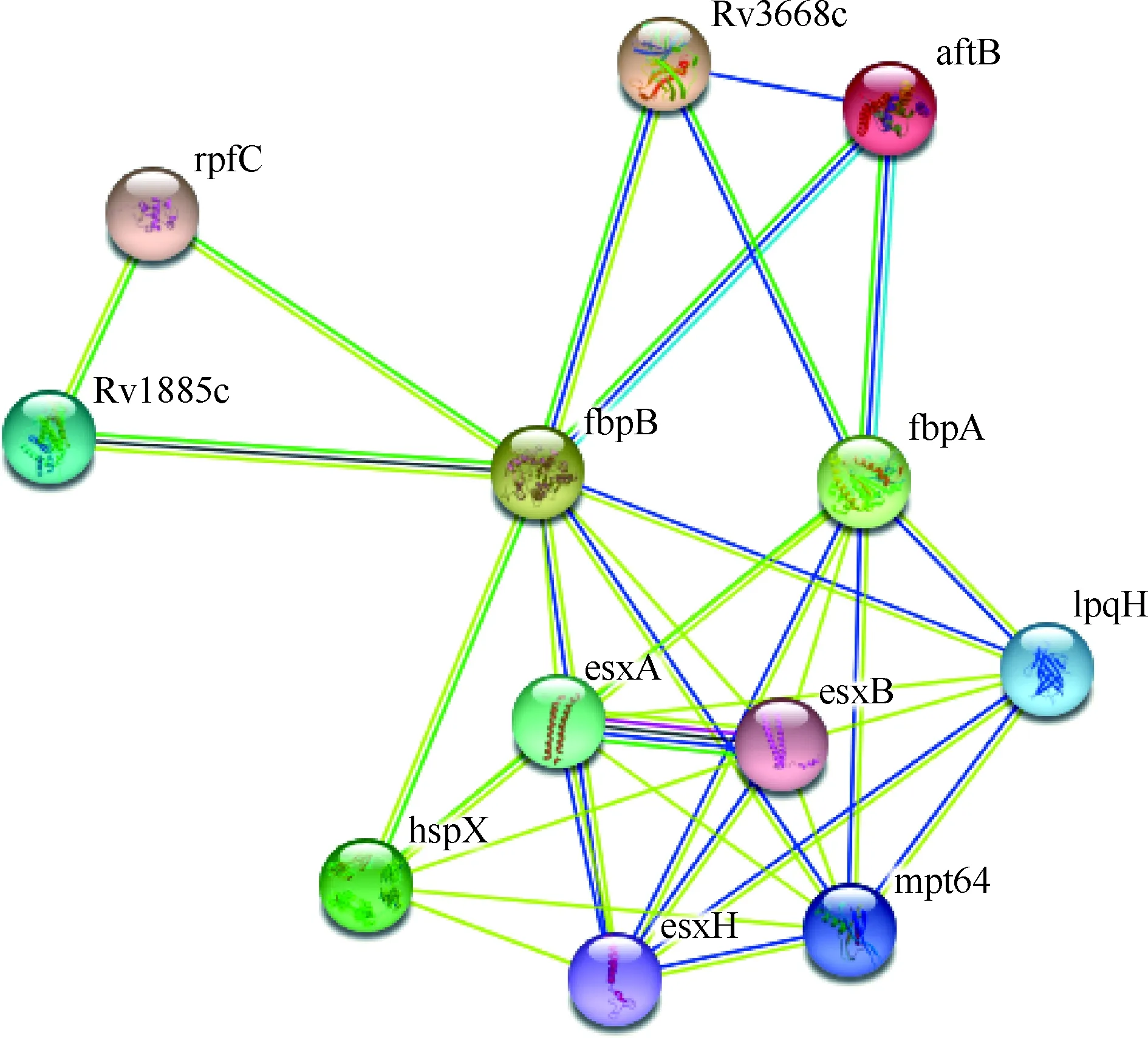
图9 MTB W541蛋白相互作用网络
六、W541蛋白相互作用网络分析结果
应用STRING服务器对W541蛋白进行蛋白质相互作用网络分析,结果显示,W541蛋白的主要组成蛋白fbpA(即Ag85A)和fbpB(即Ag85B)与10个MTB蛋白rpfC(Rv1884)、Rv1885c(即MtCM)、Rv3668c、aftB、lpqH(即Rv3763、19 kDa脂蛋白)、esxB(即Rv3874、CFP10)、esxA(即Rv3875、ESAT6)、hspX(即Rv2031c、16 kDa抗原)、esxH(即Rv0288、TB10.4)和mpt64(即Rv3036c)均存在相互作用关系(图9)。
七、W541蛋白与人类蛋白同源性分析结果
通过BLAST分析,发现W541蛋白的氨基酸序列与人输卵管相关蛋白3(tubby-related protein 3)只有3.27%(23/704)的同源性,同源性主要位于第26~92位氨基酸残基,这段同源性达到33.82%(23/68)。与人S-甲酰谷胱甘肽水解酶也只有2.70%(19/704)的同源性。由此可见,W541蛋白与人类蛋白的同源性极低。
讨 论
近年来生物信息学方法的迅猛发展和互联网数据库的开发应用,为蛋白优势表位的选择和表位串联疫苗的评估提供了有效的方法。本研究利用生物信息学方法分析MTB W541的结构及功能,为W541疫苗的进一步优化奠定了基础。
信号肽不仅与蛋白质在细胞内的定位有关,还能决定一个蛋白质是否为分泌蛋白[6]。而跨膜区的蛋白质有可能是膜偶联受体,也可能是膜偶联酶及膜离子通道等。本研究预测W541蛋白无信号肽和跨膜区,定位于细胞质膜,提示该蛋白可能为非跨膜、不分泌的细胞质膜蛋白,这与其构成的4种抗原单独预测并不完全一致,目前研究已证实Ag85A、Ag85B、Rv3407和Rv1733c均未发现信号肽[7-9],但殷月兰等[8]的预测显示Ag85A和Ag85B两者均含有一个跨膜螺旋结构,并可通过其他分泌途径释放到菌体外;而de Souza等[7]在MTB H37Rv标准株的培养滤液和细胞壁中未能检出Rv3407蛋白;刘静等[9]报道Rv1733c也是一个跨膜蛋白。由此可见,4种蛋白部分抗原表位串联后形成的W541融合蛋白的特性已发生了很大变化。
蛋白质磷酸化是一种重要的翻译后修饰,大多数蛋白质在翻译结束后需经不同程度的化学修饰才能成为具有功能的成熟蛋白质。在真核生物中,蛋白质磷酸化通常发生在丝氨酸、苏氨酸、酪氨酸和组氨酸残基上。本研究发现W541蛋白含有62个磷酸化位点,刘静等[9]和李小平等[2]预测Rv1733c/Rv3407也分别含有多个磷酸化位点,蛋白质通过这种修饰参与激素、生长因子、细胞因子和环境应激中的信号转导,诱导多种生理功能,调控细胞过程,从细胞增殖、分化、发育到细胞凋亡等[10]。因此,W541可能具有重要的调控作用。
蛋白质糖基化也是一种重要的翻译后修饰,使蛋白质在成熟过程中折叠成正确构象,可增加蛋白质的稳定性,而且这些蛋白通常与细胞信号的识别有关,如受体蛋白等。本研究发现,W541蛋白含有6个糖基化位点,也提示它具有调节蛋白质的功能作用,对于W541蛋白作为疫苗的溶解度、稳定性、半衰期和活性等都将具有重要的影响。
蛋白质的二级结构与B细胞表位关系密切。蛋白二级结构中的β-转角和无规则卷曲结构相对松散,易于扭曲、盘旋,且暴露于蛋白表面,可与抗体较好的嵌合,常含有B细胞的优势表位[11]。α螺旋和β折叠结构规则不易变形,常处于蛋白质内部,与抗体不易结合,一般不含有B细胞表位。由于W541蛋白含有较多的Ag85A和Ag85B抗原表位,因此本研究W541蛋白的二级结构和三级结构预测的结果与殷月兰等[8]对Ag85复合物预测的结果相似,都含有较大比例的无规则卷曲,它们大多位于蛋白分子表面,较可能成为优势B细胞抗原表位,而能够诱导机体产生有效的免疫应答。本研究结果显示,W541蛋白具有Th表位、CTL表位和B细胞表位,是一个T细胞抗原表位占优势的蛋白抗原,其中许多Th表位和CTL表位均已通过试验证明,如陈燕等[12]研究证实GLPVEYLQV和KLIANNTRV抗原肽是MTB Ag85A中2个主要的HLA-A*0201限制性CD8+CTL表位。殷月兰等[8]、liang等[13]、李小平等[2]、刘静等[9]的研究结果已显示W541蛋白的主要构成抗原Ag85A、Ag85B和Rv3407、Rv1733c蛋白均具有诱导细胞免疫应答和体液免疫应答的效能。郑越[14]也报道Ag85A、Ag85B DNA疫苗都具有较强的免疫原性,呈Th1型细胞介导的免疫应答。T细胞表位诱导的细胞免疫应答在抗结核免疫中发挥关键的作用;B细胞诱导的体液免疫应答在抗MTB感染过程中也发挥一定的免疫保护作用,如通过抗体的中和作用、调理吞噬作用、激活补体作用、抗体依赖的细胞介导的细胞毒性作用等,减少病理损伤,增强对MTB的杀伤作用。因此,W541蛋白可能成为理想的免疫原,为疫苗的研发奠定基础。
本研究对W541蛋白相互作用网络分析发现,W541的主要组成蛋白Ag85A和Ag85B之间不存在相互作用关系;与其存在相互作用关系的10个MTB蛋白中,大多数是分泌蛋白,而且文献报道中许多蛋白为T细胞抗原,如早期分泌抗原靶-6(ESAT-6)和培养滤液蛋白-10(CFP-10)因能诱导宿主产生强烈细胞免疫应答,成为新型结核病疫苗的热门优势抗原[15]。袁伟[16]将MTB休眠期抗原HspX与Ag85B和ESAT-6联合构建了能够在真核细胞表达融合蛋白的重组质粒pcDNA-Ag85B-Esat6-HspX,发现DNA疫苗可在小鼠体内刺激产生较强的体液和细胞免疫应答,具有较强的免疫原性。TB10.4含有CD8 T细胞表位,在整个MTB感染过程中均可诱导特异性CD8 T细胞应答,可招募特异性CD8 T细胞到感染部位并表达CD44、TNF-α和IFN-γ,上调CD8 T细胞的FasL和LAMP-1/2(CD107A/B)的表达水平,使这两种细胞具有强烈的体内细胞溶解活性[17]。MTB MPT64 DNA疫苗免疫小鼠能诱发特异的体液和细胞免疫应答,对小鼠抗MTB感染具有一定的免疫保护效力。rpfC蛋白[18]是一种复苏促进因子,作为亚单位疫苗免疫C57BL/6小鼠,可诱导机体产生特异性IgG抗体,刺激T细胞分泌高水平的Th1型细胞因子(如IFN-γ和IL-12)和低水平的Th2型细胞因子(如IL-4和IL-5),并延长结核感染小鼠的存活时间,降低其肺和脾脏中MTB数量,证明该蛋白具有一定的免疫保护作用,可作为候选疫苗组分之一。因此,W541作为疫苗可能诱导保护性免疫在抗结核感染中发挥重要作用。
W541蛋白与人类蛋白的同源性极低,若作为疫苗免疫后,不会与人类蛋白产生交叉反应,不会引起自身免疫性疾病。因此,W541具有较好的安全性。
综上所述,本研究采用生物信息学方法预测MTB W541蛋白具有多个潜在的T、B细胞抗原表位,其中以T细胞抗原表位占优势,作为疫苗的免疫原可能诱导保护性免疫应答,并发挥重要的调控作用,可作为候选疫苗进一步进行动物试验评价。
利益冲突所有作者均声明不存在利益冲突
作者贡献李鹏川:起草文章;梁艳、张林西和吴雪琼:指导文章撰写工作、对文章的知识性内容作批评性审阅
