蔗糖合成结构可控的功能性淀粉研究进展
2022-11-30张学文孙媛霞
张学文, 孙媛霞*
(1.中国科学院天津工业生物技术研究所 工业酶国家工程研究中心,天津 300308;2.国家合成生物技术创新中心,天津 300308)
随着消费者对功能食品和药物递送提出的更高需求,采用酶法制备结构可控的功能性淀粉已成为一种发展趋势[1]。直链淀粉和高支化淀粉是功能性淀粉的重要组成部分。虽然天然淀粉中存在直链淀粉,但其分离难度大、纯度低、结构不均一,限制了其在功能食品及医药等领域的应用[2-3]。高支化淀粉是天然淀粉的衍生物,具有良好的水溶性、抗降解性等特性,使其在功能食品和药物递送等方面具有广阔应用前景。以淀粉为底物酶法合成直链淀粉和高支化淀粉具有结构调控性差的缺陷[4],而以蔗糖为底物合成结构可控淀粉已成为功能性淀粉合成的新手段。作者旨在综述以蔗糖合成直链淀粉和高支化淀粉的研究进展及其在功能食品及医药等领域中的应用前景,为结构可控的功能性淀粉创新性研发提供参考。
1 直链淀粉的定向合成
1.1 蔗糖合成功能性多糖概况
蔗糖是由葡萄糖和果糖通过α-1,2糖苷键连接而成,再利用生物酶法进行深加工得到异麦芽酮糖、异麦芽糖、低聚果糖、低聚麦芽聚糖等具有高附加值的功能性糖[5-8]。近年来,以蔗糖为底物制备功能性多糖的报道逐渐增多,其中β-果聚糖、β-葡聚糖和α-葡聚糖是食品工业中具有重要应用的功能性多糖(见图1)。β-果聚糖是一类具有重要益生作用多糖,例如菊糖和果聚糖等。β-果聚糖可以促进肠道双歧杆菌增殖,改善肠道微环境,降低胆固醇和脂肪吸收[9],还具有调节血糖、降低糖尿病引起的氧化应激反应、保湿与冷冻保护的功能[10-11],已被广泛开发成稳定剂、表面形成剂、乳化剂、食品风味载体等应用于食品、医药和化工行业[12]。β-葡聚糖作为功能性食品原料,可作为食品增稠剂、膳食纤维、脂肪替代物等应用于食品工业中,同时还具有降低胆固醇、调节免疫力、改善肠道菌群等多种益生功能[13]。
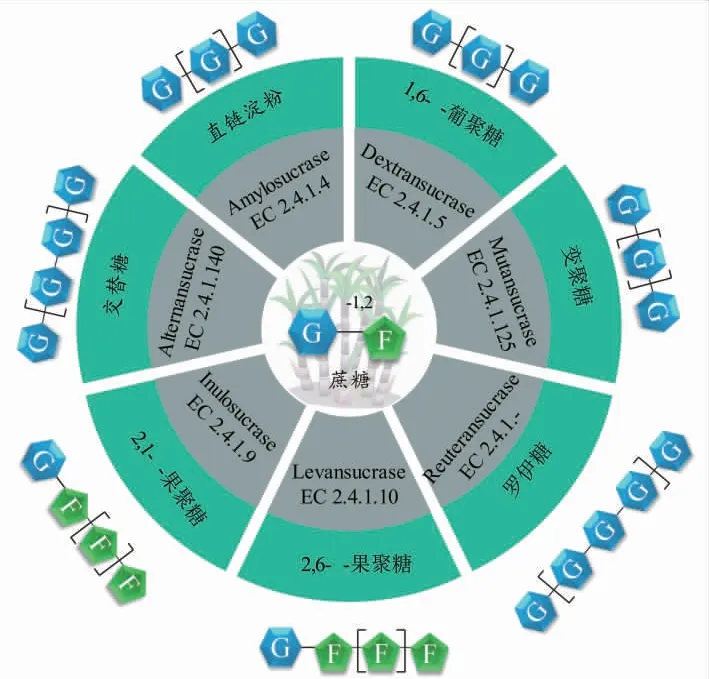
图1 蔗糖制备多功能葡聚糖和果聚糖Fig.1 Enzymatic synthesis of functional glucans and fructosans from sucrose
蔗糖作为葡萄糖供体能够合成结构丰富的功能性α-葡聚糖,包括直链淀粉、葡聚糖、Reuteran和交替糖等。多种类型的糖苷键极大地提高了功能性α-葡聚糖的结构多样性,使其具有抗消化、调节肠道微生物种群等益生作用。直链淀粉由α-1,4糖苷键连接的重复葡萄糖单元构成,是天然淀粉的重要组成部分。除作为能量来源之外,直链淀粉由于其高度可控的螺旋结构被开发为功能性高分子材料[14]。在水溶液中直链淀粉单链能够自发形成双螺旋结构,同时在内部空腔中结合客体分子形成超分子聚合物[15]。自然界中直链淀粉通常与支链淀粉相互交联形成淀粉颗粒,由于分离方法限制,高纯度的直链淀粉很难从自然界中分离获得,酶法体外合成是获得结构可控直链淀粉的有效途径[16]。
1.2 蔗糖合成直链淀粉途径
蔗糖磷酸化酶(sucrose phosphoryl ase,SP)和葡聚糖磷酸化酶(glucan phosphorylase,GP)是催化蔗糖合成直链淀粉的典型磷酸化酶体系(见图2)。SP以蔗糖为底物催化α-D-葡萄糖-1-磷酸(Glc-1-P)的合成。GP利用Glc-1-P在引物非还原端进行糖链延伸,最终合成直链淀粉[17]。GP合成直链淀粉的引物通常为麦芽寡糖,最短引物为麦芽四糖[18]。由于α-1,4糖苷键的断裂和1-磷酸键的形成需要相似的能量,因此GP催化的反应为可逆反应,除催化糖链的延伸外还可以催化α-1,4葡聚糖从非还原端磷解生成游离Glc-1-P[19]。调控蔗糖与引物的比例能在一定程度上实现直链淀粉长度的调控[20],但直链淀粉的长度还受到两种酶的比例、引物浓度、蔗糖浓度等多因素影响,这给直链淀粉定向合成造成了很大困难。
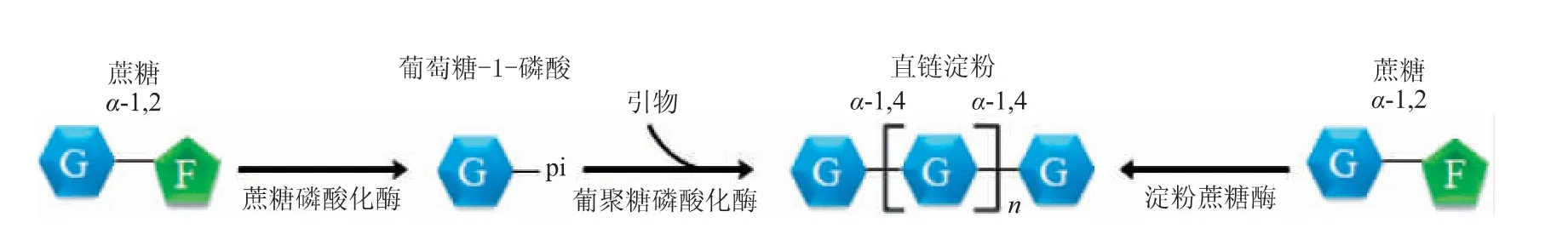
图2 蔗糖合成直链淀粉的酶促体系Fig.2 Enzymatic synthesis of amylose from sucrose
淀粉蔗糖酶(amylosucrase,ASase)催化蔗糖合成直链淀粉是直链淀粉生物合成的新途径,此方法仅需要淀粉蔗糖酶且不需要添加引物。相比于磷酸化酶合成体系,淀粉蔗糖酶体系更为简洁高效,且直链淀粉的结构仅受酶催化特性和蔗糖浓度的影响。
1.3 淀粉蔗糖酶酶学性质及催化机理
1974年,研究人员分析得到可产胞外酶的Neisseria polysaccharea菌株,而该酶可以将蔗糖催化为淀粉状聚合物[21]。1999年Montalk等报道了第一个来自N.polysaccharea的ASase基因序列(NpAS)[22],是对ASase研究的新起点。随着研究的深入,多种来源的ASase被鉴定出来,其性质比对如表1所示[5,23-30]。ASase的最适温度为30~45℃,最适pH为7.0~8.0。从表1可以发现ASase拥有较强的聚合活性,且均表现出一定的水解活性和异构活性。来自C.carbonis的CcAS产物中直链淀粉的质量分数达到84.0%,是目前已知最高水平,且水解产物葡萄糖和果糖的质量分数约7%,异构产物松二糖质量分数约10%。聚合产物直链淀粉链长分布差异较大,因此改变淀粉蔗糖酶催化特性能够实现淀粉长度的特异性调控。
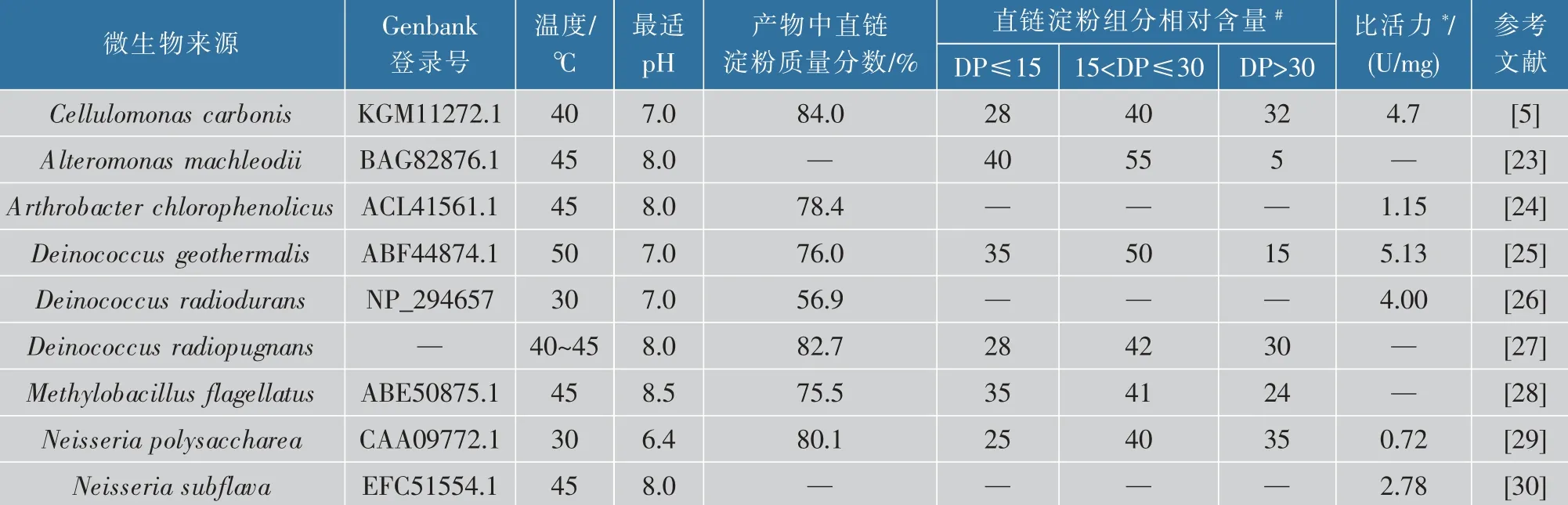
表1 不同来源淀粉蔗糖酶性质比对Table 1 Properties of amylomaltases from diverse resources
淀粉蔗糖酶属于糖苷水解酶家族13(GH13),可以进行水解、聚合等催化多种反应。淀粉蔗糖酶和其他糖苷水解酶和糖苷转移酶拥有相似的反应机理(见图3)。首先,催化中心的质子供体(Asp)对蔗糖中糖苷键进行质子化,并对葡萄糖的异头碳进行亲核攻击,形成酶与底物分子共价连接中间体。中间体与水分子或糖受体反应完成水解或转苷催化。酶分子活性中的水分子和糖受体的浓度决定了水解和转苷活性。当蔗糖是唯一底物时,淀粉蔗糖酶前期水解蔗糖获得游离葡萄糖(转苷催化受体),通过转苷催化把蔗糖中葡萄糖单元连接到游离葡萄糖受体上合成麦芽二糖,此可继续作为受体实现糖链的不断延伸,最终合成直链淀粉。
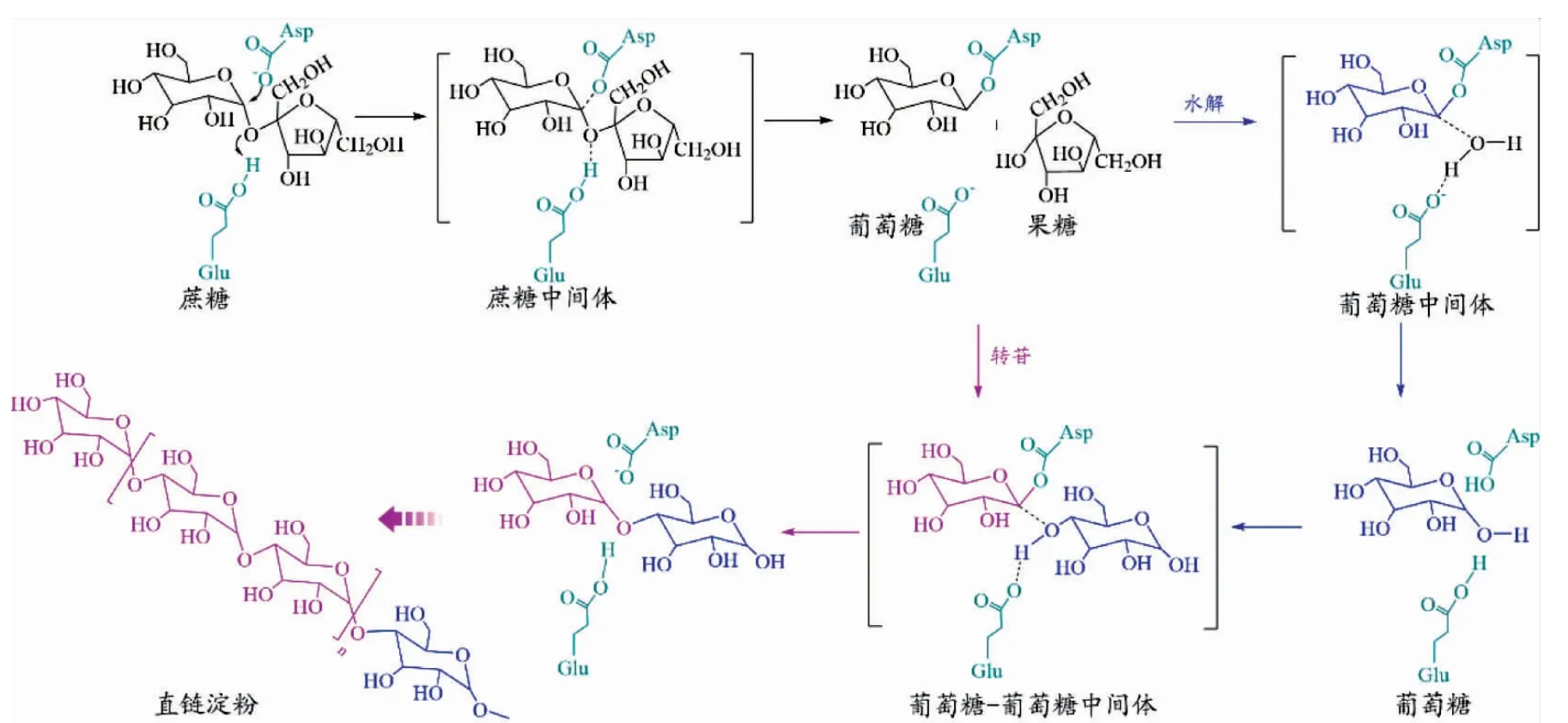
图3 淀粉蔗糖酶水解和转苷催化机理Fig.3 Reaction mechanism for hydrolysis and transglycosylation of amylosucrase
1.4 淀粉蔗糖酶结构与直链淀粉合成调控机理
以蔗糖为底物时,实现ASase合成结构可控的直链淀粉,需要对蛋白质结构和催化机理有深入认识。随着对ASase研究的深入,目前已有3种不同来源的ASase晶体结构被解析出来,分别为DgAS(PDB:3UCQ,D.geothermalis)、DrAS(PDB:4AYS,D.radiodurans)和NpAS(PDB:1G5A,N.polysaccharea)[31-33]。ASase的每个单亚基都含有5个结构域,分别为N结构域、A结构域、B结构域、B′结构域和C结构域(见图4(a))。A、B、C结构域在GH13家族中普遍存在,而N结构域和B′结构域是ASase的独有结构域。A结构域具有(β/α)8筒状结构,是具有催化能力的关键结构。N结构域和C结构域同源性非常低,研究表明N结构域和C结构域影响ASase是单体还是多聚体形态[33]。
2001年随着NpAS晶体结构被解析,位于活性中心的多个保守氨基酸(Asp144、Tyr147、His187、Arg284、Asp286、Glu328和His392)被验证与ASase聚合活性有关[34]。2002年Skov等利用酶与底物共结晶解析了NpAS的底物结合位点(见图4(b)),并预测了B结构域和B′结构域对ASase活性有重要影响[35]。NpAS活性中心含有两个催化残基(Asp286和Glu328)和7个底物结合亚位点(-1到+6),其中-1和+1是底物结合亚位点,-1亚位点包括Asp144、His187、Arg284、His392、Asp393和Arg509,是蔗糖中葡萄糖结合位置;+1亚位点包括Arg394和Asp446,是蔗糖中果糖单元的结合位置,也是麦芽寡糖中葡萄糖单元的结合位置(见图4(c))。
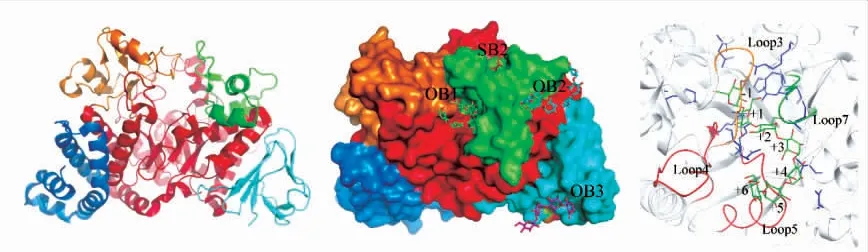
图4 淀粉蔗糖酶(NpAS:1G5A)结构域分布、底物结合位点及催化活性中心Fig.4 Crystal structure of amylosucrase(NpAS:1G5A)with multi domains,substrate binding sites,and active site
ASase最适温度通常为35~45℃,熔融温度(Tm)为40~50℃,因此较低的热稳定性限制了ASase在工业中的应用。2005年,有研究者开始对NpAS进行热稳定性改造,分子改造位点包含催化结构域A结构域、N结构域、B结构域和B′结构域。对A结构域中β-strand上的N387位点突变为天冬氨酸,在50℃时其催化活性从0增加到野生型的60%[36];针对N结构域和B′结构域构建的R20C/A451T突变体,在50℃下突变体半衰期从3 min提高到32 min,是因为R20C和A451T之间形成盐桥,同时B′结构域中的T451与Loop8中的D488形成氢键,显著增加了NpAS的热稳定性[37];A结构域-1亚位点中H392P突变体Tm从48℃提高到50℃[38]。综上,通过加强B′结构域的稳定性能显著提高ASase的热稳定性。
相较于NpAS的单亚基结构,DgAS和DrAS拥有二聚体结构且表现出较高的热稳定性,主要原因是二聚体结构改善了疏水核心,延长了盐桥网络结构,增强了氢键相互作用[33]。其中位于二聚体接触面的7个区域对二聚体的形成和稳定有重要影响(见图5)。Tian等通过比较DgAS与来自Calidithermus timidus的CtAS位于二聚体接触面7个区域的差异,并对区域4进行了截短或替换,发现突变体Tm分别从74.47℃(野生型)降低到62.46℃和64.32℃,同时60℃下催化活性几乎完全丧失,说明区域4对二聚体的稳定性具有显著影响[39],其他区域与二聚体稳定性的关系还需要进一步研究。
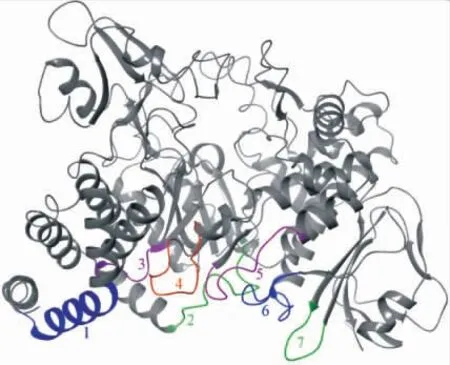
图5 DgAS二聚体结构中相互作用的7个区域Fig.5 Seven interaction regions between DgAS dimers
ASase含有3个低聚糖结合位点(OB1、OB2和OB3),其中,OB1位于催化活性中心,OB2位于B′结构域,OB3位于C结构域,OB1和OB2可能与聚合物的延伸有关[40]。随着DgAS晶体结构解析,并通过比较NpAS和DgAS的晶体结构推测ASase聚合酶活性受到催化活性中心的柔性影响,主要表现在多Loop结构的B结构域和B′结构域[33]。将DgAS和NpAS的B结构域和B′结构域互换后发现拥有来自NpAS的B结构域的DgAS不能合成DP大于12的直链淀粉,进一步确定了B结构域对聚合活性的影响[41]。通过对NpAS随机突变,位于B结构域的突变体(E227G),其聚合酶活性提高60%,产物中直链淀粉含量增加[36]。Seo等通过对DgAS位于B结构域Loop3上的3个氨基酸(P219、F225和A226)进行单点突变,P219Y突变体水解活性降低至60%,聚合活性提高1.3倍,但短直链淀粉(DP 6~15)含量增加[42];A226N突变体产物中DP 16~40的直链淀粉含量显著增加,由此说明Loop3与底物的结合密切相关,且其自由度的改变影响直链淀粉聚合度[43]。
Vergès等对NpAS的活性中心进行了理性设计,并构建了多个位置的组合突变体30H3,其聚合活性提高6倍,且产物中仅含有低聚麦芽多糖(DP 3~20)[44]。另一个突变体39A8包含11个突变位点(位于+1和+2亚位点),其聚合产物仅为麦芽二糖和麦芽三塘。30H3与39A8相比,唯一的区别在于C445A和C445R。两个突变体与野生型相比其产物中仅含有可溶性低聚麦芽糖。在晶体结构中C445位于B′结构域中的Loop7上,因此推断Loop7的自由度可能与OB1和OB2亚位点的相互作用有关。30H3突变体中G369和T398位点与野生型一致,而39A8突变体此位点发生突变是引起两个突变体产物差异的直接原因。G369和T398分别位于+2和+3亚位点,39A8突变体对多糖受体的结合能力降低,因此导致突变体不能延伸长链[43]。综上,B′结构域影响葡聚糖结合到OB2亚位点,同时影响OB1和OB2的相互作用,最终影响产物中直链淀粉的长度。因此,通过对OB1和OB2亚位点进行理性设计,能够获得结构可控的直链淀粉。
2 高支化淀粉的定向合成
2.1 糖原分支酶的挖掘及催化特性
糖原分支酶(GBE)作为合成高支化淀粉的关键酶,能够特异性催化淀粉α-1,4糖苷键连接的直链分子形成新的分支,从而增加淀粉中α-1,6糖苷键含量,是一种极具有开发价值的新型淀粉酶[45]。在CAZy数据库中,依据序列同源性GBE被归类于GH13和GH57两个家族。
迄今,已有多个GH13家族GBE用于高支化淀粉合成的报道,但相关研究依然处在对GBE催化活性和产物结构表征阶段。现有研究表明,GBE能够催化直链淀粉或天然淀粉合成不同结构的高支化淀粉,且不同来源的GBE展现出显著的催化活性差异,如表2所示[46-60]。1998年Preiss团队报道了第一个来自E.coli的EcGBE,其活性为1.1 U/mg[46];2009年Palomo等报道了来自Deinococcus的DgGBE和DrGBE,在最适温度50℃和30℃下其催化活性分别为7.2 U/mg和4.7 U/mg[47]。2020年Li等报道了来自V.vulnificus的VvGBE催化活性为10.24 U/mg,其最适温度为30℃[48]。
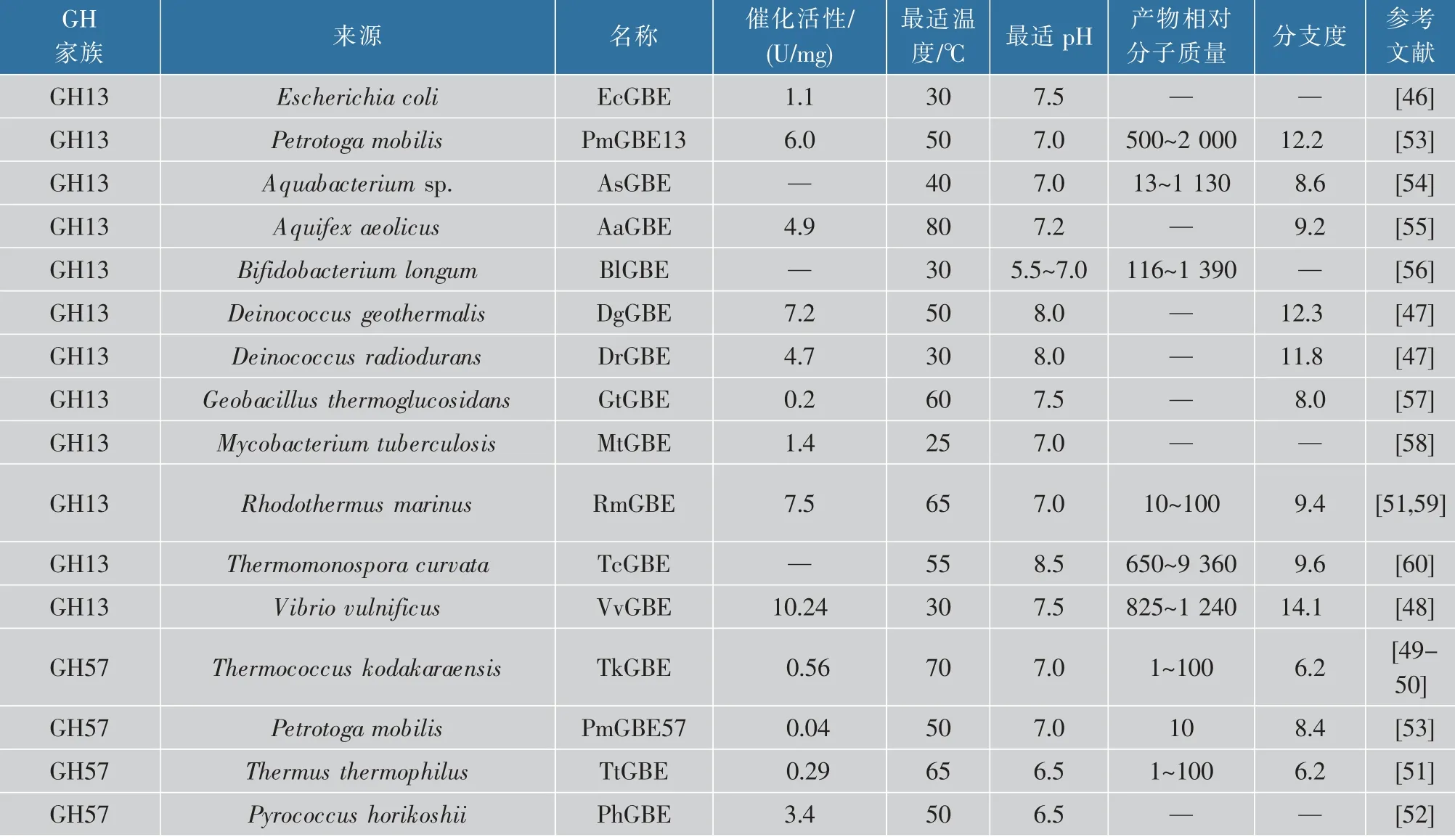
表2 已报道糖原分支酶催化特性比较Table 2 Catalytic properties of glycogen branching enzymes
目前,4个GH57家族GBE被报道。2006年有研究者等报道了第一个GH57家族糖原分支酶(TkGBE,T.kodakaraensis),其最适温度为70℃,最适pH为7.0,催化活性为0.56 U/mg[49-50]。2011年Palomo等报道了第二个GH57家族GBE(TtGBE,T.thermophilus),其催化活性为0.29 U/mg,最适温度为65℃[51],随后来源于P.horikoshii的PhGBE和P.mobilis的PmGBE57被报道,其最适温度均为50℃,催化活性分别为3.4 U/mg和0.04 U/mg[52-53]。综合分析两个家族GBE发现,限制GBE合成高支化淀粉应用的瓶颈是该酶的催化效率低且热稳定性差,GH13家族GBE催化活性普遍高于GH57家族GBE,因此更具有工业应用潜力。
2.2 糖原分支酶结构与功能的关系
目前,对糖原分支酶结构与功能的研究越来越深入,蛋白质结构数据库(Protein Data Bank,PDB)收录了7个GBE晶体结构数据(见图6),其中GH57家族GBE有3个晶体结构被解析,分别来自古 细 菌P.horikoshii(5WU7)、T.kodakarensis(3N8T)、和细菌T.thermophilus(见图6(c))。GH57家族GBE有A、B、C 3个结构域组成,其中A结构域为催化结构域,具有典型的(β/α)7桶状结构;B结构域由插入到催化结构域中的两个α-螺旋结构组成,功能不明确;C结构域由α-螺旋结构组成,是底物结合域。目前,关于GH57家族GBE研究较少,深入活性中心内部的Loop区域影响催化活性,Loop越短水解活性越高[61];位于Loop中的酪氨酸(Tyr)进行突变后,分支活性显著降低,水解活性显著增 加[48,58]。
GH13家族4个晶体结构被解析(见图6),分别来 自E.coli(1M7X)、M.tuberculosis(3K1D)、R.marinus(见图6(b))和C.subtropica(5GQU)。GH13家族GBE主要结构域为C结构域、A结构域和N结构域,其中A结构域为催化结构域,具有典型的(β/α)8桶状结构;C结构域通常有7个β-strands组成,是底物结合结构域;N结构域由一个或两个β-三明治结构单元组成,其功能不明确[58]。
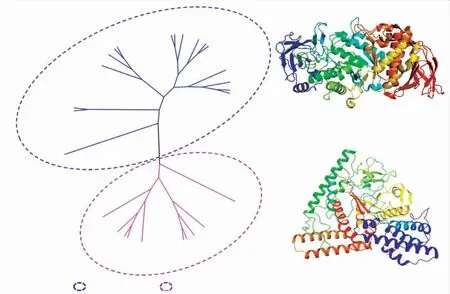
图6 糖原分支酶结构解析Fig.6 Structural analysis of glycogen branching enzyme
目前,关于GH13家族GBE的研究主要集中在基因挖掘和产物结构鉴定,尚不完全清楚GBE的催化机制。随着对高支化淀粉功能性的挖掘,影响GBE催化活性的结构基础研究逐渐引起关注。2002年Abad等报道了第一个来自E.coli的EcGBE晶体结构,通过对N端112个氨基酸敲除发现突变体和野生型催化活性没有明显变化[62];2009年Palomo等通过对来自Deinococcus的两个GBE进行了N1和N2结构域缺失或互换,发现N1和N2结构域影响产物结构,但并不影响催化活性[47];2010年Pal等报道了来自M.tuberculosis的MtGBE N1结构域缺失突变体,发现N1结构域缺失导致MtGBE催化活性从野生型1.35 U/mg降低到0.62 U/mg,Km从0.56 mg/mL降低到0.33 mg/mL,证明N1结构域对GBE催化活性有显著影响[58]。2015年有研究者选取来自V.vulnificus的VvGBE进行了N结构域缺失实验,发现N结构域与GBE转移链长有关[63]。2021年Jiang等报道了来自R.marinus的晶体结构,并对N结构域功能进行了研究,发现N结构域的缺失显著降低了RmGBE的催化活性[59]。综上可以看出N结构域对GBE的催化活性或催化特异性有重要作用,但对不同来源的GBE表现出明显差异。
2.3 糖原分支酶分子改造
探究酶与底物结合方式及途径是酶催化分子机制研究的突破口,是实现高支化淀粉结构调控的基础。1998年Binderup等通过对E.coli GBE氨基酸序列比对发现位于保守区域CSRIII上的459(E.coli numbering)位点保守性较低,对该位点进行突变后E459D突变体催化活性提高1.6倍,但对产物特异性没有显著影响[46]。2017年有研究者通过对来自G.thermoglucosidans的GBE的M349进行单点突变(M349T),使突变体的催化活性提高了35%,同时提高了产物中α-1,6糖苷键的含量[64]。Hayashi等解析了Cyanothece sp.的分支酶与麦芽七糖复合体结构,推测了分支酶可能的催化机理,并明确了活性中心-1到-7的亚位点,并对位于-7亚位点的W610进行了突变,突变体催化活性显著降低,同时产物中短链组分增加[65]。Ban等对RmGBE-7亚位点中G160位点进行突变,G160R突变体催化活性提高60%,且产物中短链组分(DP<13)质量分数从49.16%增加到55.19%[66]。综上,通过对糖原分支酶底物结合位点的改造,可以在一定程度上实现产物结构的定向调控。
2.4 高支化淀粉的酶法合成
蔗糖合成高支化淀粉的经典途径是应用蔗糖磷酸化酶、葡聚糖磷酸化酶和糖原分支酶,由于葡聚糖磷酸化酶需要引物进行聚合反应,且此反应为可逆反应,因此,此途径合成高支化淀粉的效率较低。相较于经典途径,利用ASase和GBE可提高高支化淀粉合成效率。有研究者利用NpAS和RoGBE探索了蔗糖质量浓度和双酶比例对高支化淀粉摩尔质量的影响,结果表明蔗糖质量浓度越高产物摩尔质量越大(3.7×106~4.4×107g/mol),且ASase与GBE比活力比例为1∶2时高支化淀粉摩尔质量最大,当进一步降低ASase与GBE的比例时,产物摩尔质量反而降低[67-68]。Lee等利用不同来源的ASase和GBE,再次证明了通过双酶比例能够调控高支化淀粉的结构[69],高支化淀粉的摩尔质量为7.37×105~1.94×108g/mol,分子粒径为23.70~52.65 nm。目前,仍然缺乏ASase突变体和GBE突变体合成高支化淀粉的研究。综上,ASase和GBE体外催化蔗糖合成高支化淀粉,通过调控蔗糖质量浓度、ASase与GBE比例能够实现高支化淀粉摩尔质量的调控。
高支化淀粉的另一个重要合成途径是GBE修饰天然淀粉获得。Sorndech等利用RmGBE修饰木薯淀粉制备高支化木薯淀粉,其抗性淀粉质量分数提高20%[70]。Li等利用BlGBE修饰支链淀粉制备高支化淀粉,慢消化淀粉组分提高18%[56]。
3 功能性淀粉的应用
3.1 功能性淀粉在功能食品中的应用
直链淀粉和高支化淀粉作为抗性淀粉添加到食品中可显著提高膳食纤维的含量。吴娜娜等利用含有不同直链淀粉含量的糙米淀粉制备糙米面包,发现随着直链淀粉质量分数的提高,面包中抗性淀粉质量分数增加[71]。有研究者在面包中分别添加质量分数为10%、30%和50%高直链小麦淀粉,面包硬度显著提高,且50%(质量分数)添加量的面包体积显著降低[72-73]。Ortíz-fernández等利用高直链淀粉含量的小麦淀粉制作饼干后,饼干中抗性淀粉的质量分数由2.3%提高到12.8%,显著提高了饼干的抗消化能力[74]。多项研究表明糖原分支酶制备的高支化淀粉显著增加其抗降解能力,作为食品添加剂能有效降低血糖水平[75-78],因此功能性淀粉在调节碳水代谢紊乱,尤其对肥胖病人和糖尿病人有重要意义[79]。
3.2 功能性淀粉在药物递送中的应用
直链淀粉可用于合成V型直链淀粉复合体(Vamylose complex)实现客体分子的缓释。V型直链淀粉复合体通常应用于药物递送,实现药物分子缓释,提高治疗效果。有研究者制备了直链淀粉和槲皮素的复合体,显著延长了槲皮素在胃和小肠中的释放时间[80]。Zhang等利用直链淀粉和布洛芬制备的不同直链淀粉含量的混合物,发现随着复合物中直链淀粉质量分数的增加布洛芬的释放速率显著降低,实现了药物分子在人体内的缓释,提高治疗效果[81]。丙酰化直链淀粉与药物分子制备的螺旋纳米团簇展现出优良的膜渗透性和专一性,能有效克服血脑屏障,实现药物分子的快速转运,降低药物使用剂量[82]。
高支化淀粉与糖原具有相似的结构和特性,因此可替代糖原作为药物载体,实现药物的靶向递送和缓释。Besford等开发了连接乳糖的糖原载体,此载体对前列腺癌细胞中花生凝集素具有较高亲和力并与半乳糖凝集素相互作用,实现了癌细胞的高清成像[83]。Wojnilowicz等将糖原用于siRNA载体,实现了肿瘤细胞中特定基因的沉默[84]。Gálisová等研究了糖原作为抗肿瘤药物递送载体,显著提高了药物释放的靶向性,同时有效延长了药物释放时间,显著提高了对肿瘤的治疗效果[85]。Gu等制备高支化淀粉与抗坏血酸复合体,有效增加了抗坏血酸的稳定性,显著降低了抗坏血酸的释放速率[86]。以高支化淀粉作为药物载体的开发还处于起始阶段,高支化淀粉结构对药物载体特性的影响尚缺乏深入研究。
4 展望
酶法催化蔗糖合成直链淀粉和高支化淀粉具有结构可控、生产周期短、效率高等优点。将其应用在功能食品和药物载体中能有效改善食品功能和药物递送效率。围绕蔗糖合成结构可控的功能性淀粉研究,首先,需要进一步研究淀粉蔗糖酶和糖原分支酶定向合成直链淀粉和高支化淀粉的催化机制,提高酶的催化活性与热稳定性等应用特性,完善功能性淀粉结构调控的理论体系;其次,还必须研究直链淀粉和高支化淀粉结构对功能食品营养价值及药物载体特性等的影响,提高功能性淀粉在功能食品和药物递送中的创新与应用。
