羧甲基纤维素诱导提高罗伦隐球酵母对采后砂糖橘抗青霉、绿霉病的生防效果
2022-11-30马电通吕鹤飞常雪苗黄二宾杜嵘宇田登娟
马电通,吕鹤飞,常雪苗,黄二宾,杜嵘宇,田登娟,王 芳,2,邓 佳,3,*
(1.西南林业大学林学院,云南 昆明 650224;2.西南林业大学 西南地区生物多样性保育国家林业和草原局重点实验室,云南 昆明 650224;3.西南林业大学 西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224)
砂糖橘(Citrus reticulatacv. Shatangju)又名十月橘、冰糖橘等,原产于广东四会,是芸香科柑橘属植物,砂糖橘果实颜色橙黄、皮薄、易剥离,其果肉具有爽脆、汁多、清甜等特点[1],砂糖橘果实含有多种对人体有益的营养物质,如蛋白质、VC、可溶性固形物、矿质元素(Ca、Mg、Na、K)和微量元素(Fe、Mn、Cu、Zn)等[2]。但柑橘属植物果实在采后运输贮藏过程中容易发生青霉、绿霉病害[3],其中以意大利青霉(Penicillium italicum)、扩展青霉(Penicillium expansum)和指状青霉(Penicillium digitatum)引起的柑橘青霉、绿霉病是柑橘类果实贮藏运输过程中为最严重、发生率最高的病害[4]。目前,柑橘类果实采后的贮藏保鲜方式主要为化学杀菌剂[5-6],但化学杀菌剂具有毒性、抗药性、危害人类健康和污染生存环境等缺点[7],因此需寻找新的防治方法来代替化学杀菌剂的使用,从而达到安全、高效和大量应用的防治目的。拮抗酵母作为生物防治手段中的一种,因具有不产生毒素、安全系数高、可与化学物质配合使用等多种优点[8-9],被应用于采后果品贮藏病害的防治。但拮抗酵母单独作用于果实,其拮抗效力不及化学杀菌剂[10],研究表明,通过添加糖类保护剂可以有效提高酵母的存活率、耐受性和抗逆性,从而保证其生防效力,如Zhao Lina等[11]研究发现,使用0.5%海藻糖诱导培养Pichia caribbica酵母处理采后草莓,可显著降低草莓接种灰霉病的发病率,增强草莓多酚氧化酶(polyphenoloxidase,PPO)、过氧化物酶(peroxidase,POD)和β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)等防御酶的活力,从而表现出较好的生防效力;闫岩等[3]研究发现,1.2%几丁质诱导汉逊德巴利酵母(Debaryomyces hansenii)(107CFU/mL)处理砂糖橘果实,能够降低对砂糖橘果实接种指状青霉(P. dititatum)的发病率和腐烂指数,还提高了果实体内GLU活力。
羧甲基纤维素(carboxymethyl cellulose,CMC)是纤维素的羧甲基化衍生物,是一种多糖类物质,呈白色或淡黄色纤维状粉末状,无臭、无味,在食品中具有广泛的用途,常作为食品的添加剂和果蔬的保鲜剂[12-13]。在果实应用方面,张方艳等[14]研究发现,猕猴桃果实经不同浓度CMC浸泡处理后,均能降低果实的腐败率和质量损失率,其还能使猕猴桃果实营养质量保持在较高水平;张晶琳等[15]研究发现,将CMC作为涂膜材料用于柑橘果实,能保持柑橘果实营养质量、减少果实表面气孔数量及开孔率,降低果实营养消耗及其质量损失率。但CMC能否用作生防酵母菌的保护剂,其对酵母生防效力是否有诱导增效作用还不清楚。因此,本实验采用CMC作为糖保护剂诱导培养罗伦隐球酵母(Cryptococcus laurentii),研究CMC诱导酵母对采后砂糖橘果实青霉、绿霉病害的生防效果,并探究其对果实的诱导抗病生理,以期为提高酵母对果品采后病害的生防效力提供新思路和方法。
1 材料与方法
1.1 材料与试剂
砂糖橘(Citrus reticulatacv. Shatangju)购于昆明市白龙村菜市场。从中挑选出饱满圆润、无机械伤、大小均一、无病虫害、成熟度一致的果实;用蒸馏水洗净并用体积分数75%乙醇溶液擦拭后放置于塑料筐,于室温下保存备用。
C. laurentii(ATCC18803)购于广东微生物研究所。用YM液体培养基进行培养,使用浓度为1×107CFU/mL(血球计数板计数),备用。P. expansum(引起青霉病)和P. digitatum(引起绿霉病)为前期分离自采后葡萄柚发病果实,保存于实验室,使用马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)于28 ℃培养,使用时,将病原菌孢子浓度调至1×105CFU/mL(血球计数板计数),备用。
CMC 上海腾准生物科技有限公司;蛋白胨、麦芽浸粉 北京奥博星生物技术有限责任公司;葡萄糖天津市科密欧化学试剂有限公司;酵母粉 美国赛默飞世尔科技公司;琼脂 上海致化化学科技有限公司;3,5-二硝基水杨酸 成都市科龙化工试剂厂;苯酚西陇化工股份有限公司;酚酞、亚硫酸钠、草酸、氢氧化钠、甲醇、酒石酸钾钠 天津市风船化学试剂科技有限公司;盐酸 云南杨林汕滇药业有限公司;2,6-二氯酚靛酚钠 北京博奥拓达科技有限公司。
1.2 仪器与设备
CP214电子天平 苏州赛恩斯仪器有限公司;SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;MIKRO 220R冷冻型台式高速离心机 广东市华粤仪器有限公司;HH-B11-BS-II恒温培养箱 上海跃进医疗器械有限公司;TS-2102C恒温摇床 上海天呈实验仪器制造有限公司;702型超低温冰箱 美国赛默飞世尔科技公司;70型离子交换纯水器 上海南华医疗器械;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;UV6100紫外-可见分光亮度计 上海美谱达仪器有限公司;AF103商用制冰机 美国斯科茨曼公司;YS100型电子显微镜 日本Nikon公司;Brix手持袖珍数显折射仪 日本Atago公司。
1.3 方法
1.3.1 培养基配制
YM液体培养基:蛋白胨5.0 g、葡萄糖10.0 g、酵母粉3.0 g、麦芽浸粉3.0 g溶于1 L去离子水,pH值自然;121 ℃灭菌21 min。自然冷却后,备用。
PDA培养基:土豆200.0 g、琼脂20.0 g、葡萄糖20.0 g溶于1 L去离子水,pH值自然;121 ℃灭菌21 min,趁热倒于平皿中,自然冷却后,备用。
1.3.2 CMC诱导培养时间对C. laurentii抑制砂糖橘青霉、绿霉病效果分析
参照王芸[16]的实验方法略作修改,将处理好的砂糖橘置于超净工作台,并分为两组。第一组:在果实赤道部位用已消毒的打孔钉等距均匀地打3 个孔(直径4 mm、深约5 mm),每个孔打入20 μL诱导酵母液,分别为添加0.5%(质量分数,下同)CMC诱导培养24、48 h和72 h的C. laurentii菌悬液(0.5% CMC-C. laurentii,CMC诱导浓度选择参照本课题组前期实验结果[17]及未发表研究结果),2 h后,分别向每个孔中,再打入20 μLP. expansum孢子悬浮液;第二组:果实回接处理同上,再接种20 μLP. digitatum孢子悬浮液。不同诱导时间的诱导酵母液处理重复3 次,整个实验重复2 次,共36 个果实。果实接种完毕后,置于塑料筐室温条件(25 ℃、相对湿度80%)保存,每天观察果实病斑直径和发病率,至果实病斑相接即停止观察。采用十字交叉法测量果实病斑直径/cm。发病率按下式计算。

1.3.3 CMC-C. laurentii处理对砂糖橘果实抗青霉、绿霉病效果分析
参照1.3.2节的操作方法略作修改,把已处理好的砂糖橘果实分别打孔,每个孔分别打入20 μL以下溶液,对照组(CK):无菌水;处理组1(C. laurentii):未添加CMC,培养72 h的C. laurentii菌悬液;处理组2(0.5% CMC-C. laurentii):添加0.5% CMC,培养72 h的C. laurentii菌悬液。2 h后,把上述3 种处理果实分别均匀分为两组:第一组分别再向每个孔中回接20 μLP. expansum孢子悬浮液;第二组回接20 μLP. digitatum孢子悬浮液。每个处理分别用3 个果实,每个果实打3 个孔,整个实验重复2 次,共24 个果实。果实接种完毕后,置于塑料筐室温条件(25 ℃、相对湿度80%)保存,每天观察果实发病率和病斑直径,至CK组全部发病即停止观察。发病率计算和病斑直径测量同1.3.2节。
1.3.4 砂糖橘果实抗病酶活力和抗性物质含量的测定
参照1.3.2节的操作方法略作修改,把已消毒处理的果实分为3 组,分别于下列溶液中浸泡3 min;CK组:无菌水;处理组1(C. laurentii):未添加CMC培养72 h的C. laurentii菌悬液;处理组2(0.5% CMC-C. laurentii):0.5% CMC培养72 h的C. laurentii菌悬液。每组处理5 个果实,重复3 次,共45 个果实。在处理后每隔一天对果皮、果肉分别取样,置于-80 ℃冰箱保存待测,果皮用于抗病防御酶活力和抗性物质含量测定(第2、4、6、8天取样),果肉用于果实营养品质指标测定(第0、8天取样)。
防御酶活力测定:β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)、几丁质酶(chitinase,CHI)、苯丙氨酸酶(phenylalanine ammonia lyase,PAL)和多酚氧化酶(polyphenoloxidase,PPO)采用相应试剂盒进行测定,以每分钟每克组织在每1 mL反应体系中于相应波长下吸光度变化1为一个酶活力单位。
抗性物质含量测定:总酚含量和类黄酮含量参考曹建康等[18]的方法进行测定,单位为OD280nm/g、OD325nm/g。
1.3.5 砂糖橘果实营养品质指标的测定
如1.3.4节所述,不同组(CK、C. laurentii、0.5%CMC-C. laurentii)处理果实于浸泡处理后第0、8天取果肉进行果实营养质量测定分析,参考曹建康等[18]的实验方法测定如下指标:可溶性固形物质量分数(soluble solid content,SSC)使用Brix手持袖珍数显折射仪进行测定;可滴定酸(titrate acid,TA)质量分数使用NaOH滴定法进行测定;抗坏血酸(ascorbic acid,ASA)质量分数采用2,6-二氯酚靛酚滴定法进行测定;还原糖质量分数使用3,5-二硝基水杨酸法进行测定。
1.4 数据处理与分析
以上实验指标测定重复3 次。采用Excel 2010软件进行数据统计,并使用Origin 2019软件进行图表绘制,采用SPSS 20.0软件对数据进行单因素方差分析和邓肯氏多重比较,P<0.05为差异显著。
2 结果与分析
2.1 CMC诱导培养时间对C. laurentii抑制砂糖橘青霉、绿霉病效果的影响
由图1可知,经CMC诱导培养不同时间的C. laurentii处理后,采后砂糖橘青霉、绿霉病的发病率和病斑直径随着培养时间的延长均明显降低。诱导培养72 hC. laurentii的生防效力最佳,处理后果实P. digitatum和P. expansum的发病率均为55.56%(图1A),对应果实病斑直径仅为2.51 cm和2.07 cm,显著低于其他诱导培养时间处理组(P<0.05)(图1B)。
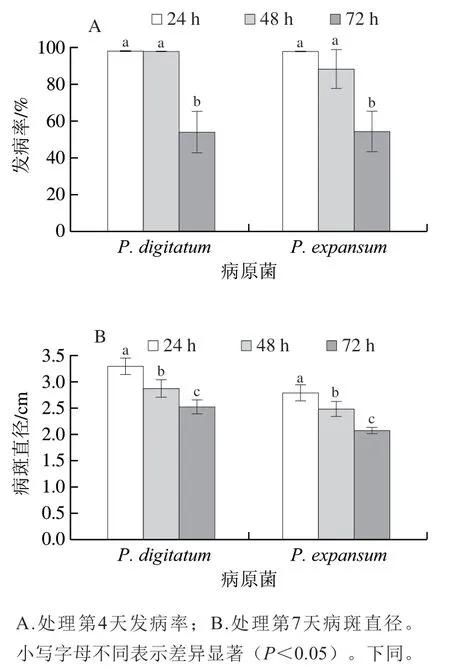
图1 不同诱导时间0.5% CMC-C. laurentii处理对砂糖橘果实青霉、绿霉病发病率(A)和病斑直径(B)的影响Fig. 1 Effect of different induction times of C. laurentii with 0.5%CMC on the incidence (A) and lesion diameter (B) of P. digitatum and P. expansum in ‘Shatangju’ mandarin fruit
2.2 CMC-C. laurentii处理对砂糖橘果实抗青霉、绿霉病效果的影响
实验结果表明,果实接种两种病原菌后均于第2天开始发病,但0.5% CMC-C. laurentii处理果实第2天未发病(表1)。处理第4天,CK组处理果实P. digitatum、P. expansum发病率均为100%,0.5% CMC-C. laurentii处理的两种病原菌果实发病率均为55.56%,显著低于其他处理组(P<0.05)。0.5% CMC-C. laurentii处理对果实病斑直径的抑制效果也很明显。实验结果显示,贮藏时间为第5天时,0.5% CMC诱导C. laurentii对于砂糖橘果实的青霉、绿霉病病斑直径的抑制效果显著优于未诱导的C. laurentii处理组,较C. laurentii处理组P. digitatum、P. expansum病斑直径减小了52.23%和33.91%。
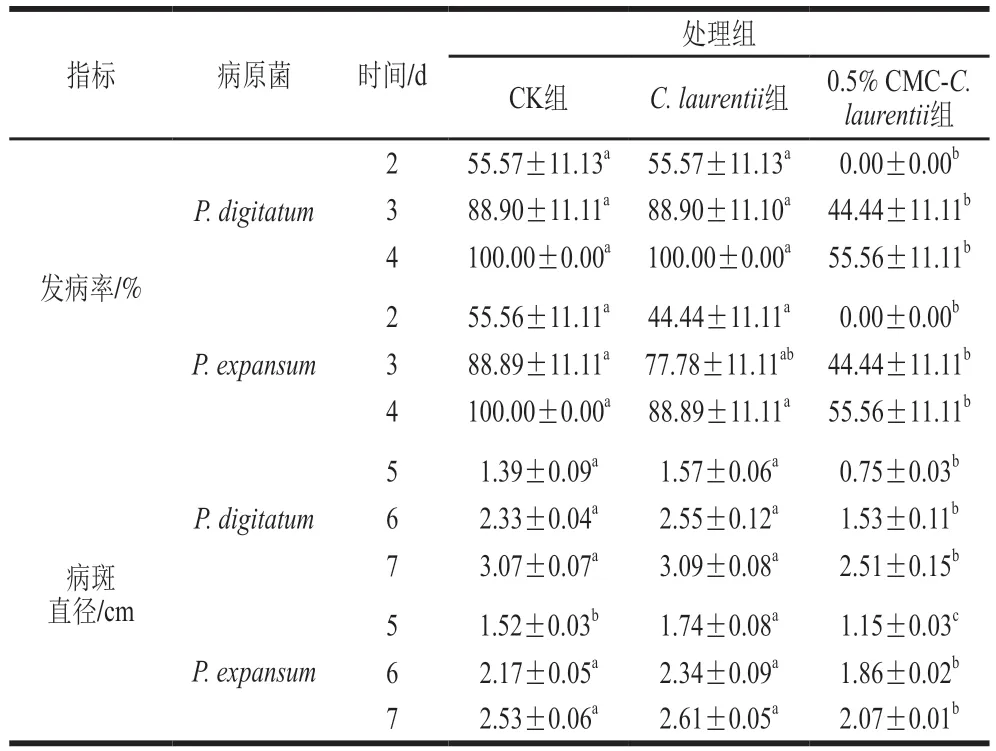
表1 CMC-C. laurentii处理对砂糖橘果实发病率和病斑直径的影响Table 1 Effect of CMC-induced C. laurentii culture on the incidence and lesion diameter of ‘Shatangju’ mandarin fruit
2.3 CMC-C. laurentii处理诱导对砂糖橘果实抗病酶活力和抗性物质含量的影响
2.3.1 果实抗病酶活力的变化
由图2A可知,砂糖橘果皮PPO活力在贮藏期间总体呈波动上升趋势。酵母处理砂糖橘果皮PPO活力呈稳定缓慢上升情况。贮藏前期C. laurentii处理果皮PPO活力高于0.5% CMC-C. laurentii处理,于贮藏第6天差异显著(P<0.05)。随贮藏时间延长,0.5% CMC-C. laurentii处理诱导促进果皮PPO活力增加,贮藏第8天,0.5% CMC-C. laurentii处理组PPO活力分别是CK组C. laurentii处理组的1.53 倍和1.12 倍(P<0.05)。
如图2B所示,在贮藏期间,采后砂糖橘果皮PAL活力整体维持相对平稳趋势。C. laurentii处理果皮PAL活力在贮藏前期(2~4 d)显著高于其他处理组(P<0.05)。相反,0.5% CMC-C. laurentii处理砂糖橘果皮PAL活力在贮藏早期相对较低,随贮藏时间延长,0.5% CMC-C. laurentii处理对果皮PAL诱导作用增加,贮藏后期该处理组果皮PAL活力显著上升,贮藏第8天显著高于其他处理组(P<0.05)。
由图2C可知,随着贮藏时间的延长,砂糖橘果皮CHI活力总体呈先上升后下降的趋势。贮藏期间(第2、4、6天)酵母诱导处理(C. laurentii处理)比CK组果皮CHI活力显著提高(P<0.05),其促进作用在贮藏前期比后期更明显。0.5% CMC-C. laurentii处理在贮藏前期的诱导促进作用不明显,但随贮藏时间延长,贮藏第8天该处理组果皮的CHI活力显著提升(P<0.05),分别是CK组和C. laurentii处理组的1.68 倍和1.72 倍。
如图2D所示,在贮藏期间,酵母诱导处理果皮的GLU活力呈持续上升趋势。C. laurentii处理果皮贮藏第6、8天时GLU活力显著高于CK组(P<0.05)。0.5%CMC-C. laurentii浸泡处理果皮的GLU活力贮藏期间始终显著高于CK组果实,贮藏第8天时,该处理组果皮GLU活力是CK组的5.18 倍。从图中可看出,酵母处理均促进果皮GLU活力上升,相对未经CMC诱导培养的酵母处理果皮,其酶活力缓慢上升,0.5% CMC-C. laurentii处理果皮的GLU活力在贮藏第8天时急剧增加,是C. laurentiii处理的1.35 倍(P<0.05)。
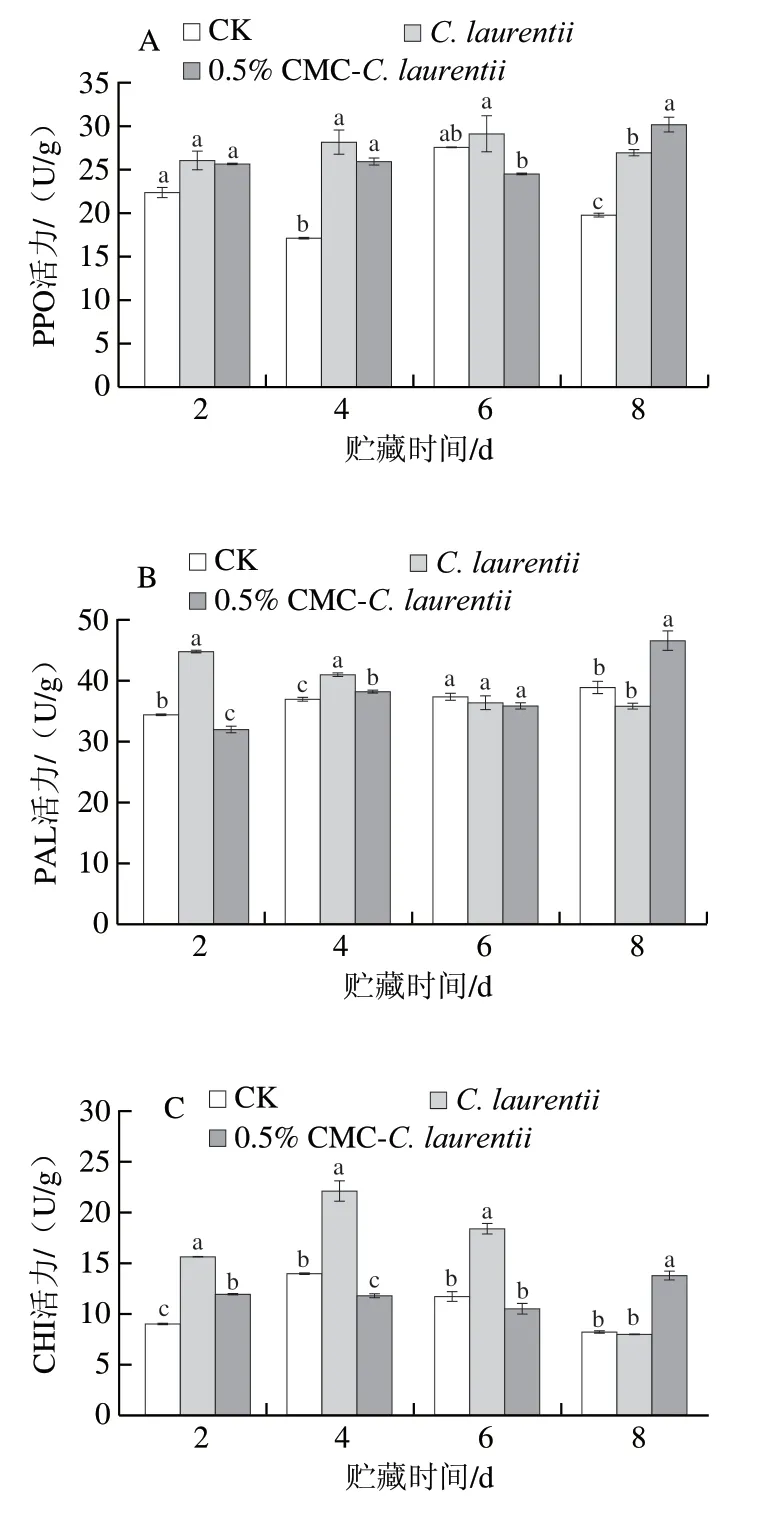
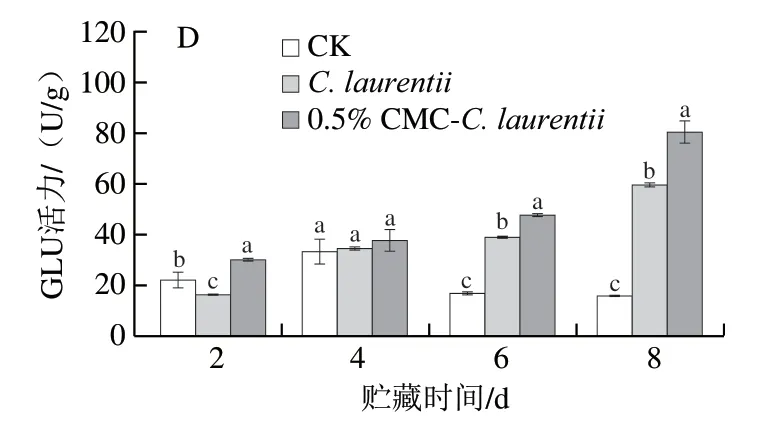
图2 CMC-C. laurentii处理对砂糖橘果皮PPO(A)、PAL(B)、CHI(C)和GLU(D)活力的影响Fig. 2 Effect of CMC-induced C. laurentii culture on the activities of PPO (A), PAL (B), CHI (C) and GLU (D) in the peel of ‘Shatangju’mandarin fruit
2.3.2 果实抗性物质含量变化
如图3所示,在贮藏过程中,添加/未添加CMC培养C. laurentii诱导处理果皮总酚含量变化与类黄酮含量变化趋势相似。如图3A所示,C. laurentii诱导处理果皮的总酚含量在第6、8天时与CK组处理无显著差异(P>0.05)。0.5% CMC培养C. laurentii诱导处理果皮类黄酮含量呈上升趋势(图3B),在贮藏第4、6、8天时显著高于其他处理组(P<0.05)。
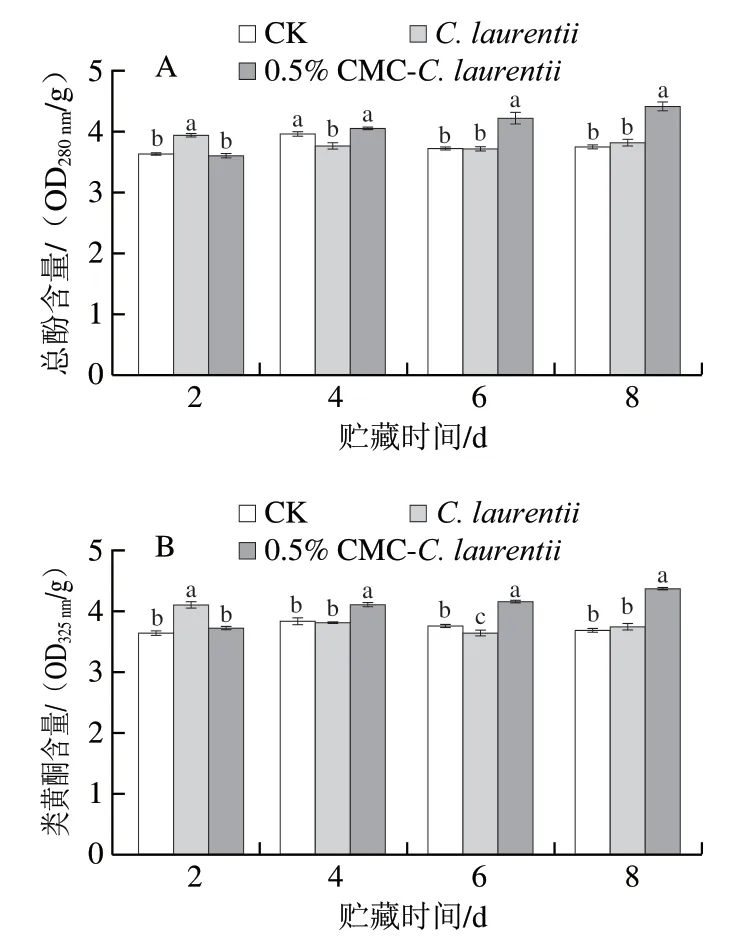
图3 CMC-C. laurentii不同处理对砂糖橘果皮总酚含量(A)和类黄酮含量(B)的影响Fig. 3 Effect of CMC-induced C. laurentii culture on the contents of total phenols (A) and flavonoids (B) in the peel of ‘Shatangju’ mandarin fruit
2.4 CMC-C. laurentii处理对砂糖橘果实营养品质的影响
CMC-C. laurentii处理对砂糖橘果实营养品质的影响如表2所示,在贮藏第8天,0.5% CMC-C. laurentii处理一定程度抑制果实体内ASA质量分数和TA质量分数的下降,其中对TA的作用效果较其他组显著(P<0.05)。此外,C. laurentii不同处理能显著抑制果实组织中SSC的升高(P<0.05),另外,0.5%CMC-C. laurentii处理能维持果实在贮藏期间的还原糖质量分数,但与CK组差异不显著(P>0.05)。因此,该实验结果表明,随着贮藏时间的延长,经0.5% CMC-C.laurentii处理的砂糖橘果实在贮藏期间能够保持较好品质,无负面影响。
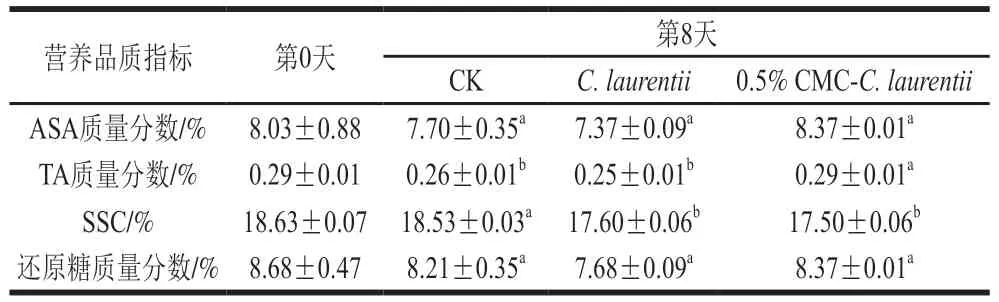
表2 CMC-C. laurentii不同处理对砂糖橘果实品质的影响Table 2 Effect of CMC-induced C. laurentii culture on fruit quality of‘Shatangju’ mandarin after storage
3 讨 论
采后青霉、绿霉病是柑橘类果实贮藏运输中最容易发生的病害[19]。果实抗病效果最直观的外在表现形式为果实发病率和病斑直径的变化[20]。目前,有研究证实,添加外源多糖诱导培养可以显著提高拮抗酵母的生防效力,如葡聚糖、海藻糖、壳聚糖、几丁质等[11]。另外,添加几丁质诱导培养Rhodosporidium paludigenum可提高酵母在梨、苹果、樱桃、西红柿和柑橘果实采后对病害的生防效力,促进R. paludigenum酵母抗氧化能力,促进CHI等胞外水解酶分泌[21]。顾宁[22]研究发现,添加0.5%壳聚糖诱导培养酵母处理对采后草莓灰霉病的发生具有明显抑制作用,通过转录组、蛋白质组学分析,推测壳聚糖诱导培养促进酵母生长繁殖、菌株活力及其在果实表面定植能力,从而提高酵母生防效果。本课题组利用转录组技术和生物信息学对0.5% CMC诱导培养24 h的C. laurentii的差异基因进行分析,结果表明,0.5% CMC诱导后酵母生长繁殖、能量供应等相关基因的表达量上调,促进酵母快速繁殖[17]。另外,Zhao Lina等[11]研究发现,使用0.5%海藻糖诱导培养Pichia carribbica处理采后草莓,防御酶(PPO、POD和GLU)活力得以升高,且对草莓灰霉病的发生有显著的抑制作用,从而表现出一定的生防效力。在本实验中,0.5% CMC-C. laurentii处理的砂糖橘果实接种P. expansum、P. digitatum病原菌后,果实发病率和病斑直径显著小于CK组和C. laurentii组(P<0.05)。结果表明,添加CMC诱导培养C. laurentii,增加酵母的繁殖速率,便于其在伤口表面快速增殖,从而增强酵母的生防效力。
植物苯丙烷代谢是植物抗病防御体系形成的关键途径之一。PAL作为植物苯丙烷代谢途径中许多次生代谢物质,如黄酮类物质、酚类物质、木质素和水杨酸等合成途径中的关键酶和限速酶,其活力的强弱直接与植物的抗病性能相关[23]。因此,在植物受到病原菌侵染后,其体内的PAL活力会升高,以此加强植物抵御对外界不良环境的影响。研究表明,PPO活力的提高能够调控木质素的合成,木质素含量的上升能够增强植物对病原菌的抗病能力,另外,PPO活力的提高还能够促进酚类物质转化为对病原菌更具毒性的醌类物质[24],进而减弱病原菌对植物的毒害作用,提高其抗病能力。蔡亚文等[25]研究发现,Pichia galeiformis处理能够一定程度控制李果实采后褐腐病,提高李果实抗病性,显示出该菌株具有较强的生物防治潜力,其生防效力与诱导果实提高PAL、POD、C4H、4CL抗性酶活力、木质素、总酚、类黄酮等抗性物质含量呈正相关。Sun Cuicui等[26]将Meyerozyma guilliermondiiY-1和褪黑素复合接种于苹果果实后,发现宿主的苯丙烷代谢相关酶(PAL、PPO)被启动,促进抗性物质(木质素、总酚)积累,诱发宿主的防御系统,增强苹果对灰霉病的抗性。本研究中,0.5% CMC-C. laurentii处理砂糖橘果实维持较高PAL、PPO活力及较高的总酚、类黄酮等抗性物质含量,从而增强砂糖橘对青霉、绿霉菌的抗病性。
GLU和CHI是植物体内两种最重要的病程相关蛋白[27],可分别降解病原真菌细胞壁的几丁质和β-1,3-葡聚糖破坏病原菌的细胞结构,从而抑制病原菌的侵染、生长和繁殖[28-29]。酵母菌也能够分泌胞外水解酶(GLU、CHI),完成对病原菌细胞壁的水解作用,进而提高拮抗酵母对病原菌的生防效力[21]。Lu Huangping等[30]研究发现,使用几丁质诱导培养R. paludigenum,能够有效抑制采后苹果青霉病害的发生,这与提高苹果中GLU、CHI活力相关。本课题组研究发现,采用C. laurentii、CMC壳聚糖复合处理有效降低葡萄柚果实绿霉病害发生,这与拮抗酵母、外源多糖协同诱导提高果实GLU、CHI活力有关[31]。本实验研究发现,0.5% CMC-C. laurentii处理的果实GLU、CHI活力增强,有效抑制青霉、绿霉菌繁殖侵染。
本实验发现,添加/未添加CMC培养C. laurentii处理,其影响采后果实防御酶活力、抗性物质含量的效果有所差异。未添加CMC培养C. laurentii在贮藏初期对果皮PPO、PAL、CHI活力及总酚、类黄酮含量的诱导作用明显,之后整体呈下降趋势,而添加CMC培养C. laurentii对果皮总酚、类黄酮含量的诱导效果变化趋势则相反,随贮藏时间延长,果皮PPO、PAL、CHI活力及总酚、类黄酮含量逐渐增加,贮藏第8天显著高于C. laurentii组(P<0.05)。上述现象的出现,推测可能是添加CMC培养对C. laurentii造成一定程度的诱导胁迫,使菌体处于缓冲适应期,期间菌体各种抗性能力较低,待适应胁迫条件后,菌体抗逆性增强,其生防效力也有所提升。本实验中,C. laurentii在CMC诱导适应期间,仍表现出较强的生防效力,推测是CMC诱导培养提高C. laurentii繁殖速率,抢占营养和生存空间,抑制病原菌生长,从而有效控制病害发生,这与本课题组前期转录组学研究结果[17]一致,即0.5% CMC诱导培养使C. laurentii细胞能量代谢和生长、繁殖相关基因上调表达。
果实在采后仍进行着一系列复杂的代谢过程,果实中SSC以及TA、ASA、还原糖质量分数可以用来有效衡量果实采后营养品质[32]。大量研究表明,采用拮抗酵母有效控制采后果实贮藏病害发生的同时不会对果实的贮藏品质造成影响(如罗伦隐球酵母防治葡萄柚绿霉病[33]、季也蒙毕赤酵母防治枇杷炭疽病[34]、葡萄汁有孢汉逊酵母防治草莓灰霉病等[35])。本研究表明,0.5% CMC-C. laurentii处理在贮藏期间能够有效维持砂糖橘果实中TA、ASA和还原糖的质量分数,抑制了SSC减小。推测可能是0.5% CMC诱导C. laurentii处理使砂糖橘果皮表面形成多糖-酵母复合膜,抑制水分损失,减缓果实呼吸作用,从而降低果实内部营养物质的消耗,维持采后果实营养品质。
4 结 论
本实验结果表明,0.5% CMC-C. laurentii处理能够增强采后砂糖橘抗青霉、绿霉病效果,果实抗病防御酶PAL、PPO、GLU、CHI活力及抗性物质总酚、类黄酮含量得以提高,能强化果实自身抗病防御系统,抵御病原菌的入侵,进而增强果实采后抗病性。同时本研究表明,0.5% CMC-C. laurentii处理对砂糖橘果实贮藏品质无不利影响。综上所述,添加CMC培养诱导能够提高C. laurentii生防效力,增强C. laurentii处理砂糖橘果实抗青霉、绿霉病的能力,本研究对提高C. laurentii在果品采后生物防治的商业化应用方面具有一定的理论指导意义。
