黑参发酵对疲劳应激诱导氧化损伤的防护作用及与白参、红参和人参浆果的比较
2022-11-30李秋阳唐金鑫刘士伟邹佳琪米倩雯王丽娜毕云枫
李秋阳,唐金鑫,刘士伟,徐 萍,邹佳琪,阴 裴,米倩雯,于 雷,王丽娜,毕云枫,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林医药学院药学院,吉林 吉林 132013)
身体疲劳是一个复杂的生理过程,可以定义为依赖于剧烈运动和较大压力引起的难以维持规律的非自愿活动[1]。目前有几种理论可以解释运动后身体疲劳的潜在机制:1)乳酸和尿素氮等代谢物的过度产生和积累导致肌肉疲劳[2];2)肌肉或其他相关器官(如肝脏)中活性氧自由基(reactive oxygen species,ROS)产生引起的氧化应激损伤[3]。
近年来,研究人员广泛研究了中草药和营养食品在对抗身体疲劳方面的有益作用。已有研究发现天然产物可通过抑制代谢物产生、缓解氧化应激或改善糖原代谢来延缓疲劳并提高运动表现[4-5]。人参具有多种生物活性和药理作用,如抗肿瘤、抗疲劳[6]、抗氧化、提高机体免疫力及降糖降脂等作用[7-9]。人参炮制品主要有白参、红参和黑参[10]。与白参和红参相比,黑参具有更强的抗炎、抗肿瘤、提高免疫力等生物活性[11]。人参浆果即人参鲜果实,也具有改善与治疗心律失常和抗疲劳的功效[12]。有研究表明人参发酵后可生成多种生物活性物质,如稀有人参皂苷、多酚和氨基酸,使人参的药理功效显著提升[13],但将发酵前后白参、红参、黑参、人参浆果的抗疲劳活性与氧化应激相关性进行对比的研究还鲜见报道。
本研究旨在对比探究同一给药剂量下白参、红参、黑参及人参浆果发酵前后对于剧烈运动小鼠疲劳缓解及氧化损伤的保护作用。在小鼠游泳训练后,测定血清尿素氮、乳酸浓度及肌肉乳酸浓度;对小鼠肌肉和肝脏中糖原水平的变化进行检测。同时测定肌肉和肝脏中与疲劳相关的代谢物和氧化还原状态参数,为几种原料参的利用提供理论依据。
1 材料与方法
1.1 动物、菌株、材料与试剂
120 只雄性ICR小鼠(3~4 周龄、体质量为18~22 g)购于辽宁长生生物技术股份有限公司,生产许可证号:SCXK(辽)2020-0001;实验动物使用许可证号:SYXK(吉)2018-0023。
植物乳杆菌(Lactobacillus plantarum)由课题组从市售泡菜中分离,现保藏于吉林农业大学新资源食品开发与利用团队实验室;肠膜明串珠菌肠膜亚种(Leuconostoc mesenteroidessubsp.mesenteroides)(CICC 22184)购于中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)。
白参、红参、黑参、人参浆果(经吉林农业大学中药材学院何忠梅教授鉴定) 通化市人参交易市场;稀有人参皂苷(Rh1、Rg2、F1、Rk3、F2、Rh4、Rg3、PPT苷元、CK、Rk1、Rg5、Rh2、PPD苷元)标准品 金盛生物科技有限公司;乳酸试剂盒、尿素氮试剂盒、糖原试剂盒、蛋白含量定量试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)及丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所;红景天胶囊 四川宝兴制药有限公司;试剂均为分析纯。
1.2 仪器与设备
JY92-IIDN超声波细胞粉碎机 宁波新芝生物科技有限公司;UV-2600I型可见分光光度计 岛津企业管理(中国)有限公司;BSA224S型天平 北京赛多利斯科学仪器有限公司;HC-3018型台式高速冷冻离心机安徽中科中佳科学仪器有限公司;Multiskan FC型酶标仪赛默飞世尔科技(中国)有限公司;Sinocare安稳血糖测定仪 三诺生物传感股份有限公司;HN-2型水浴锅上海利辰邦仪器科技有限公司;BXM-30R型灭菌锅上海东亚压力容器制造有限公司;HPX-9082型数显电热培养箱 上海博迅实业有限公司医疗设备厂。
1.3 方法
1.3.1 人参发酵前后样品的制备
分别将植物乳杆菌、肠膜明串珠菌肠膜亚种按照接种量5%(体积分数,下同)加入新鲜De Man Rogosa Sharpe(MRS)培养基中,37 ℃培养24 h进行活化,然后两种菌均按照接种量5%混合接种至新鲜MRS培养基中37 ℃培养24 h备用,混合菌液中的活菌数为3.63×108CFU/mL。将白参、红参、黑参干制品粉碎,然后分别过60 目筛,将鲜人参浆果碾碎。分别取60 g人参干制品粉末和碾碎的人参浆果,加入120 mL去离子水和9.0 mL生理盐水中,混匀后即获得发酵前样品,现用现制。分别取60 g人参干制品粉末和碾碎的人参浆果,加入120 mL去离子水,接种9.0 mL植物乳杆菌-肠膜明串珠菌肠膜亚种混合菌液,室温发酵23 d后备用。鲜人参浆果于-20 ℃冻存,人参干制品于室温下贮藏。
1.3.2 总稀有人参皂苷含量的测定
1.3.2.1 人参皂苷的提取
准确称取适量1.3.1节发酵前后样品于烧杯中,按照料液比1∶3(m/V)加入无水甲醇溶液超声30 min,静置12 h后离心(3 500 r/min、10 min),收集上清液,在沉淀物中按照料液比1∶3(m/V)加入无水甲醇继续超声30 min,静置12 h后离心(3 000 r/min、10 min),收集并合并两次超声提前后的上清液,80 ℃水浴蒸发至原体积的1/2,随后加入4 倍体积的正丁醇溶液,摇匀,静置12 h后离心(3 000 r/min、10 min),将上清液50 ℃旋转蒸发至近干,加入色谱纯甲醇溶解后过0.22 μm滤膜,即得人参皂苷提取液。
1.3.2.2 高效液相色谱法测定人参皂苷含量
色谱柱为C18色谱柱(250 mm×4.6 mm,5 μm),流动相A为乙腈,流动相B为0.05 mol/L磷酸盐水溶液;梯度洗脱(0.1 min,18% A;0.1~5 min,18% A;5~20 min,21% A;20~22 min,21%~26% A;22~26 min,26%~32% A;26~46 min,32%~33.8% A;46~51 min,33.8%~38% A;51~57.7 min,38%~49% A;57.7~58 min,49%~49.1% A;58~62 min,49.1% A;62~63 min,49.1%~50.6% A;63~68 min,50.6%~59.6% A;68~69.8 min,59.6%~65% A;69.8~72 min,65% A;72~77 min,65% A;77~94 min,65%~85% A;94~97 min,18% A;97~120 min,18% A)。检测波长203 nm,流速1.0 mL/min,进样量10 μL,柱温35 ℃。采用外标法进行定量。
1.3.3 动物饲养及分组
ICR小鼠饲养于吉林农业大学动物实验中心,环境条件保持在室温(25±2)℃、相对湿度(60±5)%、12 h光照/黑暗循环,以小鼠标准饲料常规饲养,自由进食和饮水。经过1 周的适应喂养后,将小鼠随机分为10 组,每组12 只,10 个实验组分别为:空白对照组(生理盐水)、阳性对照组(红景天胶囊粉末)[14]、白参发酵前/后组、红参发酵前/后组、黑参发酵前/后组、人参浆果发酵前/后组。根据《中华人民共和国药典》(2015版)中成人人参每日摄入量,换算得小鼠的人参发酵物给药剂量为0.3~0.9 g/(kgmb·d)。参照屈青松等[13]的报道确定人参发酵物最佳给药剂量。各组小鼠分别灌胃0.5 g/(kgmb·d)不同干预物(以红景天胶囊粉末、人参干制品和人参浆果质量计),连续给药30 d。具体给药方式为将0.5 g各组干预物与2 mL生理盐水混匀后进行灌胃。
1.3.4 健康指标测定
实验开始后,称量并记录小鼠的初始体质量、最终体质量、体质量增加量,同时称量饲料质量,计算每日摄食量(消耗饲料质量/30,单位为g/d)[15]。
1.3.5 运动能力测定
每组随机选取6 只小鼠进行力竭游泳实验。小鼠连续灌胃给药30 d,末次给药30 min后,将1/10小鼠体质量的铅皮捆绑在尾部,并置于水深超过30 cm、水温恒温在(28.0±0.5)℃的游泳池中,小鼠沉入池底10 s无反应视为死亡,记录从游泳开始至死亡的时间,即为小鼠的游泳力竭时间/min,按下式计算游泳力竭时间延长率。负重游泳期间若有小鼠躬腰停止、悬浮休息,用玻璃棒搅动附近水流迫使其不停运动。

1.3.6 代谢物积累指标、能量储备指标及氧化应激指标测定
小鼠连续灌胃给药30 d,末次给药30 min后每组随机选取6 只小鼠在游泳池中运动30 min,休息20 min后摘除眼球采血约1 mL,将所得血样3 000 r/min离心20 min,分离血清[16],参考尿素氮和乳酸试剂盒说明书测定血清尿素氮和乳酸浓度(代谢物累积指标)。随后立即处死小鼠,称取0.1 g小鼠后腿肌肉,按照试剂盒说明书测定肌肉乳酸浓度(代谢物累积指标)。称取0.085 g小鼠后腿肌肉、0.075 g肝脏组织,按照糖原试剂盒分别测定肌/肝糖原含量(能量储备指标)。称取0.1 g肝组织,参考相应试剂盒说明书测定肝组织中MDA含量以及T-SOD、GSH-Px活力(氧化应激指标)[17]。
1.4 数据处理与分析
数据表示为平均值±标准偏差,采用Excel 2019软件、Originpro 8.5软件作图及SPSS 26软件进行数据分析,采用t检验进行差异显著性分析,P<0.05表示差异显著,采用Pearson相关性分析法进行相关性分析。
2 结果与分析
2.1 不同人参制品中的总稀有人参皂苷含量
采用高效液相色谱法测定不同人参制品中13 种稀有人参皂苷(Rh1、Rg2、F1、Rk3、F2、Rh4、Rg3、PPT苷元、CK、Rk1、Rg5、Rh2、PPD苷元)的含量。由表1可知,与白参相比,红参和黑参中总稀有人参皂苷含量增加;各组人参在发酵后总稀有人参皂苷含量明显增加,其中人参浆果发酵后总稀有人参皂苷含量最低(2.105 5 mg/g),黑参发酵后总稀有人参皂苷含量最高(9.487 mg/g)。

表1 不同人参制品发酵前后总稀有人参皂苷含量Table 1 Comparison of rare ginsenosides in native and fermented ginseng products
2.2 人参发酵前后样品对小鼠体质量及摄食量的影响
小鼠体质量的变化直接反映小鼠的生长情况,体质量增长或下降过快都不利于小鼠的健康。如表2所示,干预30 d后,各组小鼠的体质量随给药时间的延长而增长,各组小鼠体质量增加量差异不明显,且与空白对照组相比,阳性对照组与人参制品干预组并没有差异。观察小鼠状态,并未出现小鼠死亡,行动迟缓,行为异样等状况,说明各组药物不会促进或抑制小鼠生长,且无任何毒副作用,小鼠仍处于正常生长状态。
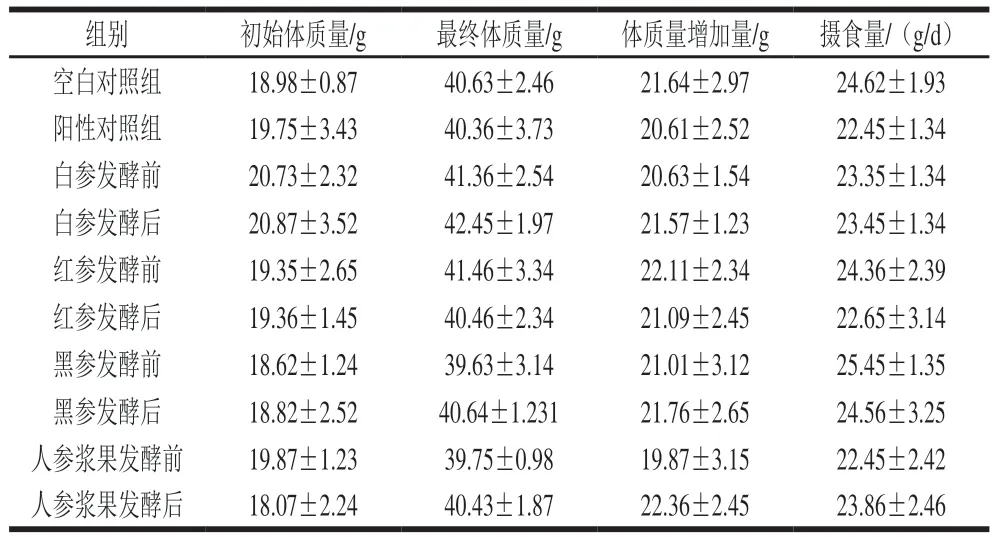
表2 干预过程中小鼠体质量及摄食量的变化(n=12)Table 2 Changes in body mass and food intake of mice during administration (n = 12)
2.3 人参发酵前后样品对小鼠运动能力的影响
运动能力是直接体现小鼠疲劳状态的方式之一。力竭游泳实验可以较好地评估小鼠的疲劳状态。小鼠游泳力竭时间越长,说明该药物的作用效果越明显。由表3可知,小鼠在给予同等药物浓度下,相对于空白对照组,阳性对照组给药小鼠游泳力竭时间极显著延长(P<0.01)。与阳性对照组相比,白参、红参、黑参及人参浆果给药组小鼠游泳力竭时间明显延长,尤其各组人参发酵后,较阳性对照组显著或极显著延长游泳力竭时间(P<0.05、P<0.01) ,以发酵后黑参效果最佳(P<0.01),游泳力竭时间延长率达到143.40%。以上结果表明不同人参制品及人参浆果发酵后比发酵前能明显延长小鼠游泳力竭时间,具有良好的抗疲劳效果。
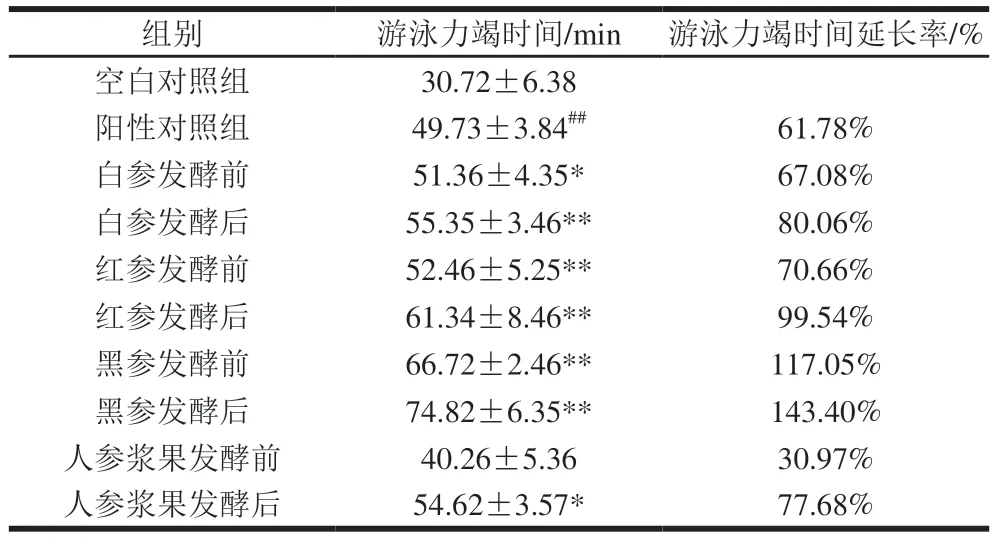
表3 药物对小鼠运动能力的影响(n=6)Table 3 Effects of drugs on exercise capacity of mice (n = 6)
2.4 人参发酵前后样品对小鼠代谢物累积指标的影响
糖酵解是短时间内剧烈运动的主要能量来源,乳酸是碳水化合物在无氧状态下的糖酵解产物[18]。因此,乳酸是运动强度或疲劳程度的重要参数之一。在进行长时间运动时,肌肉中氧气消耗加快,机体开始进行无氧代谢,糖酵解进程加速,导致大量乳酸堆积,进而影响新陈代谢及机体各系统的功能,降低运动能力并产生疲劳感[19-20]。由图1A、B可知,与空白对照组比较,阳性对照组血清乳酸及肌肉乳酸水平极显著降低(P<0.01)。与阳性对照组相比,不同人参制品干预的小鼠血清乳酸浓度呈不同程度的降低。与阳性对照组相比,在发酵前,人参浆果降低血清乳酸浓度能力稍弱,其他3 种人参制品多呈现基本相似的效果;在发酵后,黑参组降低血清乳酸浓度的效果极显著提高(P<0.01)。在降低肌肉乳酸含量方面,发酵前、后均呈人参浆果<白参<红参<黑参的趋势,以发酵后的黑参效果最好,其对应的肌肉乳酸含量与阳性对照组相比下降了12.70%。以上结果表明,小鼠在给予同等剂量药物条件下,人参发酵后对比发酵前表现出更好的缓解或清除小鼠血清及肌肉乳酸堆积,具有较好的抗疲劳效果。
长时间及高强度运动时,机体大量消耗糖原,且在没有及时补充糖原情况下,机体就会消耗蛋白质用以供能,蛋白质代谢最终生成尿素[21-22]。由图1C可以看出,与空白对照组相比,各组血清尿素氮浓度明显降低。与阳性对照组相比,除黑参发酵前组外,各给药组血清尿素氮浓度显著降低(P<0.05);在发酵前,血清尿素氮浓度为黑参<红参<人参浆果<白参;发酵后,红参及黑参组血清尿素氮浓度较阳性对照组极显著降低(P<0.01),以黑参降低效果最明显,分别为空白对照组和阳性对照组的43.91%和31.99%。以上结果表明,小鼠在给予同等药物浓度下,不同参类对降低小鼠血清尿素氮浓度效果不同,但是与发酵前黑参对比,发酵后黑参表现出较好的抗疲劳效果。
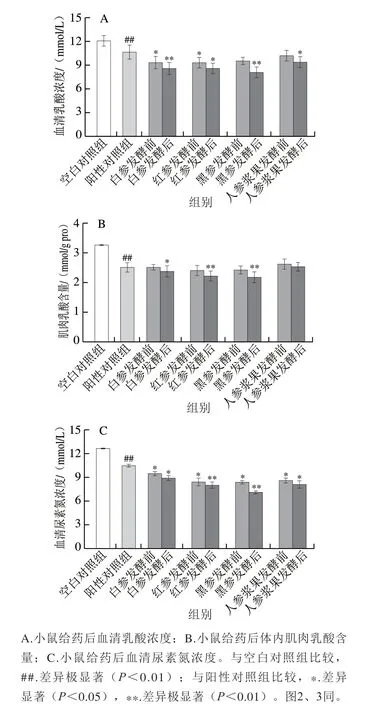
图1 人参发酵前后样品对小鼠代谢物累积指标的影响(n=6)Fig. 1 Effect of native and fermented ginseng products on metabolite accumulation indexes in mice (n = 6)
2.5 人参发酵前后样品对小鼠能量储备指标的影响
研究表明,葡萄糖是组织糖原的分解产物,在剧烈运动后作为能量利用的循环底物被释放,在运动期间,能量需求会加速肌肉葡萄糖的利用,从而增加血糖的消耗。在机体运动时,如果没有及时补充糖原,机体很容易出现低血糖的症状从而引起机体疲劳[23]。由图2A可以看出,与空白对照组相比,干预后小鼠血糖浓度出现不同程度的升高,表明运动后各组药物干预可以维持血糖浓度,降低疲劳感。
肝脏和肌肉糖原是糖酵解和能量产生底物的来源,是抵御能量消耗的第一道防线[24],因此,肝脏和肌肉中的糖原水平都是与疲劳程度密切相关的指标。在剧烈运动时,肝糖原可能分解为葡萄糖作为替代能源,然后血流将包括葡萄糖在内的营养物质输送到支持运动的工作肌肉[25]。如图2B、C所示,在运动后,与空白对照组比较,阳性对照组肌糖原和肝糖原含量极显著增加(P<0.01)。在发酵前,不同人参及人参浆果干预组小鼠的肝脏和肌肉中糖原含量呈人参浆果<红参<白参<黑参。与发酵前人参处理组相比,发酵后人参各处理组小鼠肝脏和肌肉中的糖原含量增加。黑参在发酵后糖原含量显著高于阳性对照组(P<0.05),肌糖原含量达空白对照组的2.11 倍,肝糖原含量达空白对照组的2.32 倍。这些结果表明,喂食黑参尤其是发酵后的黑参可使糖原累积物增加,从而增加小鼠耐力并延迟疲劳的发生。
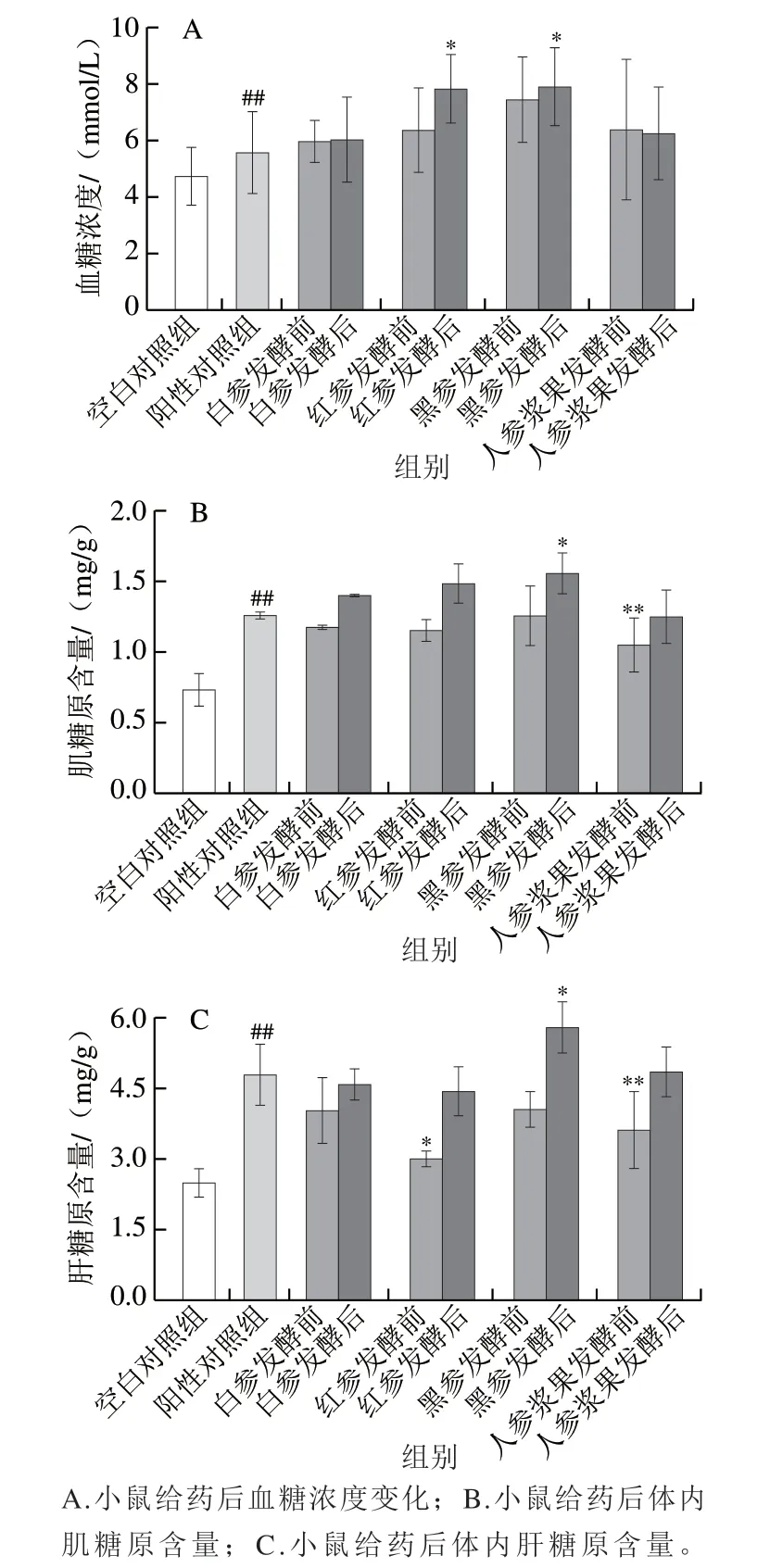
图2 人参发酵前后样品对小鼠能量储备指标的影响(n=6)Fig. 2 Effect of native and fermented ginseng products on energy reserve indexes of mice (n = 6)
2.6 人参发酵前后样品对小鼠氧化应激指标的影响
ROS在人体正常生理和病理过程中起着至关重要的作用[26]。剧烈运动使ROS含量急速增加,引起过度的氧化应激,并进一步导致不可逆的氧化损伤[27]。包括GSH-Px和T-SOD在内的细胞主要防御抗氧化酶可以防止生物大分子物质如DNA、蛋白质和脂质免受ROS的攻击。MDA是脂质过氧化的终产物,也是氧化应激的重要生物标志物[28]。因此,提升T-SOD和GSH-Px活力,降低MDA含量,可以有效减轻氧化应激造成的机体损伤,缓解或者消除疲劳。由图3A可知,对比于空白对照组,阳性对照组可极显著降低肝脏内MDA含量(P<0.01)。相比阳性对照组,发酵后的人参干制品组MDA含量极显著降低(P<0.01)。在发酵前,白参组小鼠表现出较低的MDA含量。发酵后,相对于其他组,喂食发酵后黑参的小鼠MDA含量最低,是阳性对照组的56.05%。
与空白对照组相比,阳性对照组中小鼠肝脏GSH-Px活力显著增加(P<0.05),而与阳性对照组相比,喂食人参后,各组GSH-Px活力明显提升,且在发酵前白参、红参、黑参组小鼠机体GSH-Px活力分别为阳性对照组的1.596、1.560 倍及1.593 倍。在发酵后,与阳性对照组相比,人参浆果组GSH-Px活力极显著提升(P<0.01),黑参GSH-Px活力也极显著提升(P<0.01),分别是空白对照组和阳性对照组的2.08 倍和1.75 倍。
由图3C可知,阳性对照组可极显著提高小鼠肝脏中T-SOD活力,为空白对照组的1.9 倍。各人参处理组T-SOD活力虽不及阳性对照组,但较空白对照组明显提高。发酵前红参和黑参组的T-SOD活力相近,白参和人参浆果组T-SOD活力较低,但均高于空白对照组;发酵后黑参组T-SOD活力与阳性对照组差异不显著(P>0.05),说明发酵后黑参也具有较好的抗氧化效果。
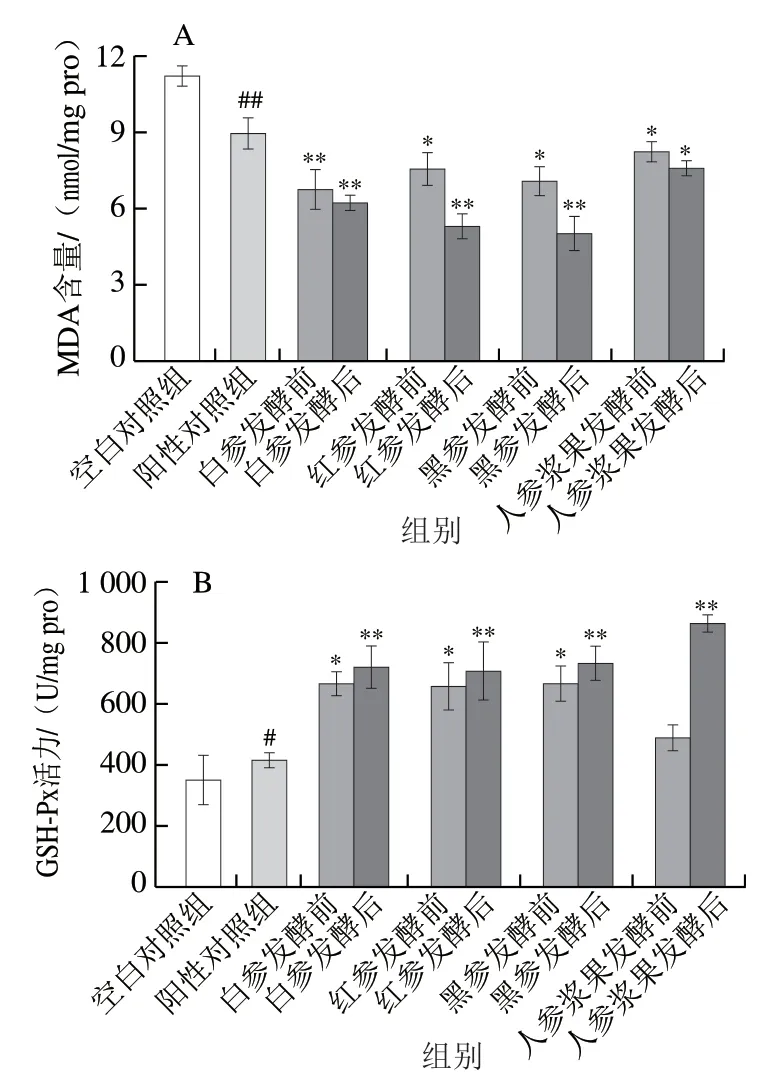
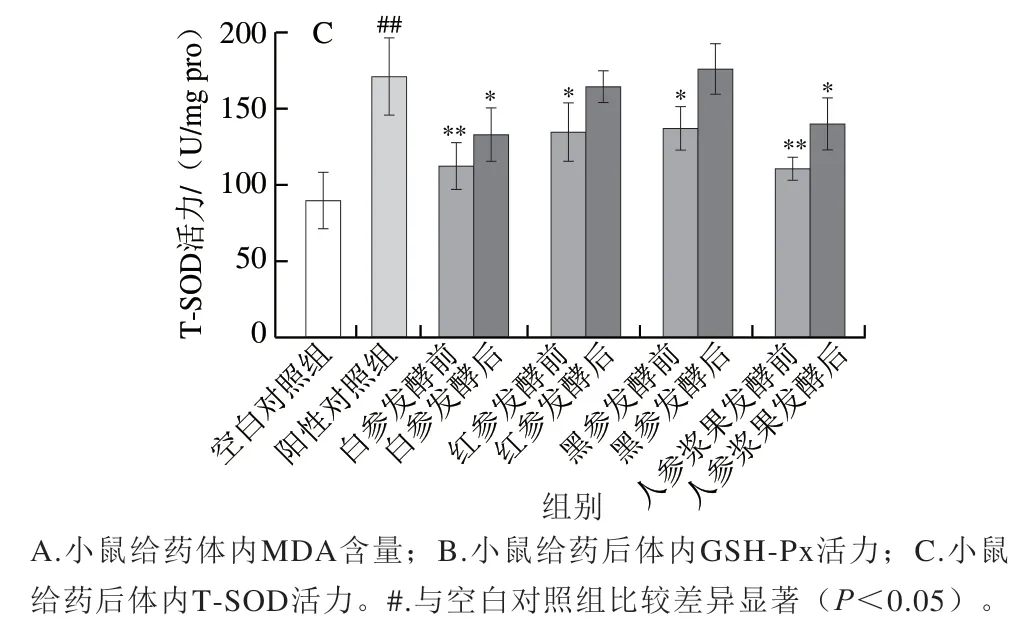
图3 人参发酵前后样品对小鼠氧化应激指标的影响(n=6)Fig. 3 Effect of native and fermented ginseng products on oxidative stress indexes in mice (n = 6)
2.7 抗疲劳指标、氧化应激指标相关性分析结果
氧化应激指标、抗疲劳指标之间的Pearson相关性分析结果如图4所示,小鼠组织中的T-SOD活力和GSH-Px活力与小鼠机体中的肝糖原、肌糖原含量呈正相关,与血清尿素氮、血清乳酸、肌肉乳酸水平呈负相关。而MDA含量与小鼠机体中的肝糖原、肌糖原含量呈负相关,与血清尿素氮、血清乳酸、肌肉乳酸浓度呈正相关。这说明小鼠体内的氧化活性与疲劳状况有较好的相关性,T-SOD活力、GSH-Px活力越强及MDA含量越低,运动产生的乳酸及尿素氮越少,越有利于糖原的储备。其中,T-SOD活力与肌糖原含量的相关系数为0.85。GSH-Px活力与血清乳酸浓度的相关系数为0.85。MDA含量与肌糖原含量相关系数为0.91。这些结果说明,人参发酵前后样品可以通过提高抗氧化酶活力,降低脂质过氧化物含量,保护机体免受氧化应激的损伤,起到抗运动疲劳的功效。
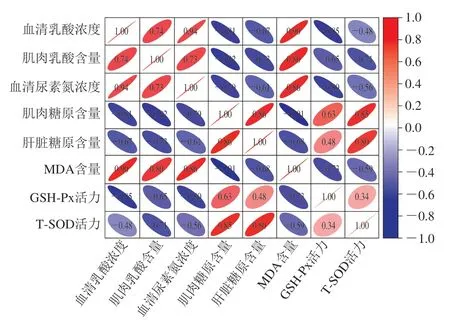
图4 人参发酵前后样品小鼠氧化应激指标与抗疲劳指标相关性分析结果Fig. 4 Correlation analysis between oxidative stress indexes and anti-fatigue indexes of mice administered with native or fermented ginseng products
3 讨 论
寻找有效的方法来缓解运动引起的疲劳一直是研究人员的关注重点。在之前的研究中广泛论证了人参皂苷的抗疲劳与抗氧化功效,Yang Qiyu等[29]研究表明Rg3可能通过提高脱乙酰酶SIRT1活力来改善运动表现和抗疲劳。稀有人参皂苷具有强大的药理功效,微生物发酵法因转化能力强被广泛应用。Zheng Ziyi等[30]的研究表明人参叶发酵后人参皂苷Rh2和Rg3的含量显著提高,可以安全地用于缓解运动引起的疲劳。本实验在此基础上利用复合菌种发酵白参、红参、黑参以及人参浆果,不同人参加工品中总稀有人参皂苷含量依次为人参浆果<白参<红参<黑参,表明黑参发酵后稀有人参皂苷总含量较高,可能具有更强的药理活性。进一步研究发现,与白参、红参和人参浆果比较,黑参发酵后样品组小鼠游泳力竭时间延长率达143.40%,血清尿素氮、血清乳酸、肌肉乳酸浓度明显降低,糖原储备效果明显,说明发酵后的黑参抗疲劳效果更好。此外,通过测定MDA、GSH-Px、T-SOD水平分析不同组的氧化应激水平发现,灌胃发酵后样品可明显降低小鼠在急性运动期间的氧化应激水平,其中以发酵后黑参的效果最佳。
相关性分析结果表明,小鼠组织中T-SOD活力和GSH-Px活力与小鼠机体中的肝糖原和肌糖原含量呈正相关,与血清尿素氮、血清乳酸、肌肉乳酸浓度呈负相关,MDA含量则呈相反的效果。因此,发酵前后人参均可以通过提高抗氧化酶活力,降低脂质过氧化物含量,保护机体免受氧化应激的损伤,起到抗运动疲劳的功效。
本实验结果表明,各组人参及人参浆果均表现出不同程度的机体保护作用,其中发酵后黑参制品具有更强的药理功效,可作为疲劳应激诱导氧化损伤防护的功能性食品。此外,本实验结果表明人参发酵后具有更强的药理功效,提示人参制品的发酵处理可作为具有应用前景的人参加工技术。
