原花青素B2对高脂膳食小鼠钙代谢及股骨基因表达谱的影响
2022-11-30张方方杨昌铭吴其国周一鸣周小理
张方方,肖 瀛,杨昌铭,吴其国,周一鸣,周小理
(1.上海应用技术大学香料香精技术与工程学院,上海 201418;2.上海城建职业学院健康与社会关怀学院,上海 201415)
高脂膳食是指脂质摄入量占总摄入能量30%以上的饮食模式,已被认为是导致机体血脂紊乱和氧化应激发生的重要原因[1-2],进而诱发肥胖、糖尿病等代谢疾病,严重影响正常生活和健康[3]。血脂紊乱和氧化应激状态的产生会介导成骨细胞和破骨细胞功能受损,抑制骨形成并促进骨吸收,从而导致骨质疏松症[4-5]。骨骼的几何形状和微结构以及骨重塑过程主要受基因表达控制,外界摄入的营养物质可通过调节基因表达来影响成骨细胞和破骨细胞相关代谢途径的蛋白表达[6]。Cao Xiangchang等[7]研究表明,高脂膳食会增加大鼠模型的骨质流失和骨骼微结构改变程度,抑制成骨细胞分化和凋亡,同时增加破骨细胞的数量,并降低骨形态发生蛋白-2的表达水平。此外,高脂膳食已被证实可造成小鼠基因表达的变化,导致各种脂质代谢过程和胰岛素信号传导途径的蛋白质编码RNA异常表达[8]。
原花青素是由黄酮类化合物聚合而成的次生代谢产物[9],常见于各种植物的花、坚果、果实、树皮和种子中[10-11],已被发现具有强抗氧化、抗菌、抗炎症及抗糖尿病等多种促健康活性[12-14]。Tenkumo等[15]研究表明,富含原花青素的葡萄籽提取物具有防止骨代谢失衡和促进骨愈合、改善骨骼健康的作用。尽管原花青素作为一种天然功能因子其活性研究是食品营养与健康领域的热点之一,然而其对高脂膳食导致骨骼组织基因表达的影响鲜见研究报道。
随着基于高通量技术的发展,转录组测序技术(RNA sequencing,RNA-Seq)由于具备高分辨率、高灵敏度、成本低等优势,逐渐成为基因表达水平、关键基因的挖掘及调控机制研究的重要手段[16]。因此,本研究以高脂膳食诱导血脂代谢紊乱小鼠为模型,评价原花青素B2(proanthocyanidin B2,PB2)对高脂膳食性钙代谢异常的干预作用,并通过RNA-Seq技术对小鼠股骨样本进行真核有参转录组分析,筛选差异表达基因(differential expression genes,DEGs),同时进行相关通路的富集分析,为进一步分析PB2对高脂模型小鼠钙代谢异常干预作用的分子机制提供一定的理论依据。
1 材料与方法
1.1 动物、材料与试剂
6 周龄SPF级C57BL/6健康雄性小鼠27 只,体质量(17.3±1.0)g,购自上海灵畅生物科技有限公司。实验动物生产许可证号:SCXK(沪)2018-0003;动物处理及饲养条件遵照动物福利的相关规定及《中华人民共和国实验动物管理条例》和《实验动物质量管理办法》实施。
实验饲料为低脂饲料、高脂饲料(Paigen饲料),具体饲料营养能量见表1,购于南通特洛菲饲料科技有限公司。实验所用垫料、饲料均经过辐照杀菌处理,饮用水经高压灭菌处理,符合SPF级动物使用标准。
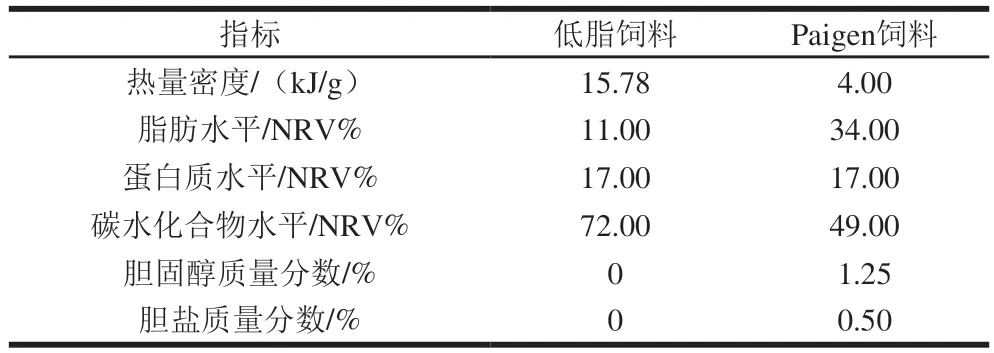
表1 饲料营养素成分Table 1 Nutrient composition of experimental diets
PB2(纯度≥90%) 上海同田生物技术有限公司;甲醛、无水乙醇、无水乙醚、氯仿、异丙醇等(分析纯)国药集团化学试剂上海有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、钙、甲状旁腺素(parathyroid hormone,PTH)含量测定试剂盒南京建成生物工程研究所有限公司;TRIzol裂解液美国Invitrogen公司;焦碳酸二乙酯(diethyl pyrocarbonate,DEPC) 上海阿拉丁生化科技股份有限公司;TruseqTM RNA sample prep Kit、HiSeq X Reagent Kits、NovaSeq Reagent Kits试剂盒 美国Illumina公司;QuantiFluor®dsDNA System-核酸提取试剂盒 普洛麦格生物技术有限公司;Agencourt AMPure XP-核酸纯化试剂盒 美国Beckman公司;Oligo(dT)美国Thermo Fisher公司;末端修复混合液 美国Enzymatics公司。
1.2 仪器与设备
PURELAB Classic型超纯水机 威立雅水处理技术(上海)有限公司;MDF-1156型低温冰箱 日本三洋机电有限公司;XW-80型混合器 江苏海门其林贝尔仪器有限公司;K280R型高速冷冻离心机 英国森特恩公司;TGL-16M型台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;磁力架 美国英杰生命技术有限公司;E6150型Quantus™ Fluorometer生物库 普洛麦格(北京)生物技术有限公司;NanoDrop2000型超微量紫外分光光度计 美国Thermo Fisher公司;qTOWER 2.2定量聚合酶链式反应(polymerase chain reaction,PCR)仪德国耶拿分析仪器股份公司;2100型生物分析仪 美国Agilent公司;NovaSeq 6000高通量测序平台 美国Illumina公司。
1.3 方法
1.3.1 动物分组及处理
6 周龄小鼠同室分笼饲养于SPF级动物房内,所有小鼠在实验前需要经过1 周的环境适应期,饲喂AIN93饲料,保持12 h明暗交替光照,温度20~24 ℃、相对湿度50%~65%,小鼠可自由摄食和饮水(去离子水)。
小鼠随机分3 组,每组9 只,对照组(CON组)饲喂低脂饲料、高脂膳食组(HF组)饲喂Paigen饲料、原花青素组(PB2组)饲喂添加0.2%(以饲料质量计)PB2的Paigen饲料。本研究采用高脂膳食诱导血脂代谢紊乱模型[17-18],PB2干预剂量根据前期研究[19]确定。所有小鼠自由摄食和饮水,持续饲喂8 周,每天观察小鼠状态,每周记录一次小鼠体质量及其食物摄入量。
1.3.2 血浆、股骨、尿液和粪便样品采集
实验结束前1 周,每组取9 只小鼠开展代谢平衡实验,分别放入代谢笼中,适应3 d后,持续收集尿液和粪便3 d,记录饲料消耗情况及粪便量和尿液量。
实验第8周末,小鼠断食不断水12 h,使用无水乙醚麻醉并称量体质量,通过摘取眼球取血。血液收集于含有1.5 mL质量分数0.1%肝素钠的离心管中,冰浴10 min后于4 ℃、3 500 r/min条件下离心15 min,取上清液于1.5 mL离心管中,-80 ℃冰箱保存,待测。
眼球取血完毕后,颈椎脱臼处死小鼠,解剖取出完整左股骨,转入装有5 mL RNAlater试剂离心管中,于-40 ℃保存待提取RNA,右股骨取出后于-20 ℃保存用于骨矿物含量测定。
1.3.3 骨矿物含量的测定
参考曹静祥[20]的方法稍加修改,股骨经清洗后烘干至质量恒定后称质量,每份股骨样品放入一支瓷舟内,并将瓷舟并排码放在一片白色瓷砖上,叠放在马弗炉中,以200 ℃为起始温度,间隔100 ℃分段升温至500 ℃灰化,并在炉温降至100 ℃以下且灰分恒质量后称质量。
1.3.4 血脂水平和钙吸收能力相关指标的测定
血浆样品于冰上解冻,股骨在室温下解冻至室温。按照试剂盒说明书相关操作进行血浆血脂指标(TC、TG、LDL-C、HDL-C)、钙浓度、PTH质量浓度和股骨钙含量测定。
采用代谢平衡法评价小鼠钙吸收能力。对采集饲料和粪便使用HNO3和HClO4(4∶1,V/V)进行消化处理,用钙含量检测试剂盒测定样品中的钙含量,依据公式(1)~(3)分别计算动脉硬化指数(atherosclerosis index,AI)、钙净吸收量和钙贮留量。
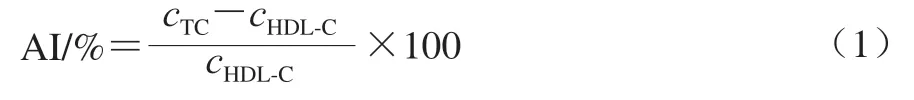
式中:cTC为TC浓度/(mmol/L);cHDL-C为HDL-C浓度/(mmol/L)。

1.3.5 mRNA测序
采用TRIzol法从股骨组织样品(股骨头近端)提取总RNA,同组每3 个样品等量合并为一份样本,具体流程如下。取定量股骨加入液氮,研磨后装入预冷的加有1 mL TRIzol的离心管中,充分振荡,裂解5 min;随后于4 ℃、13 000×g条件下离心5 min,将上清液转移入新离心管中,加入200 μL预冷的氯仿,充分振荡,静置5 min;同条件离心15 min后吸取上清液转移入新离心管中,加入与上清液体积相同的预冷异丙醇,静置10 min;同条件离心10 min后吸去上清液,加入1 mL预冷的体积分数75%乙醇溶液,吹吸混匀充分;同条件离心5 min后吸去上清液,再次离心数秒,吸除残液,静置3~5 min晾干;加入20~50 μL灭菌的质量分数0.1% DEPC溶液溶解。
利用NanoDrop2000检测RNA的浓度和纯度,琼脂糖凝胶电泳验证其完整情况,使用2100型生物分析仪测定RNA完整值,并使用带Oligo(dT)的磁珠与ployA进行配对,分离出mRNA。在mRNA样品中加入碎片缓冲液,将其打断为300 bp左右的片段,在逆转录酶的作用下,利用随机引物,以mRNA为模板反转合成稳定的双链cDNA。随后加入End Repair Mix将其补成平末端,在3’末端加上一个A碱基,用于连接Y字形的接头。
纯化产物并进行片段分选,对分选片段进行PCR扩增,纯化并构建文库。利用QuantiFluor®dsDNA System定量,按数据比例混合上机,在cBot cluster generator上进行桥式PCR扩增,生成clusters,随后进行Illumina NovaSeq6000上机测序。
1.3.6 定量逆转录聚合酶链式反应测定
实时荧光定量逆转录聚合酶链式反应(quantitative reverse transcription polymerase chain reaction,qRTPCR)能够验证RNA测序结果。提取总RNA后将其转录成cDNA,采用Taq聚合酶和EvaGreen dye荧光染料,以稀释后的cDNA为模板扩增靶基因,引物序列见表2。通过溶解度曲线评估PCR产物的特异性,所有qRT-PCR数据均采用2-ΔΔCt相对定量法[21]进行分析,并归一化为β-actin基因的相对表达量。
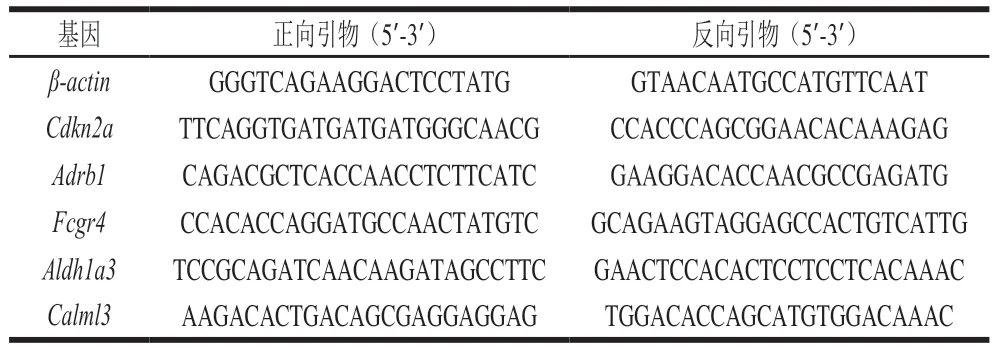
表2 qRT-PCR引物序列Table 2 Sequences of primers used for qRT-PCR
1.4 数据统计与分析
1.4.1 生化指标数据分析
小鼠生理生化指标均以平均值±标准差表示,采用SPSS 22.0软件通过Duncan’s法进行单因素方差分析,P<0.05表示差异具有统计学意义。
1.4.2 原始测序数据质控
使用SeqPrep和Sickle软件对原始测序数据进行过滤,并对质量修剪前后的序列进行数据量统计,得到高质量的测序数据以保证后续分析顺利进行。
1.4.3 基因表达量分析
使用RSEM软件对待分析数据计算基因表达情况,揭示基因功能和调控情况。表达定量的结果以每百万读长中来自于某基因每千碱基长度的转录产物数(transcripts per kilobase million,Tpm)为单位,对Tpm均一化使不同样本中的总表达量一致。
1.4.4 基因表达差异分析
使用DESeq2软件对CON、HF组和PB2组进行基因表达差异分析,鉴定出DEGs,并筛选差异共表达基因,用于后续研究。
筛选条件为错误发现率(false discovery rate,FDR)<0.05、|log2FC|≥1(FC为变化倍数(fold change)。
1.4.5 差异基因GO富集分析
使用Goatools软件和基因本体论(gene ontology,GO)数据库(http://www.geneontology.org/)进行Fisher精确检验,按照参与功能对基因进行分类,总共分为生物进程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)。对差异基因进行GO功能显著性富集分析,可以说明差异基因的功能富集情况,阐明样本间DEG在功能水平的异同。为控制计算的假阳性率,使用Bonferroni多重检验方法对P值进行校正,当经过校正的P≤0.05时,则说明此GO功能存在显著富集情况。
1.4.6 差异基因通路富集分析
使用KOBAS软件基于京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库使用Fisher精确检验进行通路富集分析。为控制计算假阳性率,采用BY(FDR)方法矫正P值,矫正P≤0.05时说明此通路为DEGs中显著富集的KEGG通路。
2 结果与分析
2.1 体质量及血浆脂质水平的变化
如表3所示,各组小鼠在实验期间体质量增加,与CON组相比,其他两组小鼠体质量降低显著,但PB2组小鼠体质量显著高于HF组(P<0.05)。HF组小鼠血浆TC、LDL-C浓度和AI显著高于CON组(P<0.05),PB2组小鼠的上述指标与HF组显著降低(P<0.05)。此外,PB2组小鼠的TG浓度显著低于其他两组小鼠(P<0.05)。长期摄入高脂膳食可使体内游离脂肪酸释放进入机体循环系统[22],导致脂质代谢异常,血浆TC水平显著升高,血浆脂蛋白组成向LDL-C转变,从而增加动脉粥样硬化风险[23]。已有研究表明,原花青素具有调节小鼠脂质代谢的能力[24],本研究结果也表明PB2可以调节高脂膳食介导的脂代谢异常,降低发生动脉粥样硬化的风险。
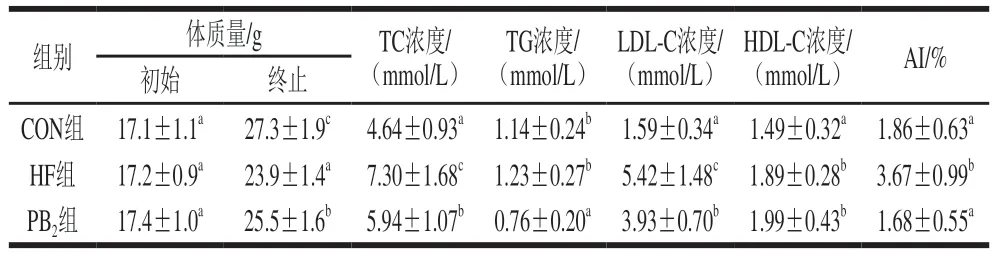
表3 PB2对小鼠体质量和血浆脂质水平的影响Table 3 Effect of procyanidin B2 on body mass and plasma lipid levels in mice
2.2 钙吸收、钙内稳态与骨矿物含量的变化
钙代谢平衡实验结果如表4所示,与CON组相比,高脂膳食小鼠(HF组)钙摄入量降低,粪钙排泄量和尿钙量增加(P>0.05),钙净吸收量和钙贮留量显著降低(P<0.05)。与HF组相比,PB2组钙净吸收和钙贮留量显著增加(P<0.05),钙净吸收量与钙贮留量有向CON组水平恢复的趋势。
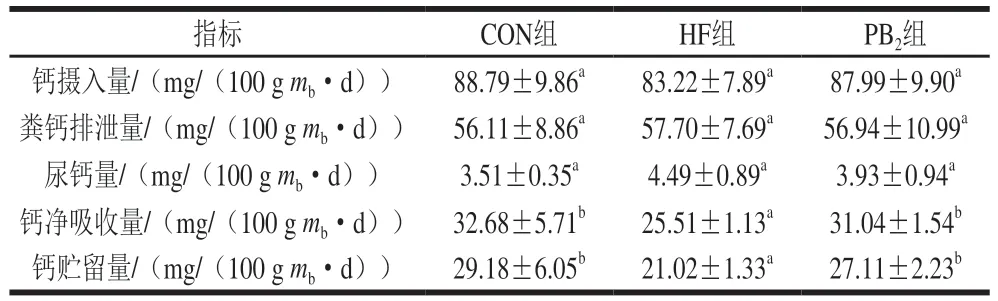
表4 PB2对小鼠钙吸收的影响Table 4 Effect of proanthocyanidin B2 on calcium absorption in mice
PTH是细胞外钙和磷的重要调节因子,也是机体的血钙浓度维持剂,能够刺激骨细胞对骨的重吸收[25]。如图1所示,血浆钙浓度在3 组样本间无显著变化(P>0.05),与CON组相比,HF组的PTH质量浓度高度显著提高(P<0.05),与HF组相比,PB2干预后可以显著降低高脂膳食小鼠PTH质量浓度(P<0.05),部分恢复到CON组水平。如表5所示,HF组骨矿物含量和股骨钙含量与CON组相比显著降低(P<0.05),而PB2摄入可以使含量恢复至正常水平。因此,综合钙吸收、钙内稳态和骨矿物含量的结果可知,高脂膳食导致的钙吸收降低可能造成小鼠钙代谢负平衡,从而刺激PTH分泌,动员骨钙入血,使骨骼中矿物质含量降低,从而维持血钙浓度稳定的水平范围,而PB2组可以干预由高脂膳食导致的钙代谢异常。
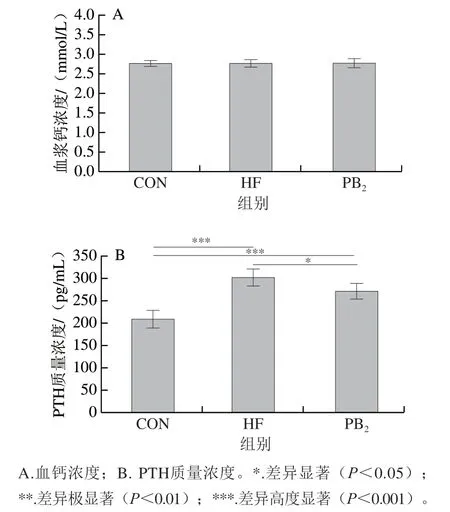
图1 PB2对小鼠钙稳态的影响Fig. 1 Effect of proanthocyanidin B2 on calcium homeostasis in mice

表5 PB2对小鼠骨矿物含量、股骨钙含量的影响Table 5 Effect of proanthocyanidin B2 on bone mineral content and femoral calcium content in mice
2.3 RNA-seq测序数据评估
对3 组小鼠股骨提取的mRNA进行RNA-Seq,如表6所示,测序共获得557 782 130 条序列,质量过滤质控后CON组测得181 626 736 条序列,HF组测得172 345 898 条序列,PB2组测得193 498 872 条序列。测序过滤后所得数据整体质量较高,测序错误率均在0.012%左右,Q20(Phred数值大于20的碱基占总碱基的百分比)在98.29%以上,Q30(Phred数值大于30的碱基占总碱基的百分比)超过94.86%,GC相对含量(碱基G和C数目总和占总碱基数目的百分比)均在52.5%以上,表明碱基G与C含量大致相等。
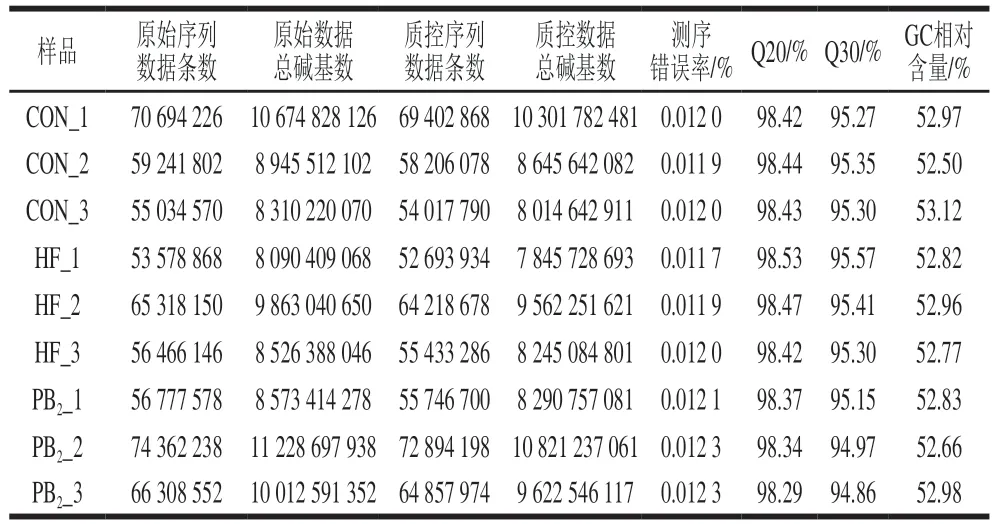
表6 测序数据统计Table 6 Statistics of sequencing data
2.4 差异基因表达分析
为了研究不同组中基因表达情况,本研究采用RSEM 1.2.31软件,以Tpm为衡量表达水平的标准进行差异量表达分析。样本间基因主成分分析(principal components analysis,PCA)结果如图2所示,CON、HF、PB2组在贡献度最高的PC1和PC2上离散明显,PC1和PC2贡献率分别为96.78%和2.29%。高脂膳食摄入使得HF组显著远离CON组样本,而PB2组能够改善这一偏移情况,与HF组相比,PB2组距离CON组更为接近。
为了进一步研究不同组间存在差异的基因表达,本研究采用DESeq 2 1.10.1分析,选取|FC|≥2且P<0.05的基因作为组间差异基因,分别对HF组/CON组和PB2组/HF组进行分析,结果如图3所示。HF组/CON组总共鉴定出436 个差异基因,差异统计火山图表明,高脂膳食摄入导致其中204 个基因表达显著上调,232 个基因表达显著下调;PB2组/HF组总共鉴定出176 个差异基因,PB2组摄入使得其中65 个基因表达显著上调,111 个基因表达显著下调(P<0.05)。
此外,对3 组中共表达的差异基因进行筛选,共筛选出49 个基因,与CON组基因表达情况相比,高脂膳食摄入使得38 个基因表达显著上调,11 个基因表达显著下调,PB2组摄入可以使其中1 个基因表达保持继续下调,显著改善高脂膳食导致的其余48 个基因表达异常(P<0.05)。
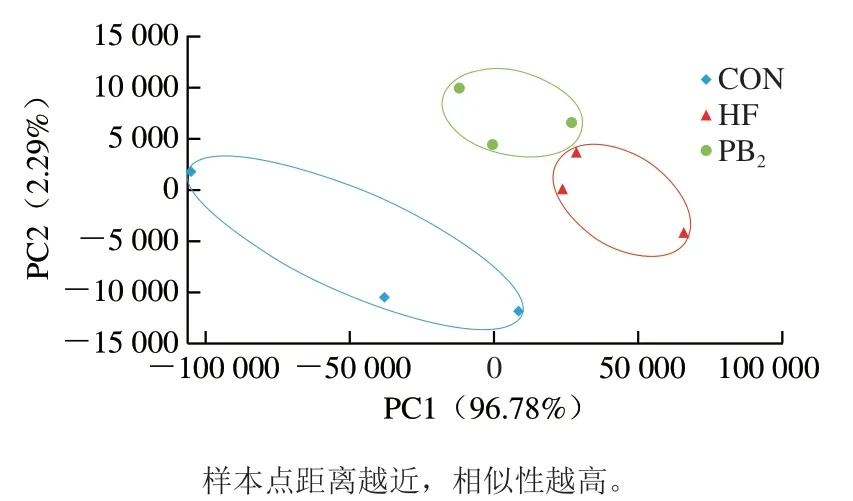
图2 样本间基因PCAFig. 2 Principal components analysis of genes between samples
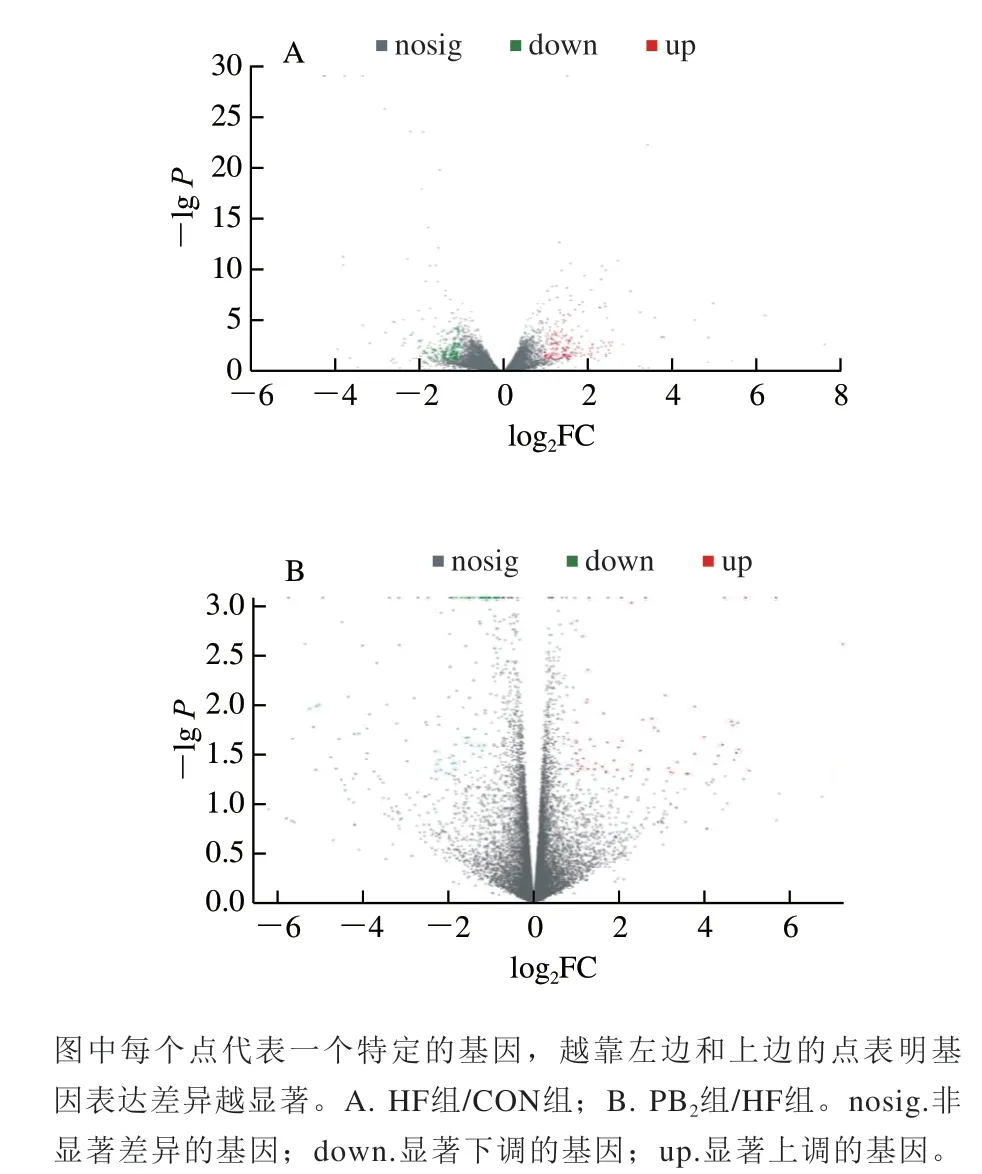
图3 基因表达量差异统计火山图Fig. 3 Volcano plot for the expression of differential genes
2.5 差异共表达基因的富集分析
对于PB2组/HF组鉴别出的176 个差异基因进行了直接与钙代谢相关的通路的筛选分析,发现主要涉及破骨细胞分化、细胞外基质(extracellular matrix,ECM)-受体相互作用、细胞黏附分子(cell adhesion molecules,CAMs)、细胞周期和钙信号通路(表7),基因表达变化总体呈现PB2对破骨细胞活性相关基因表达下调并对胶原合成相关基因表达上调的趋势。
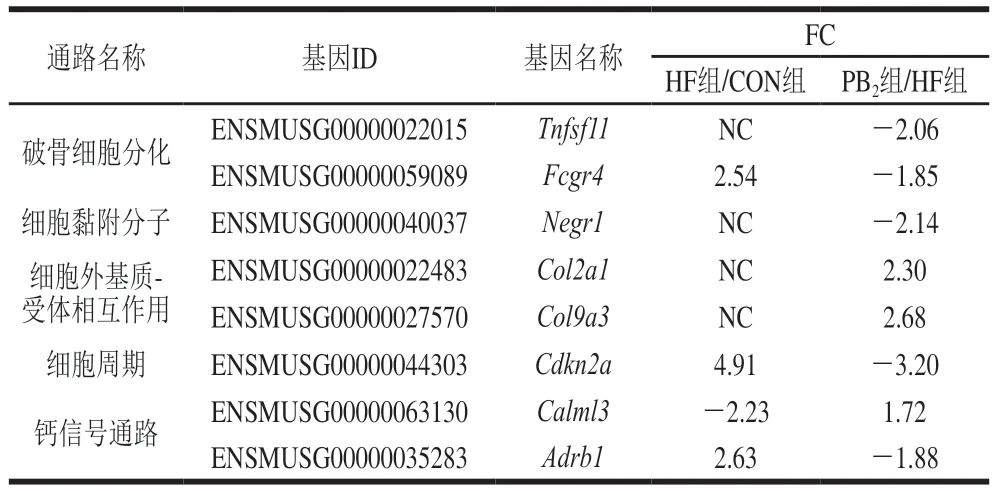
表7 骨代谢相关通路基因表达的影响Table 7 Changes in gene expression associated with bone metabolismrelated pathways
为了从数量较多的潜在靶基因中筛选出有代表意义的基因进行验证,本研究使用Goatools 0.6.5等软件进一步对49 个差异共表达基因进行GO富集分析和KEGG富集分析。GO富集分析中前20的显著性GO项结果表明,差异共表达基因归属于BP和CC两个分支,其中包括机体免疫、机体应激反应、细胞吞噬作用、细胞识别、补体激活、信号转导、大分子复合物的组成等(图4A)。KEGG富集分析结果展示了主要调控通路,共有13 条通路显著富集(P<0.05),分别为肾素分泌、唾液分泌、心肌细胞肾上腺素能信号传导、鸟苷酸环化酶-蛋白激酶G(cyclic guanosine monophosphate-protein kinase G,cGMP-PKG)信号通路、钙信号通路、cAMP信号通路、苯丙氨酸代谢、组氨酸代谢、β-丙氨酸代谢、酪氨酸代谢等(图4B)。
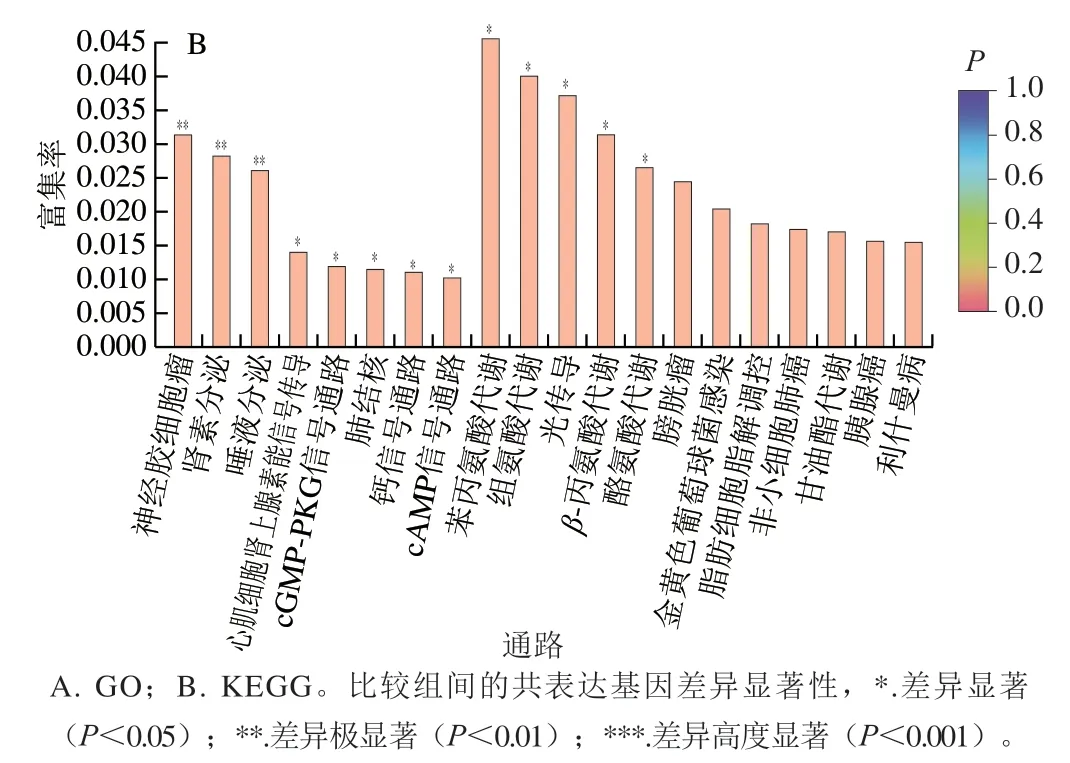
图4 差异共表达基因富集分析Fig. 4 Enrichment analysis of differentially co-expressed genes
此外,本研究根据显著性富集通路对差异共表达基因进行分析,筛选出5 个基因作为潜在调控基因(表8),分别为Cdkn2a、Adrb1、Fcgr4、Aldh1a3和Calml3基因,PB2组干预可以显著下调高脂膳食小鼠Cdkn2a、Adrb1和Fcgr4基因的表达量,分别下调9.19、3.68、3.61 倍,上调Aldh1a3和Calml3基因表达量,分别上调2.06、3.29 倍(P<0.05)。

表8 显著性富集通路筛选的差异共表达基因Table 8 Differentially co-expressed genes selected by the significant KEGG pathways enriched
2.6 qRT-PCR验证结果
为了验证差异基因Cdkn2a、Adrb1、Fcgr4、Aldh1a3和Calml3的表达水平变化结果,进行了qRT-PCR分析(图5)。与RNA-Seq结果相比,尽管qRT-PCR测得基因表达水平结果略有不同,但其变化趋势保持了一致性,表明转录组数据可靠。
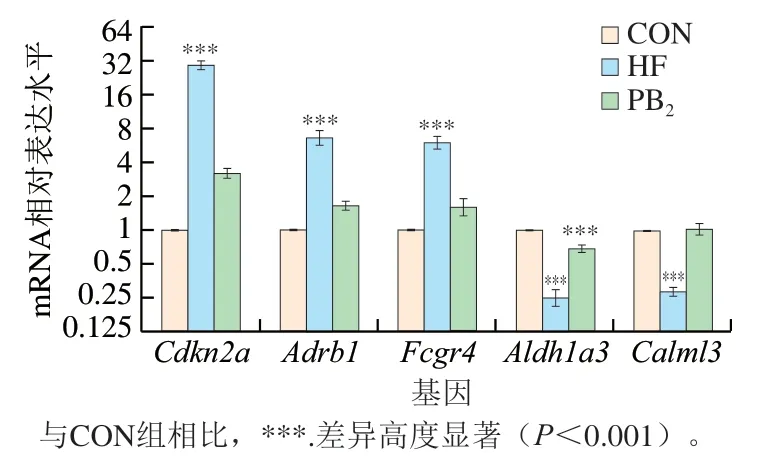
图5 qRT-PCR验证差异共表达基因的变化Fig. 5 qRT-PCR verification of changes in the expression of differentially co-expressed genes
3 讨 论
近年来,由高脂饮食引起的代谢疾病及其并发症是世界主要的公共卫生问题之一[26]。已有研究表明,高脂膳食的摄入会显著提升小鼠的血浆甘油三酸酯和胆固醇水平,导致血脂紊乱[27]。本研究结果与先前研究结果[28-29]一致,与CON组相比,高脂膳食会导致小鼠TC、LDL-C浓度和AI水平显著增加(P<0.05)。此外,Bhandi等[25]研究表明,多酚的摄入可显著降低高脂膳食小鼠TC、TG、LDL-C浓度和AI水平,这与本研究中补充PB2有效降低了高脂膳食小鼠TC、TG、LDL-C浓度、AI水平的结果相似。长期摄入高脂膳食导致的血脂紊乱已被证明对骨骼健康的具有不利影响[30],动物实验研究表明,小鼠饲喂高脂膳食会导致骨密度、骨形成水平降低,骨髓脂肪增加[31-32]。本研究发现PB2可以显著增加高脂膳食小鼠的钙净吸收和钙贮留量(P<0.05),显著降低PTH质量浓度(P<0.05),增加骨矿物与骨钙含量。肠道钙吸收量的降低是骨钙含量减少与骨密度下降的重要因素之一[33]。当肠道钙吸收减少时,PTH质量浓度的上升可以促使骨钙重吸收使骨骼中的钙离子进入血液,维持血液中Ca2+浓度的稳定,长期PTH水平增加会导致骨钙流失。因此,本研究表明PB2促进高脂膳食小鼠钙吸收,抑制骨钙的流失,干预高脂膳食性钙代谢异常。
高脂膳食导致骨吸收和形成之间的平衡改变,随之引发骨矿化降低与骨质量流失,加剧脆性骨折的风险,这种表观的骨形态改变往往与骨基因表达有关[34]。本研究对基因表达谱进行PCA,其作为一种能够有效降低数据维度的数学工具,能够将实验数据与样本之间的关系可视化[35],对RNA-Seq结果的PCA能够将PB2组从HF组中有效分离出来,前2 个成分(PC1和PC2)分别占比96.78%和2.29%。同时使用FC和t检验结果的火山图能够有效减少统计中的系统误差[36]。火山图结果显示PB2组/HF组总共鉴定出176 个差异基因,其中65 个基因表达显著上调(P<0.05),111 个基因表达显著下调(P<0.05),分别参与了破骨细胞分化、ECM-受体相互作用、CAMs、细胞周期和钙信号通路等钙代谢相关通路。已有研究表明,ECM大分子以广泛的胶原家族为代表,参与骨细胞和骨组织稳态的形成[37];细胞黏附分子是免疫球蛋白超家族成员,能够在成骨细胞成熟过程中表达,促进骨骼发育[38]。因此,本研究表明PB2能够有效调控相关基因表达参与钙代谢通路,从而干预钙代谢异常。
本研究进一步对HF组/CON组和PB2组/HF组所涉及的差异基因进行分析,共筛选出49 个有效的差异基因,富集分析结果表明,它们归属于机体免疫、细胞吞噬识别作用、补体经典激活途径等功能,涉及肾素分泌、肾上腺素能信号传导、cGMP-PKG信号通路、钙信号通路、cAMP信号通路等信号通路。机体的血脂紊乱状态会导致慢性炎症反应的发生,进而介导相关免疫调节机制[39-40]。由破骨细胞作为效应细胞的机体自发免疫反应已被证实会促进骨分解代谢,导致骨质溶解直至骨折的过程[41]。在炎症消退期间的细胞凋亡过程中,引发巨噬细胞或其他吞噬细胞的识别和清除,对于恢复正常组织结构和功能至关重要[42]。此外,补体分子作为一类参与免疫效应的大分子,其中一条由抗原-抗体复合物结合C1q启动补体激活的途径称为补体系统的经典激活途径。目前,已有研究表明,补体C1q能够通过调节Wnt(wingless/integrated)信号通路,促进破骨细胞融合但不影响成骨细胞的分化,从而在骨重塑中发挥重要作用[43]。因此,本研究表明PB2可能通过调控相关细胞功能干预高脂膳食性钙代谢异常。
成骨细胞和破骨细胞的分化调节受到相关代谢通路的调控,肾素属于肾素-血管紧张素-醛固酮系统(reninangiotensin-aldosterone system,RAAS),RAAS可在骨组织中刺激破骨细胞形成和抑制成骨细胞活性,从而诱导骨质流失,引发骨质疏松症[44]。成骨细胞中已被报道存在β-肾上腺素能受体,其介导的信号传导会抑制骨形成并触发核因子κB受体活化因子配体(receptor ctivator for nuclear factor-κB ligand,RANKL)介导的破骨细胞生成和骨吸收[45]。Nevola等[46]研究报道了β-受体阻滞剂能够使使用者的骨折风险降低、骨矿物密度增加。钙信号通路可调控RANKL-核因子κB受体活化因子(receptor activator for nuclear factor-κB,RANK)的受体激活剂,参与Ca2+代谢,还可通过CALM基因间接调控丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路。MAPK通路是参与诱导骨细胞分化和调节骨形成的中心信号通路之一,MAPK/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号可诱导成骨细胞基因表达,而抑制MAPK信号可中间阻断分化[47]。此外,cAMP和cGMP-PKG信号通路在骨代谢调节中也发挥了重要作用,已有研究报道,PTH通过cAMP信号通路的介导,促进成骨细胞特异性转录因子的形成,从而对成骨细胞骨形成功能调节[47-48]。Boguslawski等[49]研究也表明cAMP信号通路在PTH信号传导和骨钙素表达调节中具有重要作用,而骨钙素被认为是成骨细胞分化的指标。cGMP-PKG信号通路的激活也已被报道参与调节骨转换、破骨细胞和成骨细胞的分化,在骨骼发育和稳态中发挥重要作用[50]。
目前已有一些研究发现多酚作为一种常见的天然活性物质可影响骨代谢相关基因表达,如李子中的多酚类物质可上调骨形态发生蛋白信号传导相关基因(Bmp2和Runx2等)表达,而Runx2基因表达量的上升和PPARγ基因表达量的下降有助于骨髓细胞分化为成骨细胞,提高骨矿物密度和和骨微结构参数[51-53]。本研究报道了膳食补充PB2对高脂膳食小鼠骨基因表达的影响,发现PB2可调控高脂膳食小鼠股骨中Cdkn2a、Adrb1、Fcgr4、Aldh1a3和Calml3等基因的表达。此外,本研究发现PB2可上调Calml3和Aldhla3基因表达,Calml3和Aldhla3基因主要参与cGMP-PKG信号通路、cAMP信号通路和钙信号通路。最近的研究表明在cGMP-PKG信号通路中,Calml3基因表达的上调可以激活肌球蛋白轻链基因表达,增加肌球蛋白分泌量并间接促进平滑肌舒张,而肌球蛋白的表达可影响破骨细胞的形态和骨吸收活性[54]。此外,Aldhla3基因表达量增加,可能通过参与cAMP信号通路上调钙调蛋白基因表达和调控PTH的分解代谢活动[55-56],从而激活钙信号通路,调节钙稳态、促进成骨细胞形成。
本研究还发现PB2可显著下调高脂膳食小鼠股骨Cdkn2a、Adrb1和Fcgr4基因表达,其主要参与肾素分泌、心肌细胞中的肾上腺素能信号传导和cAMP信号通路。特别是Cdkn2a基因属于细胞周期抑制基因,其与p16蛋白结合的基因产物p16INK4A可阻断CyclinD1与CDK4/6结合,抑制CyclinD1-CDK4/6复合物对成视网膜细胞瘤Rb基因磷酸化,从而参与调控p53信号通路,阻断细胞周期,使其停止于G1或S期,促使胶质细胞处于周期阻滞状态[57],影响骨髓间内的成骨细胞的功能[58],可介导成骨细胞表观遗传发生变化,抑制其分化和功能[59]。同时,Cdkn2a基因作为细胞周期蛋白依赖性激酶抑制剂,其过量表达会以甲状旁腺相关蛋白或RANKL介导的方式刺激破骨细胞生成和骨吸收[60-61],从而改变正常的骨重塑进程,导致骨骼疾病的发展[62]。Fcgr4基因可调控激活Fcγ受体,促使组织细胞释放活性氧,导致局部炎症反应和损伤,而炎症的发生会诱导破骨细胞活性增强,从而导致骨流失[63-64]。此外,Adrb1基因下调已被发现可抑制β1-肾上腺素能受体表达[65]。使用肾素抑制剂可以阻滞RAAS,降低骨质疏松性骨折的发生率[66],这可能是成骨细胞中的肾上腺素能信号传导被抑制,从而导致动物模型中的骨矿物密度增加[67]。因此,本研究发现Calml3和Aldhla3基因表达上调及Cdkn2a、Adrb1和Fcgr4等基因表达下调可能与抑制破骨细胞活性和促进成骨细胞的活性的调节有关。
综上,本研究表明PB2作为天然原花青素中含量丰富的低聚物,能够干预高脂膳食小鼠钙代谢异常,并下调小鼠股骨Cdkn2a、Adrb1和Fcgr4基因表达,上调Aldh1a3和Calml3基因表达,参与调控股骨肾素分泌、肾上腺素能信号传导、cGMP-PKG、Ca2+、cAMP信号通路等通路。本研究通过基因表达谱的变化分析了PB2干预高脂膳食性钙代谢异常的可能机制,为其作为干预骨质疏松的功能因子的开发提供了一定的理论依据。
