C型产气荚膜梭菌实验感染仔猪肠道circRNA的表达特征
2022-11-29黄晓宇杨巧丽闫尊强王鹏飞石海仁滚双宝
黄晓宇,杨巧丽,闫尊强,王鹏飞,石海仁,滚双宝,3*
(1.甘肃农业大学动物科学技术学院,兰州 730070; 2.西藏自治区农牧科学院,拉萨 850000;3.甘肃省现代养猪工程技术研究中心,兰州 730070)
产气荚膜梭菌(Clostridiumperfringens,C.perfringens)是一种革兰阴性厌氧芽孢杆菌,广泛分布于自然环境、人和动物胃肠道微生物群[1-2]。产气荚膜梭菌能够引起一系列人类和动物肠道疾病(CAED),例如气体坏疽、食物中毒、坏死性小肠结肠炎、炎症性疾病、仔猪腹泻、绵羊肠毒血症等[3-4],逐渐成为引起人类和动物组织中毒性疾病和肠道疾病的主要原因。按其所产4种主要致命毒素(α、β、ε和ι)类型不同,产气荚膜梭菌被分为5种类型(A~E)[5]。
C型产气荚膜梭菌(Clostridiumperfringenstype C,C.perfringenstype C, Cp)是新生仔猪腹泻的重要感染性病原体之一[6],已成为仔猪高发病率和高死亡率的重要因素,给全球养猪业造成了巨大的经济损失[7]。C型产气荚膜梭菌被认为是引起哺乳动物高致命性、暴发性坏死性肠炎、小肠结肠炎和全身性疾病的主要原因[8], 同时也是幼畜死亡的一个重要原因[9]。此外,人类因食用受污染的动物产品或直接接触受感染的动物亦会感染该菌[9]。C型产气荚膜梭菌产生的α和β毒素进入肠道,吸附在肠道黏膜上,经肠道屏障系统被吸收到机体血液循环中,进而影响其他器官,如大脑[4]。目前,一些动物模型已被用来研究产气荚膜梭菌相关的肠道疾病[10-13], 如鸡、兔和鼠。但是目前关于仔猪如何应答C型产气荚膜梭菌感染导致的腹泻疾病尚不清楚。
circRNA是一种新型的非编码RNA,由不含50-30极性和poly(A)尾孔的共价闭环结构,经数千个基因的前体mRNA (pre-mRNA)反向剪接产生,在细胞中更稳定[14-15]。诸多研究表明,circRNA不仅可以通过激活或抑制基因的转录参与调控其功能,还能通过靶向miRNA、转录和干扰pre-mRNA剪接在基因表达中发挥潜在的调节作用[16-17]。但是目前有关circRNA如何参与调控仔猪应答C型产气荚膜梭菌感染导致的腹泻疾病尚不清楚。在本研究中,首先构建一个C型产气荚膜梭菌感染仔猪致腹泻的动物模型,并通过RNA测序全面描述C型产气荚膜梭菌感染仔猪的回肠组织中circRNAs特异性表达谱,筛选并鉴定出差异表达的circRNAs,构建与C型产气荚膜梭菌性疾病密切相关的ceRNA互作网络,本研究不仅能为进一步研究circRNA调控仔猪抵抗C型产气荚膜菌性腹泻提供基础,还可为今后猪抗腹泻新品系的培育提供参考。
1 材料与方法
1.1 菌株培养
将C型产气荚膜梭菌菌株CVCC 2032(购自中国农业微生物菌种保藏管理中心,北京)置于牛肉汤培养基中,37 ℃摇晃培养16 h (青岛海博生物)。采用平板菌落计数法测定C型产气荚膜梭菌的菌落形成单位(CFU)。
1.2 动物试验
选择6头7日龄长大二元仔猪,经酶联免疫吸附ELISA试剂盒(南京建成生物工程研究所,中国)检测血清中大肠杆菌、沙门菌和产气荚膜梭菌均为阴性后作为试验仔猪,在适当的气候控制和完全隔离条件下单独饲养,自由采食。随机选取3头仔猪经口灌服1 mL 1×109CFU·mL-1C型产气荚膜梭菌培养液[18],连续5 d,作为处理组(TI组),剩余3头仔猪灌服无菌培养液,作为对照组(CI组)。
接种后,每天监测每只仔猪的健康状况,包括行为、食欲、精神和毛发状况。评估并记录仔猪每天粪便黏稠度,按照腹泻评分标准进行评定:0 =正常、固体粪便;1=轻微腹泻,粪便柔软疏松;2=中度腹泻,质软不成型粪便;3=严重腹泻、水样粪便[19]。试验结束后,采用巴比妥酸盐麻醉法人道屠宰6头仔猪,无菌采集TI组和CI组仔猪的回肠组织样品,用无菌PBS缓冲液(pH 7.4)冲洗干净,液氮速冻并保存于-80 ℃超低温冰箱,以备RNA提取。
1.3 总RNA提取和 circRNA测序
提取TI组和CI组样品中总RNA,经1%琼脂糖凝胶检测后,利用Qubit®RNA Assay Kit测定RNA浓度。使用NanoPhotometer分光光度计(IMPLEN, CA, USA)和RNA Nano 6000检测试剂盒(Agilent Technologies, CA, USA)分别评估总RNA的纯度和完整性。
取TI组和CI组样品RNA 5 μg,按照说明书去除样品核糖体RNA (Epicentre RibozeroTMrRNA 去除试剂盒,Epicentre, 美国)和线性RNA(RNase R,Epicentre, USA)。利用Next®UltraTMDirectional RNA Library Prep Kit制备circRNA测序文库(NEB, 美国),通过Agilent Bioanalyzer 2100系统进行质量评估后,在Illumina Hiseq 4000平台(Illumina, San Diego, CA, USA)上进行测序,获得150 bp配对端(PE150)序列。
1.4 数据比对
去除包含接头序列、ploy-N和低质量(>50% of bases with Phred scores<5)的原始数据后,获取clean数据,通过计算clean数据的Q20、Q30和GC含量,使用Bowtie2[20]将clean reads与猪参考基因组进行比对。
1.5 circRNA的鉴定和定量
使用clean reads中的find_circ[21]和CIRI2[22]检测并识别circRNAs。首先使用TPM(Transcripts read count Per Kilobase Million)对潜在 circRNAs的原始计数进行标准化,以评估表达水平[23]。
1.6 circRNAs差异表达分析
基于负二项分布,使用DESeq2 R包[24]对circRNAs进行差异表达分析。采用Benjamini和Hochberg方法控制错误发生率,以P值<0.05的circRNAs视为差异表达。
1.7 GO和KEGG富集分析
利用DAVID (http://david.abcc.ncifcrf.gov)分析和预测差异表达circRNA的线性转录本;利用GOseq R包[25]和 KOBAS 2软件[26]对差异表达circRNA宿主基因进行Gene Ontology (GO)功能和Kyoto Encyclopedia of Genes and Genomes (KEGG)信号通路富集分析。通过KOBAS软件统计circRNA宿主基因的富集度[27],校正P值<0.05为显著富集。
1.8 circRNA-miRNA-gene互作网络的预测
通过miRanda软件预测差异表达circRNA外显子中的microRNA靶点,构建circRNA/miRNA相互作用关系,用Cytoscape生成circRNA-miRNA-mRNA互作网络图[28]。
1.9 circRNA-miRNA-gene基因网络与CAED分析
为研究circRNA相关的ceRNA网络与CAED之间潜在调控关系,首先筛选TI组和CI组仔猪回肠组织中显著差异表达circRNAs、miRNAs及其靶mRNAs的数据集(校正P<0.05),同时确保circRNAs、miRNAs及其靶miRNAs的表达水平在一定的数量级;其次,circRNA相关的ceRNA网络与CAED相关 (在Web of Science中搜索miRNA,在Genecards数据库中搜索mRNA);最后,进一步筛选参与炎症、免疫或感染等相关信号通路的差异表达circRNAs。根据上述4个步骤筛选与CAED相关的ceRNA网络。
1.10 qPCR验证及数据分析
采用荧光定量qPCR检测ceRNA网络中6个circRNAs、3个miRNAs和4个mRNAs的表达水平,分别以GAPDH基因和U6基因作为内参基因,引物信息见表1。采用9.5 μL 2 × SYBR Green Real-time PCR Master Mix (TaKaRa,中国大连),正、反引物各1 μL,1 μL cDNA和7.5 μL游离RNase ddH2O的20 μL反应体系,在Roche荧光定量PCR仪进行检测,溶解曲线用于评价PCR产物的特异性。
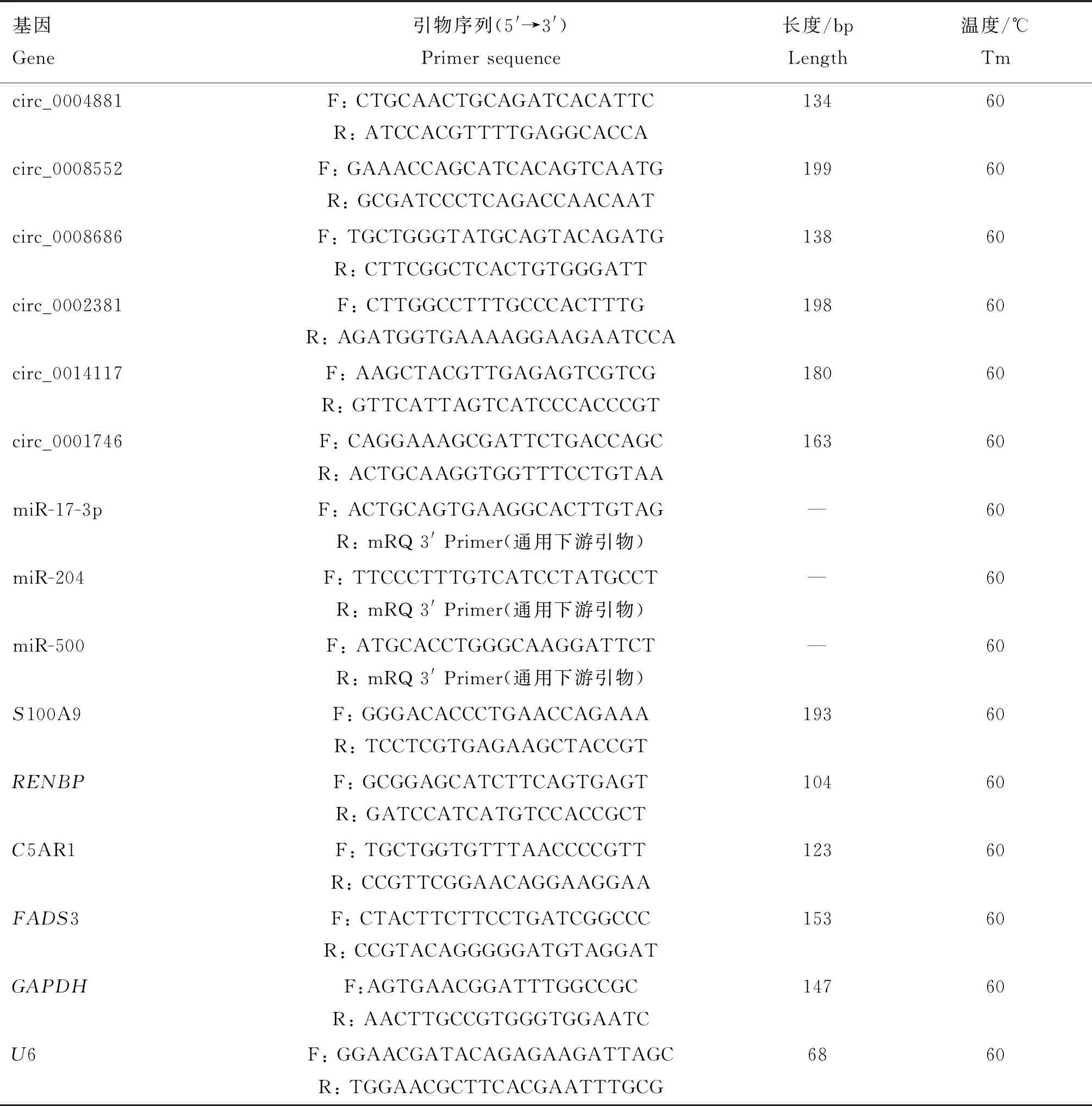
表1 circRNA、miRNA 和 mRNA荧光定量qPCR引物信息
1.11 数据统计分析
利用SPSS 21.0软件进行试验数据的统计学分析,采用独立样本T-test 分析和单因素方差分析(one-way ANOVA)检测TI组和CI组仔猪粪便腹泻评分;定量结果采用2-ΔΔCt法计算相对表达量,所得数值均用“平均值±标准误(X±SE)”表示,每个样品设置3个生物学重复。
2 结 果
2.1 仔猪腹泻评分及粪便中C型产气荚膜梭菌数量
Cp感染导致仔猪出现了不同程度的腹泻,对TI组和CI组仔猪的平均腹泻评分和总腹泻评分进行统计及差异显著性分析。结果发现,TI组仔猪的平均腹泻评分和总腹泻评分分别为1.51±0.29和37.33±2.51,均极显著高于CI组仔猪的平均腹泻评分0.49±0.03和总腹泻评分12.00±1.00(P<0.01,表2)。

表2 TI组和CI组仔猪腹泻评分统计分析
2.2 Cp感染仔猪回肠circRNA的鉴定
经测序鉴定,C型产气荚膜梭菌感染后,TI组和CI组仔猪回肠组织中共检测到3 162个circRNAs(图1A),这些circRNAs的长度分布范围为1~40 kb,大部分circRNA长度小于3 kb(图1B),其中最大长度为2 135 nt,最小长度为22 nt,平均长度为298 nt(图1C)。大多数circRNA含有1~3个外显子、内含子或基因间区域(图1D)。在染色体分布方面,这些鉴定到的circRNAs主要来源于编码蛋白质的基因外显子区域(占81.39%),部分来自基因间区域,少数来自内含子区域(图1E)。
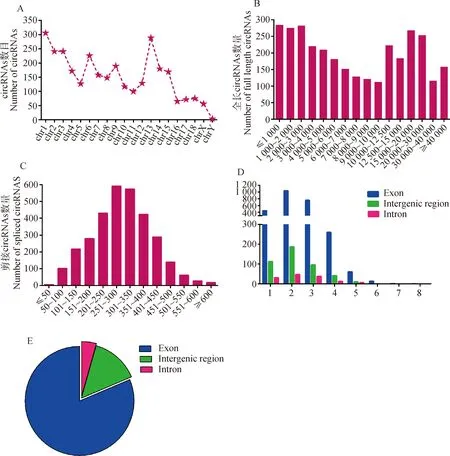
A. 仔猪染色体circRNAs的鉴定; B. 不同全长的circRNAs数量;C. 不同剪接长度的circRNAs数量;D. circRNAs外显子区、基因间区和内含子区3种亚型特征;E. 仔猪回肠circRNAs分类
将Cp感染仔猪回肠组织 circRNA原始数据提交至NCBI Sequence Read Archive (SRA)数据库,获得登录号PRJNA705036。
2.3 差异表达circRNA分析
对Cp感染的TI组和CI组鉴定到的3 162个circRNAs进行分析,发现2 854个circRNAs在两组间共同表达,203个circRNAs和105个circRNAs仅在TI组和CI组中特异性表达(图2A)。聚类结果显示,TI组和CI组具有相同表达模式的circRNA聚类在一起(图2B)。
以校正后P值 < 0.05为标准对鉴定到的circRNA进行差异表达分析, 从TI组和CI组共鉴定到694个circRNAs显著差异表达, 其中上调表达404个circRNAs,下调表达 290个circRNAs(图2C)。还对cirRNAs进行了环状基因组分析(图3),TI组和CI组中差异表达cirRNAs主要分布在1、2、3、6、8、9、13、14、15和X染色体上,每条染色体上分布的差异表达cirRNAs数量和差异倍数差别明显(图3)。
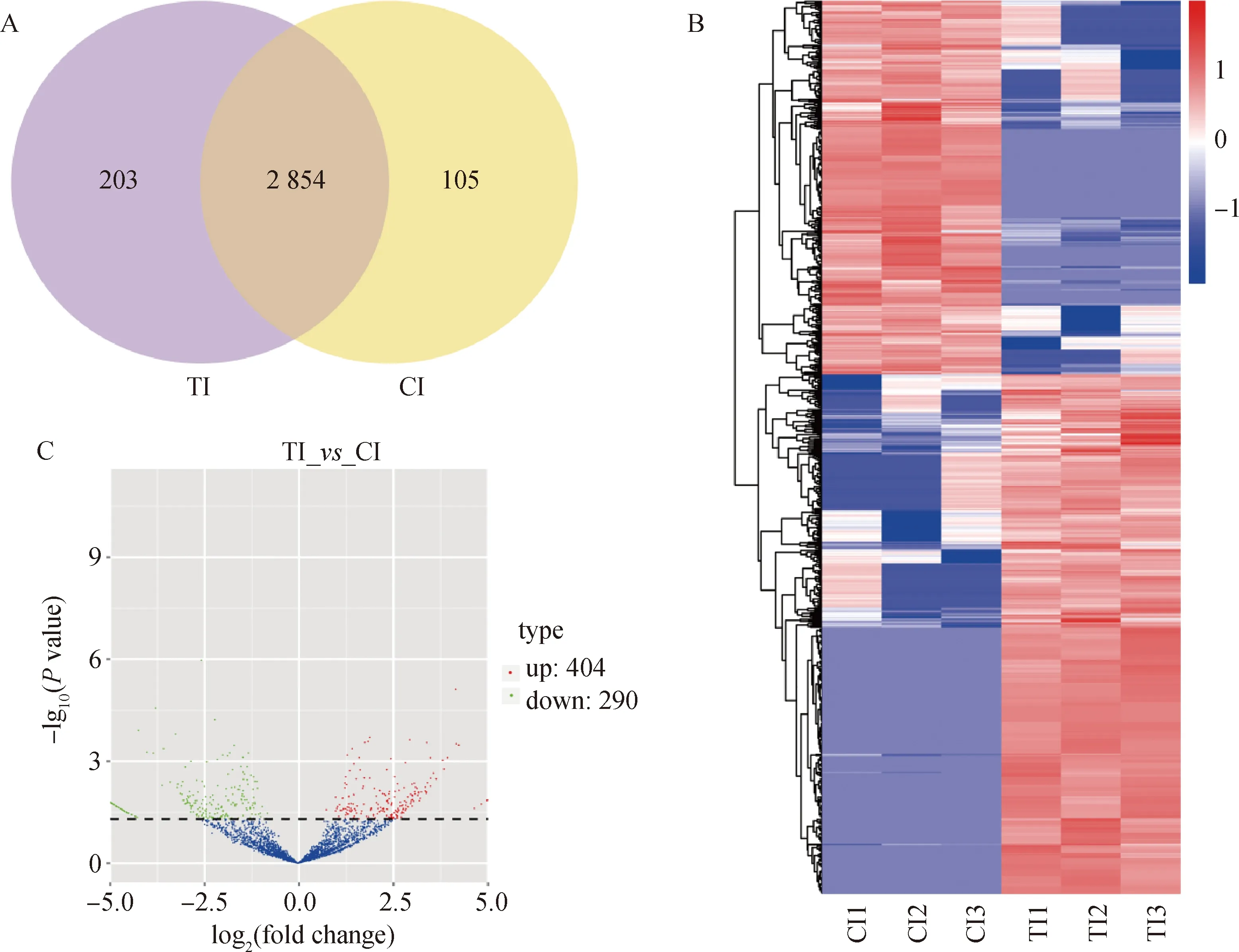
A. 维恩图;B. 聚集热图,行表示差异表达circRNAs,列表示不同样本;C. 火山图,红点和蓝点分别代表上调和下调的circRNAs

红色代表上调circRNAs,绿色代表下调circRNAs
2.4 功能富集分析
circRNAs的功能与circRNA的亲本基因的功能相关。对TI组与CI组间差异表达circRNAs的亲本基因进行GO功能富集分析,发现差异表达circRNAs主要富集在135个GO功能(校正P<0.05),其中包括52个极显著富集的GO功能(校正P<0.01),包括26个生物过程、25个细胞组分和1个分子功能,如细胞器组织、细胞代谢过程、细胞大分子代谢过程等(图4A)。KEGG信号通路富集分析鉴定出197条显著富集的信号通路,top20富集的KEGG通路包括细胞周期、TGF-beta信号通路、赖氨酸降解、Wnt信号通路、T细胞受体信号通路、MAPK信号通路等(图4B),表明差异表达circRNAs通过其亲本基因参与了细胞、免疫和信号转导过程,揭示了差异表达circRNA亲本基因的潜在功能。
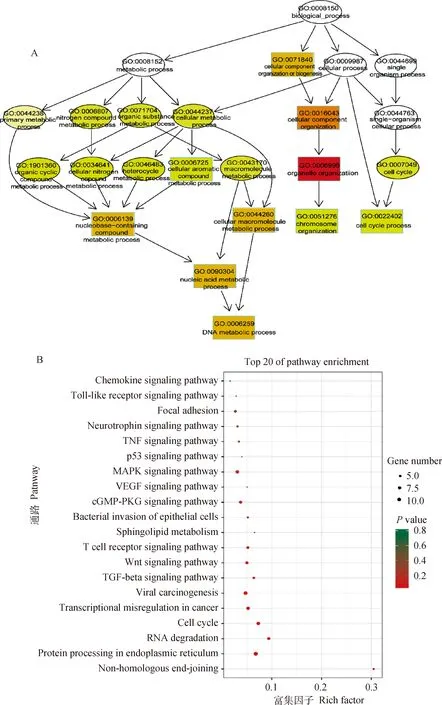
图4 TI组和CI组之间差异表达circRNA 亲本基因GO功能(A)和KEGG信号通路(B)富集分析
2.5 circRNA-miRNA-mRNA相互作用关系预测
通过circRNA转录组测序从Cp感染的仔猪回肠组织中鉴定出694个显著差异表达circRNAs,结合课题组前期从Cp感染组和对照组仔猪回肠组织中鉴定出53个显著表达miRNAs[29]和3 669个显著表达mRNAs[30],构建了circRNA-miRNA-mRNA交互网络(包括349个circRNA、36个miRNAs和233个mRNAs)(图5),如circ0006008- ssc-let-7i- TARBP2,circ0002897- miR-24-3p- ITM2C,circ0003611- miR-365-5p- NFKBID, circ0009977- miR-7134-3p- IL17RC等。这些ceRNA网络基因可能在仔猪应答Cp感染过程中发挥重要作用。
2.6 circRNA-miRNA-mRNA网络与CAED关系分析
为进一步分析circRNA相关的ceRNA网络与CAED之间可能存在的关系,筛选出由8 circRNAs-5 miRNAs-12 mRNAs组成的关系网络,由图6可知,novel-circ0004881能够通过竞争性结合miR-17-3p调控S100A9基因和ERBB2基因,novel-circ0014949能够竞争性结合miR-204调控FAM167基因的表达,novel-circ0008552能够竞争性结合miR-500调控RENBP、C5AR1和FADS3基因的表达。
2.7 qPCR验证
对ceRNA网络中的6个circRNAs,3个miRNAs和4个mRNAs的表达量进行qPCR验证,检测结果表明:circ0004881、circ0008552和circ0014117表达水平极显著上调(P<0.01),circ0008686和circ0002381表达水平极显著下调(P<0.01),miR-500、miR-17-3p、miR-204及S100A9、RENBP基因表达水平均显著上调(P<0.05),但circ0001746、C5AR1和FADS3基因表达水平显著下调(P<0.05),这些基因的表达水平与测序结果均一致(图7)。

数据以“平均值±SEM”表示;*. P<0.05; **. P<0.01
3 讨 论
近十年,C型产气荚膜梭菌被认为是引起仔猪急性高度传染性腹泻、肠道炎症性疾病及坏死性肠炎的重要致病菌之一,严重威胁着世界养猪业的健康发展[3]。目前有关C型产气荚膜梭菌感染引起仔猪腹泻的研究主要集中在发病机制和疾病诊断、病理检测等方面,由于人们对猪抵抗C型产气荚膜梭菌感染性腹泻疾病的调控机制研究不足,使得该类疾病目前尚无有效的治疗方法。circRNAs是一种新发现的特殊非编码RNA,广泛存在于各类细胞中,具有充当竞争性内源RNA(ceRNA),竞争性结合miRNA,调控其亲本基因的表达及转录等多种生物学功能[31]。circRNA相关的ceRNA网络可能在许多免疫和炎性疾病过程中发挥关键作用[32-33]。研究报道肠道组织has-circ-001569的表达与miRNA-145水平呈负相关,与miRNA-145靶基因E2F5、BAG4和FMNL2水平呈正相关,has-circ-001569通过竞争性结合miRNA-145,调控其靶基因E2F5、BAG4和FMNL2基因表达,促进细胞增殖和侵袭[34]。然而,circRNA如何调控仔猪应答C型产气荚膜梭菌感染引起的腹泻疾病尚不清楚。
本研究报道了C型产气荚膜梭菌感染的仔猪回肠circRNA的表达模式,经分析,在TI组和CI组中共鉴定到3 162个circRNAs,其中694个circRNAs显著差异表达(P<0.05),包括404个circRNAs上调表达,290个circRNAs下调表达。为了进一步了解差异表达 circRNA的功能,本研究进行了差异表达circRNA的功能富集分析。值得注意的是,差异表达的circRNAs主要富集在12个KEGG信号通路,如TGF-beta信号通路、T细胞受体和MAPK等免疫相关信号通路,这些通路被报道是与C型产气荚膜梭菌感染性疾病密切相关的信号通路[29],该结果说明,circRNA可通过免疫相关信号通路调控仔猪应答C型产气荚膜梭菌感染引起的腹泻疾病。
本课题组前期报道了C型产气荚膜梭菌感染仔猪回肠miRNA和mRNA的动态变化[29-30],结合该数据,在分析circRNA、miRNA和mRNA表达相关性的基础上,本研究进一步构建了C型产气荚膜感染仔猪回肠组织差异表达circRNA相关的ceRNA调控网络,共形成了836条circRNA、miRNA和mRNA相关关系(图5)。在此ceRNA调控网络中,发现一些circRNA可以与miR-15b、miR-21和miR-17-3p等竞争性结合,miR-15b、let-7i、S100A9、IL7R、IL17RC、CD101和TARBP2等免疫相关分子均被报道与宿主免疫系统疾病密切相关。有研究报道,miR-15b、miR-17-3p、miR-29a和miR-21被认为与结直肠癌(CRC)和炎症性肠炎(IBD)等疾病的发生发展有关,可作为疾病诊断及预后的生物标志物[35-36]。miR-15b与宿主空肠和回肠中某些细菌的拷贝数呈正相关,可作为免疫细胞发育的调节剂,对宿主肠道的发育具有潜在的调控功能[37]。因此推测,circRNA可能通过竞争性结合miRNA调控靶mRNA,在仔猪应答C型产气荚膜梭菌感染性腹泻过程中发挥免疫调节作用。
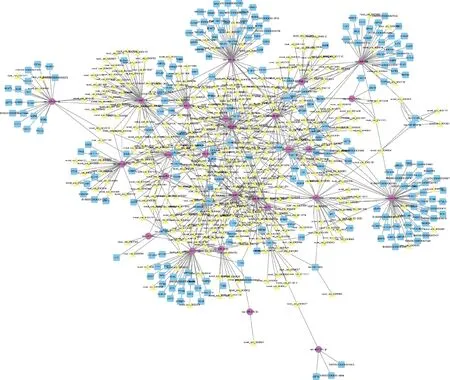
蓝色正方形代表mRNA,红色圆圈代表miRNA,黄色三角形代表circRNA
本研究筛选出了与CEAD相关的ceRNA调控网络,包括8个circRNAs,5个miRNAs和12个mRNAs,如circ-0004881-miR-17-3p-S100A9、circ-0002381-miR-338-FMVK、circ-0014949-miR-204-FAM167等,其中circ-0008552-miR-500与RENBP、C5AR1和FADS3均具有潜在的靶向关系(图6A)。qPCR检测结果表明,Cp感染导致仔猪回肠miR-17-3p的表达显著上调,其上游circ-0004881和下游靶基因S100A9的表达均显著上调。miR-17-3p被circ-0004881竞争性吸附,抑制3种线粒体抗氧化酶:锰超氧化物歧化酶、谷胱甘肽过氧化物酶2和硫氧还蛋白还原酶2,协同有效地去除细胞内的活性氧,提高肿瘤的治疗效率[38]。钙结合蛋白基因S100A9具有调控细胞增殖、诱导细胞凋亡、参与炎性应答、影响炎症细胞的迁移、抵抗病原菌多种生物功能[39-40]。LPS通过抑制细胞活力、促进细胞凋亡和促炎症因子的产生,诱导细胞发生炎症损伤。Zhao等[41]利用脂多糖(LPS)感染小鼠,发现LPS处理的小鼠肺组织中S100A9基因的表达上调,说明S100A9基因的表达水平与LPS诱导的小鼠肺组织的炎症反应密切相关。S100A9能显著改善小鼠结肠组织的炎症反应,减少免疫细胞(巨噬细胞、中性粒细胞)的浸润和促炎性细胞因子(TNF-α、IL-1β、IFN-γ、IL-6等)的产生[42]。本研究发现,Cp感染导致仔猪回肠S100A9基因显著上调表达,说明circ-0004881可能通过竞争性结合miR-17-3p,影响S100A9基因的表达,参与仔猪抵抗Cp感染过程。

图6 circRNA相关的ceRNA网络与CAED之间的潜在关系
LPS刺激能够激活巨噬细胞miR-500的表达上调,通过靶向MFN2抑制TGF-β/Smad的激活,促进细胞增殖和活化[43]。Wang等[29]研究发现,miR-500通过靶向调控ELK1、HSPA2、IL7R基因参与抵制Cp感染引起的仔猪疾病。上调表达的miR-500能通过抑制靶基因的表达,激活泛素偶联受体相互作用蛋白1(RIP1)和NF-κB, 促进癌细胞的增殖和存活[44]。C5AR1是一种炎症驱动因子,巨噬细胞能通过C5AR1的先天免疫反应,增加TNF-α炎症反应,加剧机体炎症因子的产生。补体在AOM/dss诱导的小鼠CRC模型的炎症组织中被广泛激活,导致多方面的后果。高表达的C5AR1可能通过调节某些关键细胞因子和趋化因子的产生,损伤CD8+T细胞,诱导肠道炎症的发生,可能是肠道炎症和肠癌发生的主控调控因子[45]。FADS3被认为是B细胞特异性基因,能够特异性结合NK-κB、p63转录因子,参与机体的细胞增殖、氧化应激反应[46]。本研究中,circ-0008552和miR-500在Cp感染导致仔猪回肠组织中的表达显著上调,C5AR1和FADS3基因的表达显著下调,因此推测,circ-0008552可能竞争性结合miR-500,负调控C5AR1和FADS3基因的表达,参与Cp感染仔猪致腹泻的过程。miR-204可以通过靶基因特异性抑制炎症细胞的增殖、自噬并诱导细胞凋亡[47],被认为是治疗免疫、炎症和癌症相关疾病的潜在靶点。本课题组前期发现,miR-204在Cp感染腹泻仔猪回肠组织和C型产气荚膜梭菌CPB2毒素处理的肠上皮细胞IPEC-J2中均显著高表达,此外过表达miR-204促进了猪IPEC-J2的凋亡和炎症反应,抑制miR-204 则减弱了细胞的炎性反应[48]。本研究中,Cp感染导致仔猪回肠组织miR-204的表达水平显著上调,可能促进了Cp感染导致的仔猪肠道炎症及腹泻症状。
4 结 论
本研究综合分析了C型产气荚膜梭菌感染的仔猪回肠组织 circRNA差异表达谱,筛选出694个差异表达circRNAs,主要富集在TGF-β、T细胞受体、MAPK等信号通路,构建出由8 circRNAs-5 miRNAs-12 mRNAs组成的ceRNA网络与C型产气荚膜菌感染致仔猪腹泻相关,其中circ-0004881-miR-17-3p-S100A9可能在Cp感染引起的仔猪腹泻过程中发挥潜在功能。
