阿司匹林丁香酚酯对体外脂多糖诱导小鼠巨噬细胞炎症反应的抑制效应
2022-11-29潘寅川杨亚军刘希望李剑勇
刘 旭,潘寅川,杨亚军,刘希望,马 宁*,李剑勇*
(1.河北农业大学动物医学院(中兽医学院) 河北省兽医生物技术创新中心,保定 071000;2.中国农业科学院兰州畜牧与兽药研究所 农业农村部兽用药物创制重点实验室 甘肃省新兽药工程重点实验室,兰州 730050)
炎症可引起宠物疼痛不安,造成生存质量下降,严重影响宠物福利[1]。与炎症相关的疾病主要有犬、猫的关节炎、皮炎、胃肠炎、胰腺炎以及术后炎症等。此外,代谢性疾病如血脂异常、肥胖等在犬、猫中也具有很高的发病率,而炎症是引起此类疾病的重要病因之一[2-3]。对炎症的干预和治疗,对于炎症本身及预防相关疾病的发生发展十分重要,有助于维持宠物的健康状态和提高宠物的生活质量,已日益受到重视。
阿司匹林(aspirin,Asp)是一种用于止痛、消炎、解热的常用药物[4]。前期相关研究证实,Asp可以预防犬猫等宠物的炎症性疾病[5]。然而,由于Asp会引起胃肠道并发症,限制了Asp的长期使用[6]。丁香酚(eugenol,Eug)是丁香花蕾挥发油中的活性成分,具备多种治疗效果,包括抗菌、抗炎、抗血栓、解热等[7]。由于Eug含有酚羟基,具有刺激性和易氧化的特点,其临床应用受到一定限制。为了减少Asp和Eug的副作用,提高治疗效果,通过酯化反应合成了阿司匹林丁香酚酯(aspirin eugenol ester,AEE)[8]。AEE通过酯化反应对羧基和酚羟基进行修饰,既解决了Asp进入体内时对肠胃的刺激,同时克服了Eug的不稳定性和刺激性气味[9-10]。其急性毒性、药效学、稳定性、致畸性和致突变性研究表明,AEE的LD50为10.39 g·kg-1,低于Asp和Eug[11],大鼠连续灌胃15 d(50 mg·kg-1),无显著毒性作用[12],鼠伤寒沙门菌试验(Ames)和小鼠骨髓微核试验证实其遗传毒性不显著[13]。药理学表明,AEE通过调节一氧化氮合酶和Nrf2信号通路,保护血管内皮细胞免受氧化损伤[14],并对高血脂、血栓具有一定的治疗作用[15-16]。然而,该药物作为Asp衍生物,其抗炎作用和抗炎机制尚需进一步研究。
花生四烯酸(Arachidonic acid,AA)是一种ω-6多不饱和脂肪酸,主要以细胞膜上的磷脂的形式存在。当细胞处于应激状态时,AA被磷脂酶A2(phospholipase A2,PLA2)分解成游离形式并释放到细胞液中,然后在代谢酶的作用下形成上百种生物活性代谢物。目前,参与AA代谢的酶主要有3种,分别是环氧化酶(cyclooxygenase,COX)、脂氧合酶(lipoxygenase,LOX)和细胞色素P450(cytochrome P450,CYP450)[17-18]。AA代谢网络是产生炎症介质并诱导炎症的主要网络[19],其在炎症的形成和发展中发挥着极其重要的作用,且不是一个孤立的过程。本研究以脂多糖(lipopolysaccharide,LPS)诱导小鼠巨噬细胞(RAW264.7细胞)体外炎症模型,分析AEE对RAW264.7细胞存活率和炎症因子含量的影响,明确AEE对炎症反应的抑制效应;并进一步结合RT-PCR和分子对接方法,研究AEE对AA代谢通路关键酶的作用,探讨AEE潜在的抗炎机制,为将AEE开发为兽医临床抗炎药物提供一定的理论基础。
1 材料与方法
1.1 药品试剂
小鼠巨噬细胞(RAW264.7细胞)购自中国科学院上海细胞库;AEE(纯度>99%)由中国农业科学院兰州畜牧与兽药研究所农业农村部兽用药物创制重点实验室合成制备;阿司匹林、丁香酚购自上海阿拉丁生化科技股份有限公司;脂多糖、胰蛋白酶、Cell Counting Kit-8购自北京索莱宝科技有限公司;Foundation FBS、DMEM高糖培养液购自MCE有限公司;ELISA试剂盒购自上海江莱生物科技有限公司;RNA提取试剂盒、反转录试剂盒、荧光定量PCR试剂盒购自北京聚合美生物工程有限公司。
1.2 细胞培养
将消化好的RAW264.7细胞悬液加入细胞培养瓶内,加入5 mL含10% FBS的高糖DMEM培养基、100 U·mL-1青霉素和100 μg·mL-1链霉素,细胞在37 ℃加湿培养箱中生长,培养箱中含有5% CO2,操作过程保持无菌,观察细胞的状态和成长情况,待细胞生长至对数生长期时,取生长状态良好的细胞用于试验。
1.3 试验分组及处理
取对数生长期细胞,用胰酶消化制成细胞悬液,密度为5×104个·mL-1接种于24孔板。并将细胞分为对照组(Control):正常培养24 h;炎症模型组(LPS):1 μg·mL-1的LPS作用24 h;Asp组:LPS+Asp,向培养液中加入浓度为150 μmol·L-1的Asp预处理细胞4 h,1 μg·mL-1的LPS作用24 h,Eug处理组:LPS+Eug,向培养液中加入浓度为150 μmol·L-1的Eug预处理细胞4 h, 1 μg·mL-1的LPS作用24 h;AEE处理组:LPS+AEE(低、中、高浓度):向培养液中分别加入浓度为75、150、300 μmol·L-1的AEE预处理细胞4 h,1 μg·mL-1的LPS作用24 h;每组设5个重复。
1.4 细胞毒性试验
细胞毒性试验采用CCK-8法,在96孔板中接种细胞悬液(100 μL·孔-1),将培养板放在培养箱中预培养24 h;加入浓度为(5、15、45、75、100、150、300、350 μmol·L-1)的AEE溶液;将培养板在培养箱孵育24 h;向每孔加入10 μL的CCK-8溶液;将培养板置于培养箱内孵育2 h;用酶标仪测定在450 nm处的吸光度,并计算细胞存活率。细胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100。
1.5 ELISA检测TNF-α、IL-6、IL-8、IL-1β含量
取对数生长期RAW264.7细胞接种于48孔板中,细胞分组及处理方法同“1.3”,培养结束后,收集各组细胞培养上清液,ELISA法检测各组TNF-α、IL-6、IL-8、IL-1β含量,操作步骤按照试剂盒说明书。
1.6 RT-PCR法检测COX-1、COX-2、5-LOX、PLA2和CYP450基因转录水平
取对数生长期RAW264.7细胞接种于24孔板中,细胞分组及处理方法同“1.3”,培养完成后,提取各组细胞总RNA,依试剂盒说明书操作方法,把mRNA逆转录为cDNA,获得的cDNA用于RT-PCR,检测COX-1、COX-2、5-LOX、PLA2和CYP450基因的相对转录水平。PCR引物见表1,并选用了β-actin为内参基因。RT-PCR的反应条件是95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循环40次;mRNA的相对转录量采用2-△△Ct方法计算。

表1 RT-PCR相关引物序列表
1.7 分子对接
应用RCSB PDB(http://www.rcsb.org/)数据库下载相关蛋白晶体结构,保存为pdb格式,利用AutoDock 4.2.6软件进行分子对接,利用Pymol软件进行可视化处理,研究Asp、Eug、AEE与COX-1、COX-2、5-LOX、PLA2和CYP450蛋白的结合模式,根据得到的结合能(binding energy)值评价不同药物和关键靶点之间的对接结果。
1.8 数据分析
利用SPSS软件进行分析,统计分析采用组间单因素方差分析法(one-way AVOVA),数据都以“Mean±SD”表示,P≤0.05时差异具有统计学意义。
2 结 果
2.1 AEE对RAW264.7细胞活力的影响
与空白对照组相比,CCK-8法检测结果显示,AEE处理对细胞生长没有抑制作用,5、15、45、75、100、150、300、350 μmol·L-1处理细胞活力均在93%以上,且各组间没有统计学差异(图1)。在本试验中,将150 μmol·L-1的AEE用于后续试验,在此基础之上,将低剂量确定为75 μmol·L-1,高剂量确定为300 μmol·L-1。为比较AEE、Asp、Eug之间区别,将与中剂量AEE等摩尔的Asp与Eug用于试验。
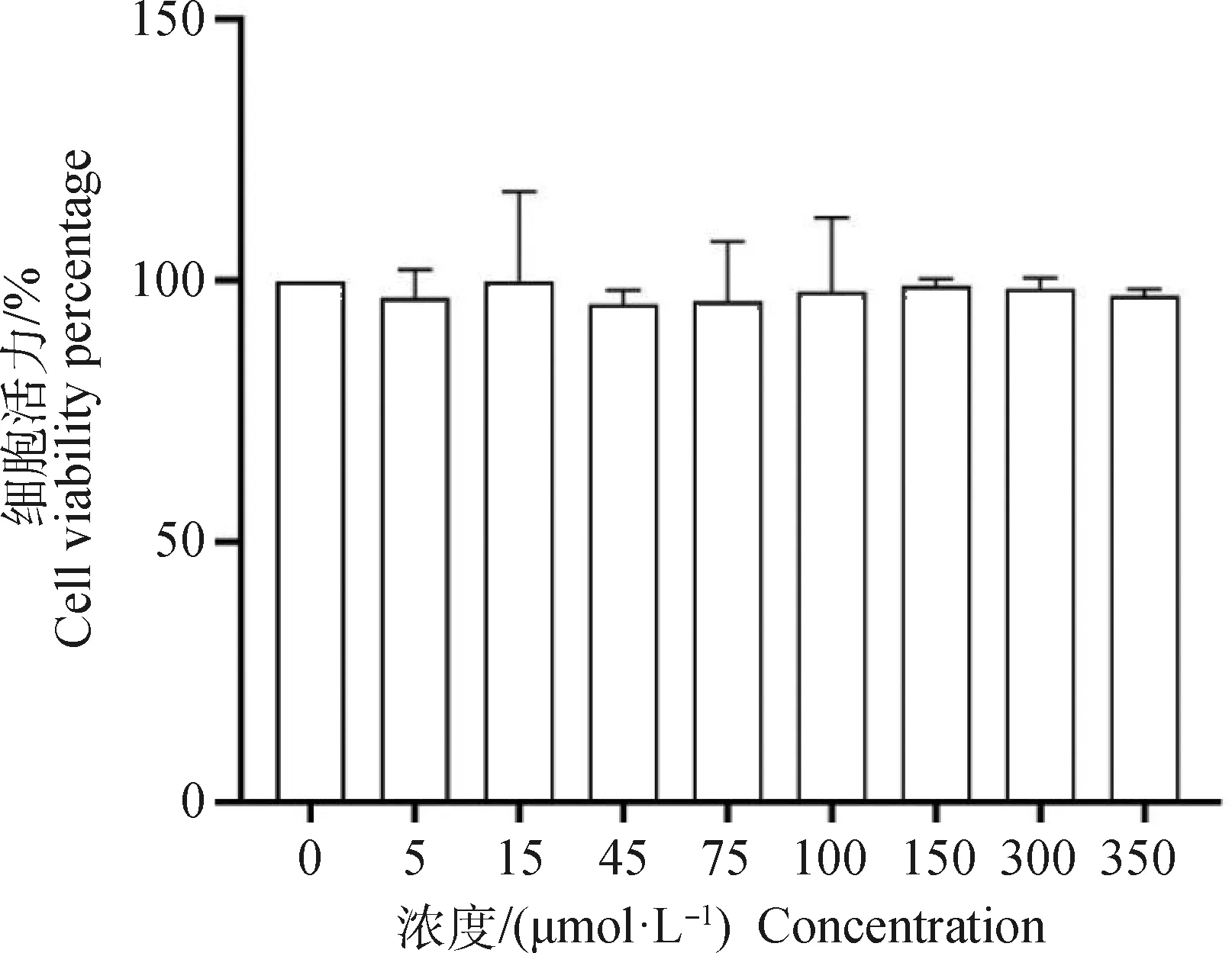
图1 AEE 对RAW264.7细胞活力的影响
2.2 AEE对LPS诱导的炎症细胞因子的影响
ELISA结果表明,与空白对照组比较,LPS组中炎症因子IL-1β、IL-6、IL-8、TNF-α表达极显著升高(P<0.01),表明炎症模型造模成功。经不同剂量AEE处理后能极显著降低炎症因子IL-1β、IL-8、TNF-α表达水平(P<0.01);在炎症因子IL-1β、IL-6、IL-8中,与Asp和Eug组比较,等摩尔的AEE与其无显著差异(P>0.05),表明其抗炎效果相似;不同剂量的AEE在炎症因子IL-1β、IL-6、IL-8之间差异不显著(P>0.05),但中剂组AEE抗炎效果要优于低剂量组和高剂量组(表2)。

表2 AEE对LPS诱导的TNF-α、IL-8、IL-6、IL-1β的影响
2.3 RT-PCR法检测COX-1、COX-2、5-LOX、PLA2和CYP450基因转录水平
β-actin为内参基因,RT-PCR检测结果显示(表3),与空白对照组比较,LPS组中CYP450、PLA2、COX-2、COX-1和5-LOX表达极显著升高(P<0.01),表明炎症模型造模成功。不同剂量的AEE处理能显著降低AA代谢通路关键酶的mRNA表达量(P<0.05);与ASP和Eug组比较,等摩尔量的AEE能够显著降低AA代谢通路关键酶PLA2的表达量(P<0.05);不同剂量的AEE在COX-1、COX-2、5-LOX和CYP450关键酶表达量之间差异不显著(P>0.05)。
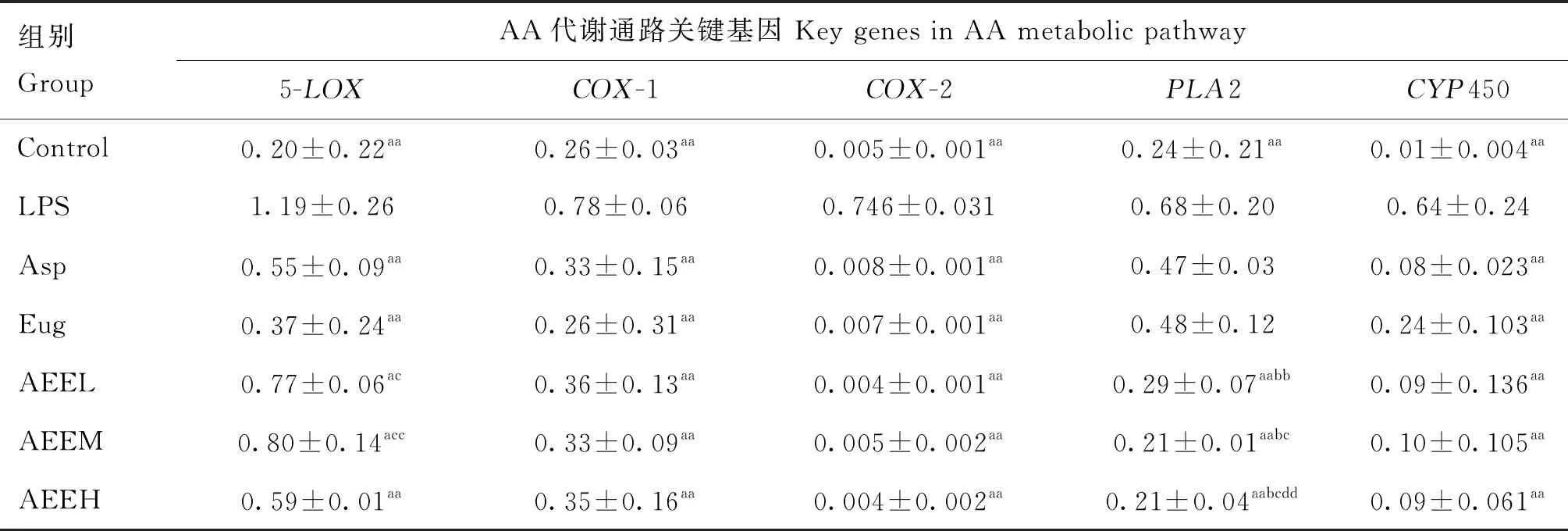
表3 AEE对LPS诱导的COX-1、COX-2、5-LOX、PLA2和CYP450的影响
2.4 分子对接研究
利用AutoDock软件进行分子对接,AEE能与COX-1、COX-2、5-LOX、PLA2和CYP450形成结合位点,结合能分别为-39.25、-39.75、-38.87、-37.24、-32.90 kJ。所有的对接结果均小于-20.9 kJ(表4)。利用Pymol软件对结果进行可视化处理,AEE中的羟基与COX-1蛋白中的氨基酸530 SER形成常规氢键,键长为2.1 Å。AEE中的羟基与COX-2蛋白中的氨基酸530 SER、527 ALA形成常规氢键,键长范围1.9~2.7 Å。AEE中的羟基与5-LOX蛋白中的氨基酸370 ARG、470 TYR、549 GLN形成常规氢键,键长范围1.9~2.5 Å。AEE中的羟基与PLA2蛋白中的氨基酸62 LYS、47 HIS、29 GLY形成常规氢键,键长范围2.0~2.3 Å。AEE中的羟基与CYP450蛋白中的氨基酸476 PHE、214 GLN、100 PHE形成常规氢键,键长范围1.9~2.3 Å(图2、3)。
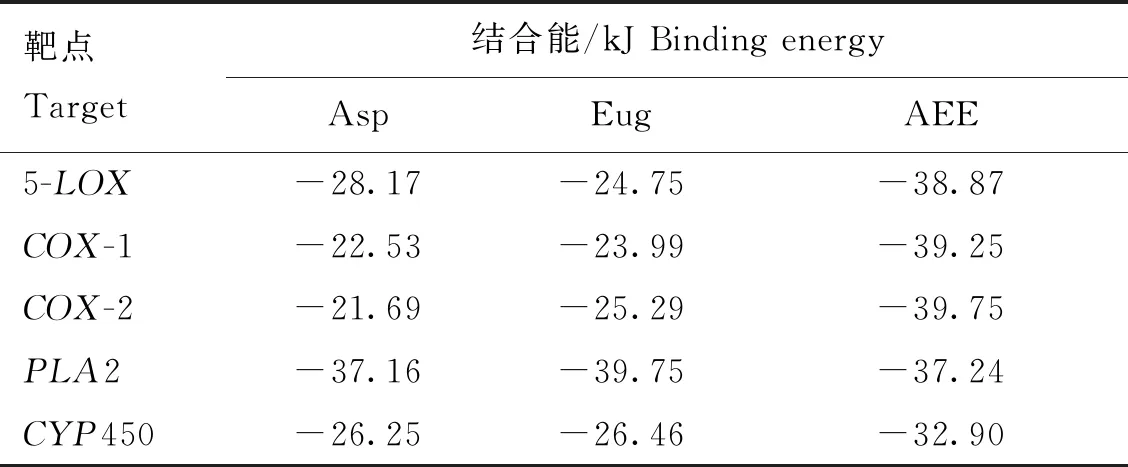
表4 AEE化合物活性成分和靶蛋白对接结果
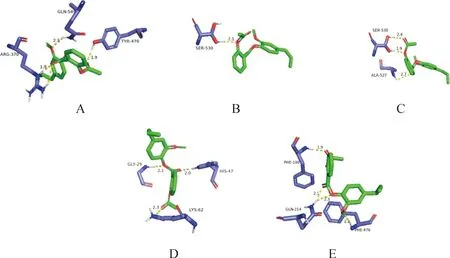
图3 AEE与5-LOX(A),COX-1(B),COX-2(C),PLA2(D)和CYP450(E)氢键示意图
3 讨 论
炎症是对健康至关重要的防御机制,是免疫系统对有害刺激的反应。通常,在炎症反应中,细胞和分子相互作用能有效地减少损伤感染。这一过程有助于组织稳态的恢复和急性炎症的解决。IL-1β是免疫病理中有效的促炎细胞因子,能诱导局部炎症和中性粒细胞、单核细胞和巨噬细胞的募集和激活[20-21],TNF-α是在急性炎症过程中产生的炎症细胞因子,在细胞内参与多种信号活动,导致细胞坏死或凋亡。近年来,研究发现TNF-α正在成为肿瘤治疗的靶点[22-23]。IL-6能诱导B细胞分化和抗体产生,诱导T细胞增殖、活化,参与机体的免疫应答,是炎性反应的促进剂。IL-8可以激活中性粒细胞并参与中性粒细胞介导的组织损伤。炎症因子是检测各种疾病的重要标志物,在许多炎症疾病中,炎症因子都会表现异常,因而降低炎症因子的表达水平在炎症疾病中发挥重要作用。
LPS刺激RAW264.7细胞是一种常见的细胞炎症模型。RAW264.7细胞是一种巨噬细胞,是几乎存在于所有组织中的重要免疫效应细胞,不仅能清除细胞碎片,还释放多种介质,包括促炎酶、细胞因子等[24]。LPS可激活巨噬细胞并引发多种炎症反应,包括释放促炎介质和细胞因子,如TNF-α、IL-8和诱导型一氧化氮合酶(iNOS)[25-26]。本研究发现,1 μg·mL-1的LPS处理细胞,诱导了细胞炎症,证明了炎症模型造模成功。前期,Xie等[25]采用1 μg·mL-1的LPS,诱导了RAW264.7细胞的炎症和氧化应激模型。Li等[27]采用同样浓度的LPS诱导了RAW264.7细胞的炎症模型。因此,本试验炎症模型建立成功,并且与前期研究结果相一致。
Liu等[28]研究发现,Asp治疗可抑制炎症早期LPS诱导的巨噬细胞活化。Murakami等[29]报道,Eug相关化合物可能通过抑制核因子κB(NF-κB)的激活而发挥抗氧化和抗炎作用。在对AEE的前期研究中,通过小鼠耳肿胀模型、腹腔毛细血管通透性增高模型、小鼠足跖肿胀模型及肉芽肿模型评估了AEE的抗炎作用。相关结果表明,0.18 g·kg-1的AEE具有明显的抗炎作用,其能显著抑制耳肿胀度,降低毛细血管通透性,抑制足跖肿胀和肉芽肿增生[30]。本研究发现,Asp、Eug、AEE也有同样的抗炎效果。ELISA检测AEE对LPS诱导的炎症细胞因子水平试验中,不同剂量的AEE处理能极显著降低炎症因子IL-1β、IL-6、IL-8、TNF-α表达水平;与Asp和Eug组比较,等摩尔的AEE与其无显著差异,表明其抗炎效果相当。然而,比较平均值发现,AEE抗炎作用更强;不同剂量的AEE之间差异不显著,但中剂量的AEE效果优于低剂量组和高剂量组。
花生四烯酸是炎症反应的有效媒介,参与了多种疾病的发病过程,是COX、LOX和CYP450途径产生前列腺素、白三烯和环氧二十碳三烯酸(EETs)的首选底物。这些途径是治疗炎症、疼痛、过敏、哮喘、心血管疾病的药物的靶点,最近还被用于抑制肿瘤相关炎症。COX是前列腺素合成中的限速酶,其有两种同工酶,即COX-1和COX-2。LOX酶在多种细胞中表达,它们具有多种生理功能,包括诱导炎症、皮肤紊乱和肿瘤发生[31]。AA也是LOX产生白三烯和脂素的底物。CYP450产生两种主要的二十碳烯类产物:由CYP环氧合酶形成的EETs和由CYP羟化酶形成的羟基二十碳四烯酸(HETE)[32]。相关研究表明,Asp是COX酶的非选择性抑制剂,体内外对COX-1和COX-2均有很好的抑制活性。Asp通过乙酰化COX-2,将AA代谢成15(R)-羟基二十碳三烯酸,从而触发脂氧素A4(LXA4)的产生[33]。在动脉中,LOX-5生物合成LXA4,在血小板中,LOX-12生物合成白三烯B4。炎症期间,LXA4在血管腔和管壁内形成,使这种脂质处于调节血管功能的有利位置[34]。研究发现,酚类化合物对PLA2的表达有很好的抑制作用。Singh等[35]证实,Asp能和PLA2发生特异性的结合,对其具有一定的抑制作用。此外,Wen等[36]证实,给大鼠长期饲喂Asp,能够增加大鼠肝线粒体的数量以及ALT和AST水平,引起CYP450的代谢活性改变;Asp具有抑制COX和LOX的作用,并能促进抗炎脂氧蛋白A4的产生[37]。近来研究显示,20-HETE下游信号通路激活的异常AA代谢与癌症的发生存在一定联系,为癌症的化学预防和治疗提供了新的分子靶点[38]。本试验RT-PCR结果表明,不同剂量的AEE处理能显著降低花生四烯酸代谢通路关键酶的mRNA表达量;与Asp和Eug组比较,等摩尔量的AEE能够显著降低花生四烯酸代谢通路关键酶PLA2的表达量,AEE的抗炎作用强于Asp;不同剂量的AEE之间差异不显著;试验结果表明,不同剂量的AEE处理对炎症因子和花生四烯酸代谢通路关键酶值都有降低作用,AEE与Asp、Eug的作用相当,同时不同剂量的AEE之间无统计学差异,但中剂量的AEE抗炎效果较好。
Balasundaram和David等[39]通过分子对接手段,研究Asp与PDE7B在神经炎症中的分子建模及对接分析。分子对接手段是一种基于受体特性以及受体与药物分子相互作用的设计方法,广泛应用于药物发现。最初,分子对接是为了帮助理解小分子和大分子之间的分子识别机制而开发的,可在分子水平上预测配体与受体的相互作用。经过不断的发展和完善,分子对接已广泛应用于药物和靶蛋白相互作用的研究中,并在新药研发领域有着重要作用。前期研究证实,分子与靶蛋白结合能越小,其结合能力越高[40]。在本研究中,通过分子对接探讨Asp、Eug、AEE与AA代谢通路关键酶的相互作用,结果显示,AEE与靶蛋白的结合能均低于-20.9 kJ,表明AEE与靶蛋白结合稳定且质量高。
4 结 论
本研究表明,AEE处理能够抑制LPS诱导的RAW264.7细胞中炎症因子IL-1β、IL-6、IL-8、TNF-α的表达水平,降低AA代谢通路关键酶COX-2、COX-1、PLA2、CYP450和5-LOX的mRNA表达量,且和靶蛋白结合能较低,具有良好的结合活性,推测AA代谢可能是其发挥抗炎作用的途径。
