基于网络药理学探讨黄芩素对猪丁型冠状病毒感染的潜在作用机制
2022-11-29刘贺娟史晨曦王美乐王栋涵魏战勇尹素改
刘贺娟,史晨曦,王 静,王美乐,王栋涵,魏战勇,尹素改*
(1.河南中医药大学医学院,郑州 450046; 2.河南农业大学动物医学院,郑州 450046)
冠状病毒(Coronaviruses,CoVs)是广泛存在于自然界的一大类人畜共患病毒,冠状病毒感染可造成人和其他动物呼吸道、消化道和神经系统的功能发生障碍。CoVs属于巢状病毒目、冠状病毒科、冠状病毒亚科的单股正链RNA病毒,冠状病毒亚科又被国际病毒学分类委员会分为α、β、γ和δ4个属[1]。人类和其它脊椎动物是冠状病毒的主要宿主,如2003年爆发的严重急性呼吸综合征病毒(SARS-CoV),2012年爆发的中东呼吸综合征病毒(MERS-CoV),均导致严重的呼吸道疾病甚至死亡[2]。2019年在武汉爆发并随之席卷全球的新型冠状病毒(SARS-CoV-2),是目前已知的第7种可感染人类的冠状病毒,截至2021年11月1日下午5:04,在全球范围内有246 594 191例COVID-19确诊病例,已造成近500万人死亡,给全球人类健康带来巨大威胁[3]。除了感染人以外,冠状病毒还可以感染家畜、家禽、鼠以及鸟类和蝙蝠等多种动物[4]。其中以猪的感染较为普遍,如猪呼吸道冠状病毒(PRCV)、猪传染性胃肠炎病毒(TGEV)、猪肠道α 冠状病毒(PEAV)、猪流行性腹泻病毒(PEDV)、猪丁型冠状病毒(PDCoV)等[5]。其中PDCoV是2014年在猪群中新发现的一种冠状病毒,主要引起7日龄以内的仔猪发生严重腹泻,仔猪感染PDCoV死亡率高达30%,给我国养猪业造成了巨大的经济损失[6]。据报道PDCoV还存在跨种传播的特性,可人工感染鸡、牛、鼠等,此外,从海地3名儿童血浆样品中也检测到突变后的PDCoV,表明PDCoV可能存在人畜共患的风险,对人类健康构成潜在威胁[7]。目前尚无PDCoV商品化疫苗或特异性药物上市。
近年来,中医药治疗冠状病毒取得了一定疗效,研究发现,中药小分子如黄酮类、生物碱类、多糖类、蒽醌类等是中药的关键活性成分,均能够促进细胞生长、增强机体免疫、减轻病毒感染[8]。因此,应用中兽医理论可以加速抗PDCoV天然药物的挖掘、研究和开发。黄芩为唇形科植物黄芩的干燥根,始载于《神农本草经》,性味苦寒,有“清热燥湿,泻火解毒,止血,安胎”之功效,广泛应用于临床,常与其他中药配伍用于治疗呼吸道感染、急性菌痢、病毒性肝炎、过敏性疾病和妇科疾病等。黄芩素是中药黄芩的主要活性成分,也是含量最高的黄酮类化合物之一。黄芩素被国家药典委员会正式命名为百可利(baicalein,BAI),别名黄芩苷元、黄芩黄素[9]。近年来有研究表明,黄芩素在抗病毒方面作用突出,既可以抗RNA病毒也可以抗DNA病毒,其显著的抗病毒作用近年来逐渐成为研究热点。黄芩素可诱导艾滋病病毒整合酶的构象变化,抑制逆转录酶活性从而影响病毒复制[10];通过阻止病毒的吸附,直接杀伤病毒以及抑制病毒复制等途径发挥抗登革热病毒的作用[11-12];能够剂量依赖地抑制流感病毒活性并减轻流感病毒所致的炎症反应等[13];还具有调节细胞因子,增强白细胞发挥先天抗病毒免疫的能力从而发挥抗水疱性口炎病毒的作用[14]。黄芩素可通过抑制病毒DNA合成,发挥抗人巨细胞病毒的作用;可以降低日本脑炎病毒的感染能力[15-16]。黄芩素对多种病毒都表现出良好的抗病毒活性,且安全性高,这种低毒高效的特性使其在抗病毒药物开发领域有着巨大优势。
网络药理学在“疾病-靶点-药物”多层次网络基础上,从整体上构建网络靶标,在药物和疾病之间建立源于疾病特异性网络的分子联系,综合分析中药的组成成分,预测药物治疗疾病的靶点,破译药物或中药配方的治疗效果机制及其可能的毒性和未知药理活性[17],减少不必要的摸索性科研研究,为药理作用及其机制研究开拓了新的思路,也为临床科研试验提供了新的理论支撑[18]。本研究使用网络药理学方法,从分子水平探索黄芩素抗PDCoV感染的机制。通过数据库搜索收集黄芩素的靶标,构建“药物-靶标-疾病”网络,确定网络中的重要核心基因,并对核心基因进行功能富集分析,找到黄芩素与PDCoV之间的关联,为黄芩素作为潜在的抗PDCoV感染药物的开发提供依据。
1 材料与方法
1.1 黄芩素结构检索及靶点获取
1.1.1 黄芩素结构检索 检索Pubchem(https://pubchem.ncbi.nlm.nih.gov/)有机小分子生物活性数据库获得黄芩素(Baicalein,CAS:491-67-8)的3D结构、PubChem-CID和SMILES文件。
1.1.2 黄芩素靶点获取 利用Pharmmapper(http://www.lilab-ecust.cn/pharmmapper/)、SEA Search Server(http://sea.bkslab.org/)、TCMSP(http://tcmspw.com/tcmsp.php)、Swiss Target Prediction(http://www.swisstarget-prediction.ch/)和STITCH在线数据库(http://stitch.embl.de/)检索黄芩素的作用靶点,将上述数据库检索得到的靶点进行去重整理后,通过Uniprot(http://www.uniprot.org/)蛋白质数据库将上述靶点蛋白转化为整理为Gene Symbol,构建黄芩素靶点的网络数据库。
1.2 黄芩素-靶点作用图的构建
采用Cytoscape 3.8.0软件构建“黄芩素-黄芩素靶点”网络,并运用Cytoscape的插件Network Analyze进行分析。
1.3 PDCoV感染相关靶点分析
PDCoV HNZK-02(基因序列号MH708123)以MOI=0.001的接毒量感染LLC-PK细胞(猪肾上皮细胞),分别于感染后1、6和18 h后收取蛋白样品送至杭州景杰生物公司进行蛋白质组学分析,筛选出有1.2倍差异表达的蛋白(P<0.05),通过Uniprot数据库将靶点蛋白转化为整理为Gene Symbol,构建PDCoV感染过程中的疾病靶点。
1.4 黄芩素抗PDCoV感染靶点筛选
采用Draw Venny Diagram(http:// bioinformatics.psb.ugent.be/webtools/Venn/)在线程序将PDCoV与黄芩素(BAI)靶基因取交集获得黄芩素与疾病的共同靶点,此集合为黄芩素治疗PDCoV感染的可能靶点。
1.5 PPI网络绘制及蛋白互作网络分析
将上述交集得到的75个共同靶点导入STRING(https://string-db.org/)数据库,构建PPI核心靶点网络图,设置置信度>0.400,其他参数保持默认值。将PPI网络互作关系导入Cytoscape软件中进行可视化分析,再利用CytoHubba以及MOCED插件对网络进行分析,按基因的核心程度进行排序筛选出关键的子网络和top10的核心靶点。
1.6 GO和KEGG分析
将黄芩素靶点与PDCoV相关靶点的交集靶点导入Metascape进行GO功能富集和KEGG通路富集分析(https://metascape.org/gp/index.html#/main/step1)。选择Custome Analysis,P-value<0.01,其他选择系统默认设置,按照排序在Gene List Summary下分别选择GO功能分析(包括GO Biological Process(BP):生物过程;GO Cellular Component(CC):细胞组成;GO Molecular Function(MF):分子功能)以及KEGG Pathway。下载富集分析文件,GO仅展示前10条具有统计学显著差异的结果;通过设置count值及In Term Inlist值,KEGG展示前20条具有统计学显著差异的结果。利用微生信(http://www.bioinformatics.com.cn/)在线做图将Metascape分析出的结果制作成高级气泡图并导入Cytoscape 3.8.0构建“药物-疾病-靶点-通路”网络图。
1.7 体外验证试验
1.7.1 药物、细胞、毒株 黄芩素购自成都曼思特生物科技有限公司(货号:A0018,CAS:491-67-9,HPLC≥98%),溶解于DMSO,母液浓度为20 mg·mL-1,分装避光保存在-20 ℃冰箱。试验所用猪睾丸细胞(ST)购自中国兽监察所并由河南省动物性食品安全重点实验室传代保存。本试验所用毒株为本实验室分离保存的PDCoV毒株 HNZK-02(GenBank登录号:MH708123),P33代,病毒滴度为108.75TCID50·mL-1。ST细胞用含10%胎牛血清(批号 04-001-1A,BI)的DMEM高糖培养基(批号:PYG0003,博士德)培养。实时荧光定量PCR(qRT-PCR)试剂盒购自南京诺唯赞公司(批号:Q341-02)。
1.7.2 试验过程 ST细胞复苏后经传代3次用于本试验,细胞接种于12孔板约24 h后,将细胞分为正常细胞对照组(Con)、阳性感染组(PDCoV)、黄芩素组(PDCoV+BAI)、以及黄芩素对照组(BAI),每组设3个重复。PDCoV组和PDCoV+BAI组用PDCoV(MOI=1)感染ST细胞,于37 ℃细胞培养箱吸附1 h后弃液,用D-Hanks洗2遍,Con组和PDCoV组加入无血清DMEM,PDCoV+BAI、BAI组加入黄芩素终浓度为50 μg·mL-1的无血清DMEM,培养18 h后收集细胞,提取样品中的总RNA,并反转录成cDNA,采用实时荧光定量(qRT-PCR)方法检测细胞中PI3K、AKT和NF-κBmRNA的相对表达水平(以β-actin作为内参基因),根据本实验室建立的PDCoV绝对荧光定量PCR方法计算PDCoV S基因组拷贝数。试验所用引物序列见表1。

表1 qRT-PCR引物序列
2 结 果
2.1 黄芩素和疾病靶点基因的收集和整理
输入关键词:baicalein,通过Pharmmapper得到化合物预测靶点89个;通过SEA Search Server获得化合物预测靶点13个;通过SwissTarget Prediction获得化合物的预测靶点104个;通过TCMSP数据库获得化合物靶点37个;通过Pubchem获得化合物相关靶点88个;通过STITCH化学物质相互作用数据库获取与黄芩素相关靶点12个;去重整理后得到黄芩素的有效作用靶点共计268个。疾病靶点的获取:对不同时间点样品蛋白组学结果整理分析,共得到1 771个下调靶点,1 997个上调靶点。
2.2 黄芩素与黄芩素靶点网络构建
将得到的268个黄芩素靶点导入Cytoscape得到图1。该网络由269个节点(黄芩素和268个黄芩素靶点)、268条边组成。外环紫色凹四边形代表黄芩素靶点,中间黄色菱形代表黄芩素。
图1 黄芩素-黄芩素靶点网络
2.3 黄芩素主要靶点-PDCoV共同靶点
运用Draw Venny Diagram在线程序将收集的黄芩素主要靶基因和PDCoV感染相关靶基因集取交集后共获得75个黄芩素治疗PDCoV感染的潜在靶点(图2),左侧紫色圆圈为黄芩素有效成分靶点,右侧为PDCoV感染相关靶点,中间交集为黄芩素抗PDCoV感染的潜在靶点。
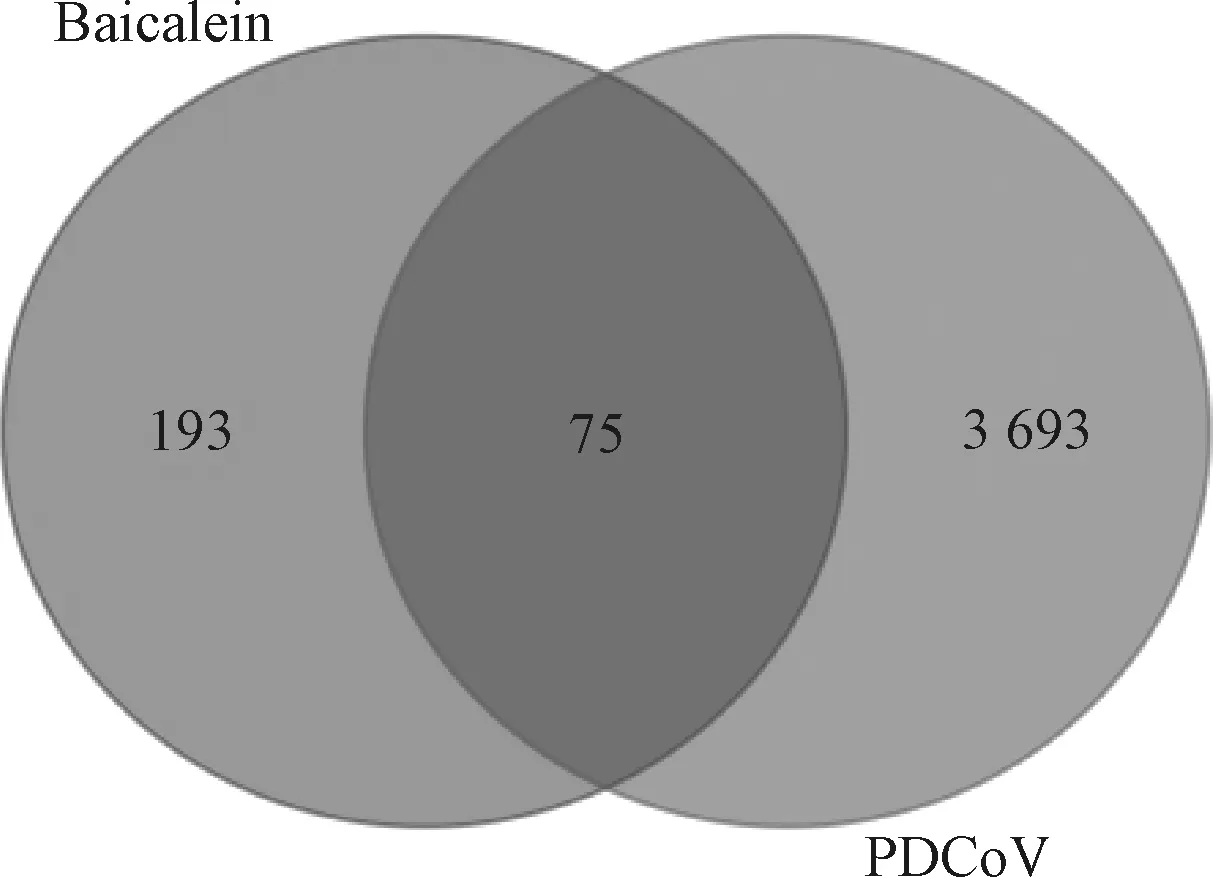
图2 黄芩素-抗PDCoV感染韦恩图
2.4 黄芩素抗PDCoV感染PPI网络绘制及蛋白网络互作分析
将单体与疾病共同靶点导入String数据库,线条的粗细程度反映蛋白间互作关系的强弱,隐藏网络中断开连接的节点,得到黄芩素抗PDCoV感染PPI网络图(图3),该PPI靶点网络由75个节点和480条边组成,平均节点度为12.8,平均局部聚类系数为0.554,预期的边数为分223,PPI富集P值<1.0×10-16。将PPI所得结果导入Cytoscape并利用MCODE插件可视化分析并寻找关键蛋白和3个主要子网络(图4)。其中红色代表上调基因,绿色代表下调基因,cluster 1得分15.444,cluster 2得分6.364,cluster 3得分5,越靠近圆环中心,节点越大,相关性越大,表示与其他靶点联系越紧密。表2展示了3个主要子网络的节点、边数以及靶蛋白。利用Cytoscape的插件Cytohubba根据蛋白的degree对网络数据进行拓扑学分析,选取节点top10的关键蛋白(表3),黄芩素抗PDCOV的关键靶点蛋白为AKT1、HSP90AA1、SRC、EGFR、CASP3、MAPK1、STAT3、FN1、RHOA、MAPK3,图5展示了关键靶蛋白的互作网络图,颜色越深代表在网络中越重要。
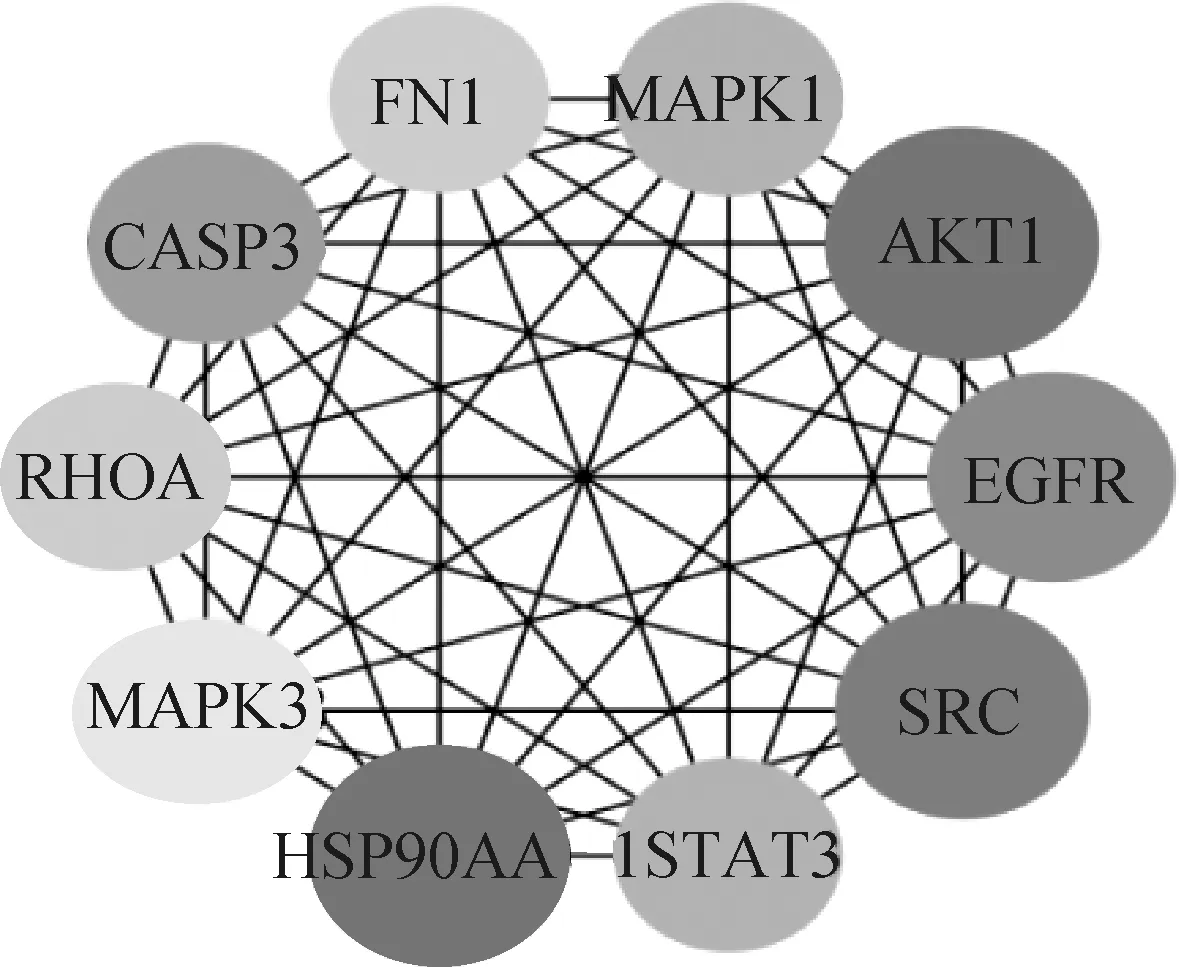
图5 关键靶蛋白互作网络图

表2 黄芩素-PDCoV共同靶点的Cluster数据
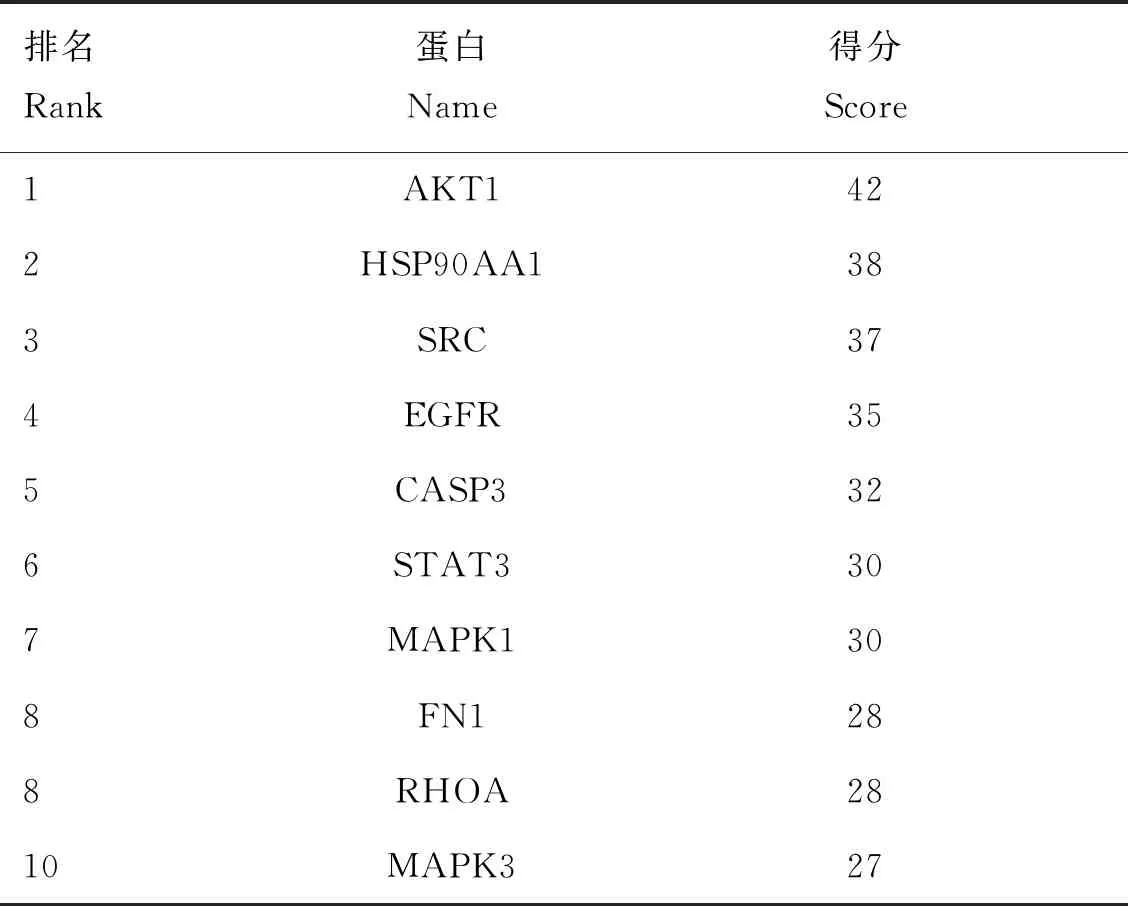
表3 黄芩素抗PDCoV感染的关键靶蛋白
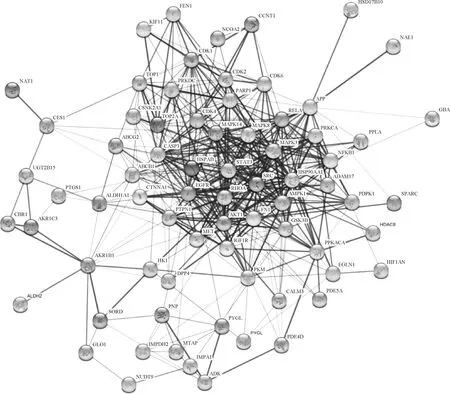
图3 靶蛋白互作PPI网络图
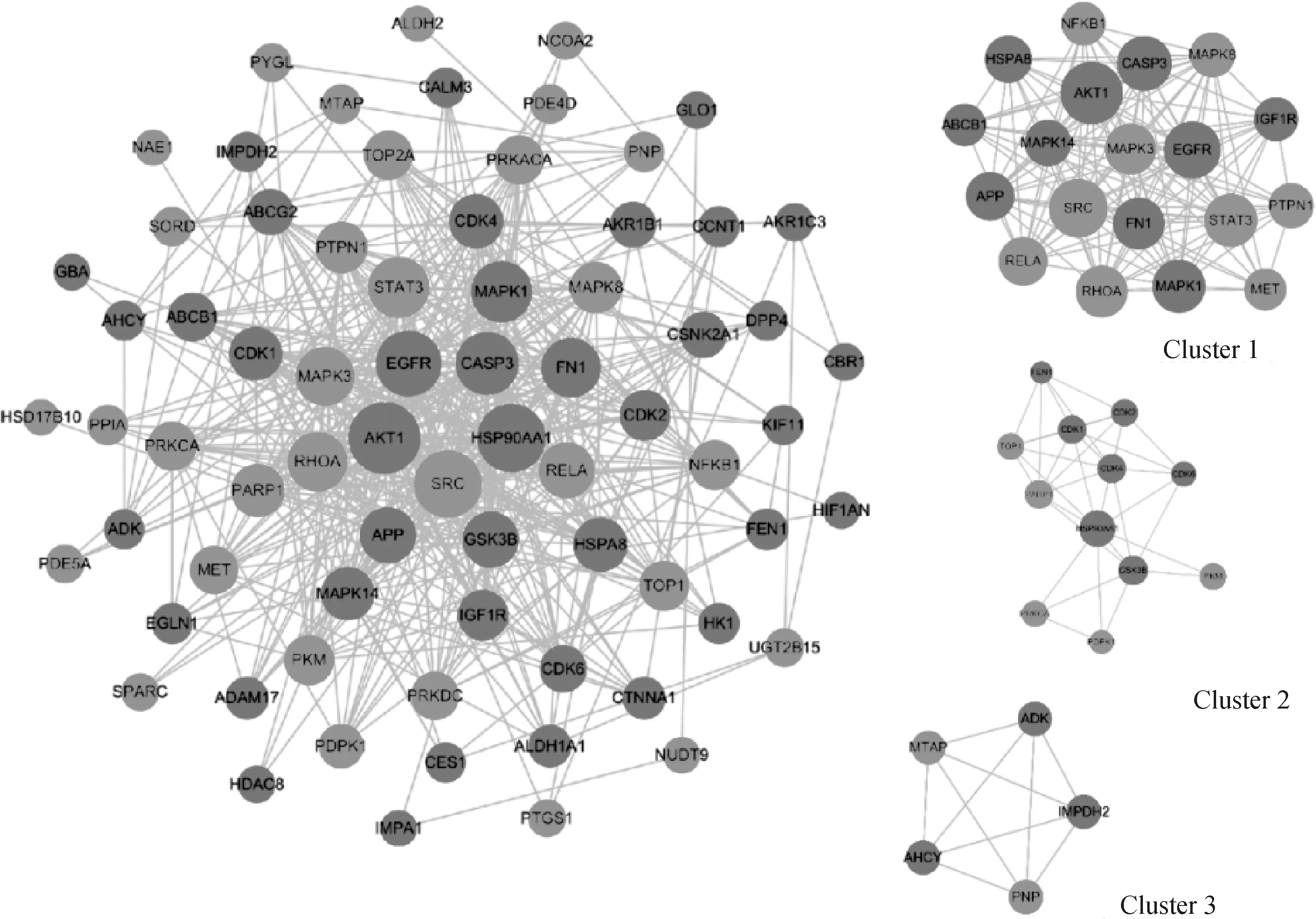
图4 靶蛋白互作及主要子网络图
2.5 GO富集分析结果
将黄芩素可能对PDCoV感染发挥作用的核心基因靶点导入Metascape进行基因本体(GO)功能富集分析(图6)以及KEGG通路富集分析(图7)。GO富集分析发现,黄芩素抗PDCoV感染的靶点基因影响的生物过程有941个,生物组分有47个,分子功能有90个,按P值大小将排在前10的结果输入到微生信平台制作富集BP,CC,MF三合一柱状图(图6)。横轴为黄芩素抗PDCoV感染可能通过的生物过程、生物组分和分子功能的GO名称,纵轴为富基基因的靶点数量。由图可知,丝氨酸修饰、JNK信号级联、糖代谢和单羧酸代谢过程是黄芩素参与抗PDCoV感染中的重要生物过程;细胞周期蛋白依赖型的蛋白激酶、细胞膜筏、线粒体膜和纺锤体等是黄芩素参与抗PDCoV感染中的重要的生物组分;磷酸转移酶活性、蛋白激酶活性、蛋白结构域结合活性、MAPK激酶活性等是黄芩素参与抗PDCoV感染中的重要分子功能。
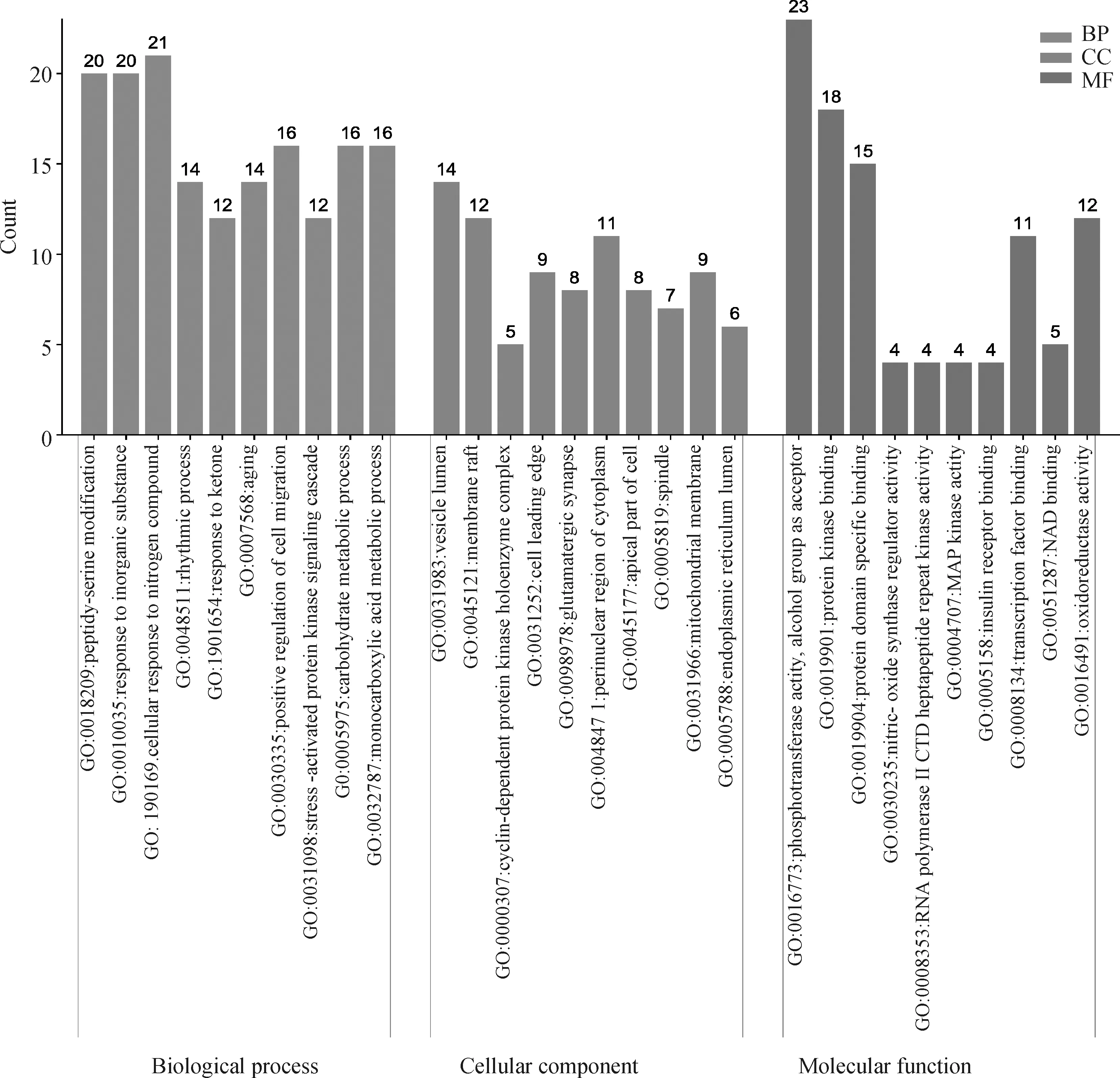
图6 黄芩素-抗PDCoV感染GO富集分析部分结果(前10)
KEGG通路富集分析结果显示,共筛选得到277条信号通路(P<0.01),整理分析筛选得到的数据,通过设置Count值及In Term Inlist,选择通路上蛋白富集多,排名靠前的信号通路,利用微生信平台,展示前20条具有统计学显著差异的结果(图7)。黄芩素-抗PDCoV感染的核心靶点基因主要参与癌症、肝炎、PI3K-Akt通路、EB病毒感染、缺氧诱导因子1信号通路、MAPK信号通路等,提示黄芩素治疗PDCoV感染可能是通过这些通路发挥作用的。

图7 KEGG分析结果气泡图(前20)
2.6 黄芩素-PDCoV感染-靶点-通路网络分析
通过KEGG分析结果,将通路和靶点导入Cytoscape,获得了“黄芩素-PDCoV感染-靶点-通路”网络图(图8),共有53个节点和735条边,外环菱形代表KEGG富集得到的前20个参与黄芩素抗PDCoV感染的信号通路,中环圆形代表黄芩素抗PDCoV感染的关键靶蛋白,中心多边形代表PDCoV感染,其上方的箭头代表黄芩素。
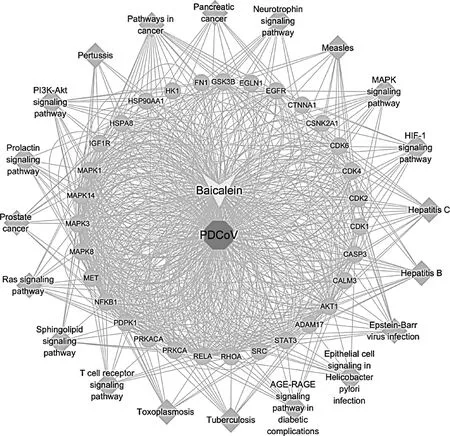
图8 “黄芩素-PDCoV感染-通路”网络图
2.7 体外验证黄芩素对PI3K-AKT及其下游基因表达的影响
首先在ST细胞上检测黄芩素对PDCoV复制的影响,结果如图9所示,与PDCoV组相比,黄芩素处理极显著降低了PDCoV的基因组拷贝数(P<0.001)。随后检测了黄芩素在抑制PDCoV感染程中对PI3K-AKT信号通路及其下游基因表达的影响(图9)。试验结果表明,与Con组相比,PDCoV组PI3K、AKT和NF-κB的表达量极显著升高(P<0.001);与PDCoV组相比,黄芩素处理显著降低了PI3K(P<0.001)、AKT(P<0.05)和NF-κB(P<0.001)的mRNA表达量(P<0.001)。
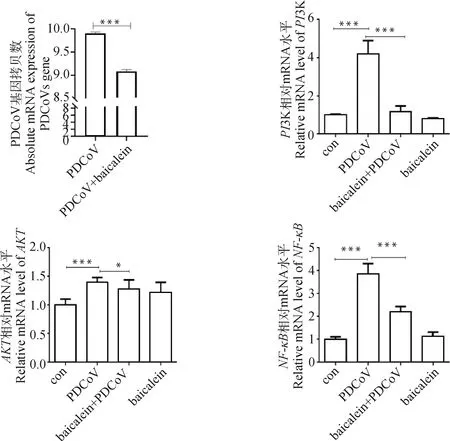
*P<0.05表示差异显著,**P<0.01、***P<0.001表示差异极显著。
3 讨 论
近年来,冠状病毒对人和动物的威胁日益加剧,给全球公共卫生安全带来巨大威胁。冠状病毒存在跨种传播,能够感染鸟类、老鼠、蝙蝠等其他野生动物,并通过在中间宿主家畜和家禽中的传播感染人类[19]。冠状病毒感染仔猪会导致病毒性腹泻,哺乳仔猪死亡率可高达90%,并可感染不同年龄段的猪,具有高致病性、高阳性率、高死亡率的特点,危害大,更应引起重视[20-21]。目前,尚未研制出抗PDCoV的疫苗和特异性药物,天然产物是开发抗病毒药物的一个方向,应用好中华传统医药对开发抗病毒新药研究十分重要。黄芩是中药组方中最常用药物之一,通过分子对接发现黄芩中的重要活性物质黄芩素与SARS-CoV-2 3CL水解酶结合性强,体外试验表明黄芩素可有效抑制SARS-CoV-2 3CL水解酶的活性,其显著的抗病毒作用近年来逐渐成为研究热点,有望开发成广谱抗冠状病毒药物[22-24]。黄芩素是从中药黄芩中提取的黄酮类化合物,含量较高,具有抗病毒、抗炎、免疫调节、抗菌、抗肿瘤等多种功效[25]。黄芩素可能通过抑制ATP合成酶活性抑制大肠杆菌感染,且可以通过阻止病毒黏附,抑制细胞因子的产生等多种方式抑制病毒感染[26-27]。但这都不足以揭示其复杂的抗病毒机制,因而可以借助网络药理学针对性地深入探索其抗病毒感染机制。
本研究采用了TCMSP、Pharmmapper、Pubchem、STITCH和Swiss Targer Prediction数据库等数据库进行分析,这些数据库相对权威也更全面。以PharmMapper为例,该数据库整合了TargetBank、DrugBank、BindingDB和PDTD中的所有目标中提取的大型内部药效团数据库支持,寻找所有靶标的最佳映射姿势,是一个相对权威的药物靶点数据库。TCMSP以系统药理学为基础,囊括《中国药典》,提供了丰富的活性成分、作用靶点以及相关疾病资料且被广泛认可引用。网络药理学为研究药物作用机制和新药开发提供了新思路,但同时也面临挑战,比如中医药数据积累不足,数据的质量受限于生物技术的发展等[17,43]。为了使药物靶点更全面准确,本研究分别在各个具有权威性的数据库进行了查询,随后对查询结果进行去重处理,因此,药物靶点是较为全面准确的。通过挖掘多个化合物靶点数据库和本实验室前期蛋白质组学的数据(数据尚未发表),发现了75个黄芩素抗PDCoV感染的潜在靶点。通过PPI网络寻找这其中的关键子网络,发现了包含36个关键蛋白的3个子网络,其中包括调控炎症反应的STAT3、NFB1、MAPK1等,与细胞凋亡相关的CASP3、MAPK8、MAPK14、SRC、AKT1等,与细胞自噬有关的AKT1、MAPK3、MAPK8、IGF1R等,与细胞周期有关的CDK1、CDK2、CDK4、CDK6、SRC、AKT1等,以及参与蛋白质正确折叠的HSPA8、HSP90AA1等,说明黄芩素抗PDCoV感染的作用机制除了调控炎症反应、细胞凋亡与细胞自噬,还参与调控了细胞周期和蛋白质折叠等其它机制。
GO富集分析结果发现,在分子功能方面,磷酸转移酶的活性、蛋白激酶的结合能力和特定蛋白结构域的结合能力富集因子最多,结合生物过程中富集因子最高的丝氨酸修饰分析,提示一些受磷酸化影响的信号通路可能在黄芩素抗PDCoV感染中发挥重要的功能。在细胞组成中,富集分析表明,细胞周期蛋白依赖型的蛋白激酶可能在黄芩素抗PDCoV感染的过程中起着重要作用。研究显示,在多种猪冠状病毒感染中,病毒感染可以调控细胞周期。如猪传染性胃肠炎病毒可诱导细胞阻滞在S期和G2/M期,且经UV灭活的病毒不能阻滞细胞周期,表明细胞周期阻滞依赖于病毒感染[28];另有研究显示,猪流行性腹泻病毒感染细胞后,细胞周期阻滞在G2/M期[29],表明细胞周期在病毒感染过程中起着重要的作用。黄芩素通过下调细胞周期蛋白依赖性的蛋白激酶,将HeLa细胞周期阻断在G0/G1期,从而抑制细胞迁移和诱导细胞凋亡来治疗宫颈癌[30]。本研究显示,黄芩素可能是通过调控细胞周期蛋白依赖型的蛋白激酶的表达,调节PDCoV感染引起的细胞周期阻滞,从而发挥抗病毒感染的作用。
KEGG富集分析结果筛选得到277条信号通路(P<0.01),鉴于富集通路较多,在数据分析中通过设置Count值,以及InTerm Inlist值,选择通路上富集蛋白多且排名靠前的前20条信号通路。黄芩素抗PDCoV感染的关键靶点主要富集在癌症通路、PI3K-Akt信号通路、Ras信号通路和MAPK信号通路。其中富集因子最大的是癌症通路,主要受上述讨论的细胞周期影响及上调的差异蛋白AKT1、EGFR等表达量的影响。目前对PDCoV致病机制研究较少,天然免疫应答可能起重要作用[31],研究证实PDCoV感染会引起炎症、自噬、凋亡等[32-33]。PI3K/AKT信号通路、Ras信号通路和MAPK信号通路均是由磷酸化修饰级联介导的信号通路,这一现象与GO分析得到的结果相一致。PI3K-Akt信号通路作用很广,参与调控多种细胞进程,如细胞凋亡、细胞自噬、蛋白合成、细胞分化、DNA修复等。PI3K-Akt信号通路被激活后,会磷酸化凋亡调控蛋白caspase9来使其失活,从而产生抗凋亡作用[34];除此以外,PI3K-Akt信号通路还能通过抑制线粒体凋亡蛋白的释放发挥抗凋亡功能[35]。凌云等[36]的研究证明,黄芩素可以通过抑制Akt/mTOR信号通路增加乳腺癌细胞中LC3-Ⅱ/LC3-Ⅰ的比例,进而诱导细胞自噬。在胃癌细胞系上的研究表明,黄芩素也可以通过PI3K-Akt信号通路来诱导细胞自噬,从而发挥抗癌作用[37]。本研究的研究结果提示,黄芩素抗PDCoV感染的机制可能与PI3K/AKT信号通路调控的细胞自噬和炎症有关。与PI3K-Akt信号通路一样,Ras信号通路和MAPK信号通路的作用也十分广泛,参与调控细胞分化、自噬、凋亡、增殖和炎症反应,且这三个通路之间可以形成网络相互影响。孙晓林[38]研究证明,绵羊肺腺瘤病毒的囊膜蛋白可以激活Akt和MAPK信号通路,调控Beclin1的表达从而抑制细胞自噬。在流感病毒H1N1感染过程中,研究发现有MAPK信号通路的参与,且应用疏清颗粒可以通过调控MAPK信号通路来干预病毒感染[39]。王慧莲等[40]的研究表明,在类风湿关节炎成纤维样滑膜细胞中,汉黄芩素可以激活MAPK信号通路来诱导细胞凋亡。通过抑制Ras信号通路,黄芩素能够将细胞周期阻滞在G1期,从而诱导宫颈癌细胞凋亡,该研究提示,在宫颈癌的发生和发展过程中,Ras信号通路参与调控细胞周期,而应用黄芩素可以抑制癌症的发生和发展[41]。随着数据库不断的更新、计算机算法的精进以及生物技术的发展,多学科交叉协作将为研究人员提供更可靠的信息。鉴于网络药理学揭示药物对疾病的作用机制仍存在局限性,比如忽略了部分数据库的更新、算法的精进、各数据库间的对比等,研究还需要结合临床和科学验证[42-43]。结合PDCoV的可能致病机制和病理生理过程,因此,本研究选择了PI3K-AKT通过体外细胞试验初步验证了网络药理学的预测结果,为进一步的深入研究奠定了基础。
4 结 论
综上所述,本研究表明黄芩素主要作用于AKT1、HSP90AA1、SRC、EGFR、CASP3、MAPK1等关键靶蛋白,并通过调节PI3K-Akt、Ras和MAPK等多个信号通路,从而发挥抗PDCoV感染的作用。本文借助生物信息学相关技术和方法,通过对关键靶点、生物过程和信号通路的分析,全面系统地研究了黄芩素抗PDCoV感染的潜在作用机制,揭示了黄芩素是通过多靶点、多通路、多机制来抑制PDCoV的感染。虽然本研究只是针对黄芩素抑制PDCoV感染作用机制进行了预测,还存在局限性。但是,本研究将中医药理论与网络药理学联合应用,进行科学的预测,减少了不必要的摸索性试验研究,大大节省了时间、科研经费,为抗猪丁型冠状病毒天然药物的挖掘、研究和开发,提供了新的理论支撑,同时也为其他动物类疾病的研究提供思路与方向。
