磁敏感加权成像在脑胶质瘤鉴别诊断、术前病理分级及术中的应用
2022-11-29哈热勒哈什安曼太巴图尔吐尔地
哈热勒哈什·安曼太,巴图尔·吐尔地
新疆维吾尔自治区人民医院放射科,新疆 乌鲁木齐 830001
作为临床颅内原发性肿瘤常见类型,胶质瘤具有较高的恶性程度,其发生率占中枢神经系统恶性肿瘤约80%,相较于其它肿瘤,脑胶质瘤往往预后较差,中位生存时间短,且患者术后仍具有较高的复发率[1-3]。胶质瘤呈现浸润生长,较难和正常组织区分开来,同时手术彻底清除难度高。临床上术前通过影像学检测对胶质瘤进行分级,准确评估其恶性程度,对于治疗方案制定、手术成功率的提高具有重要意义[4-5]。常规MRI增强检查主要反映肿瘤坏死、囊变、血脑屏障情况,在反映肿瘤血管信息以及功能代谢状态方面存在不足[6-7]。磁敏感加权成像(SWI)分辨率高,基于不同组织存在的磁敏感差异,通过运用高分辨扫描、最小密度投影等显示瘤体中的引流静脉以及出血产物。既往对于SWI在脑胶质瘤诊断中的应用研究较多,但对于其在脑胶质瘤手术指导中的应用相关研究较少[8-10]。本研究分析SWI技术在脑胶质瘤鉴别诊断、术前病理分级及手术指导中的应用效果,旨在为疾病诊断与术前评估提供参考,报告如下。
1 资料与方法
1.1 一般资料
回顾性分析新疆维吾尔自治区人民医院2018年10月~2021年10月经手术及组织病理学检查证实为脑胶质瘤(n=64)、单发脑转移瘤(n=15)和颅内淋巴瘤(n=15)的患者的临床资料。纳入标准:手术及病理证实为脑胶质瘤、单发脑转移瘤或颅内淋巴瘤;接受常规MRI及SWI序列扫描检查;检查前未接受过放化疗或者是其它抗肿瘤治疗;图像质量较佳且一般资料完整。排除标准:脑外伤或既往脑部手术史;合并血管畸形;颅内压严重增高或脑疝;合并严重精神疾病;胶质瘤治疗后复发;存在幽闭恐惧症或造影剂过敏。64例脑胶质瘤患者中,男37例,女27例,年龄42~76(57.93±7.91)岁。所有病例均经手术及病理证实,按世界卫生组织分类标准[11],将其分为低级别、高级别胶质瘤,其中低级别27例(I级8例,II级19例),高级别37例(III 级22例,IV级15例)。本研究经医院伦理委员会批准通过(伦理号:KY2021042004)。
1.2 方法
1.2.1 检查方法 采用Philips Ingenia 3.0T MR扫描仪,8通道头线圈,仰卧,头部置线圈,嘱患者平静呼吸。依次行常规平扫、SWI、DSC-PWI、常规增强扫描。定位:GRE序列,TR、TE分别为5.46 ms、1.52 ms,矩阵:512×512,采集1次,层厚、层间距分别为5.0 mm、10 mm。常规扫描:OAxT2WI,TR、TE分别为5200 ms、117.7 ms,层数、层厚、层间距分别为20、5.0 mm、1.0 mm,视野:23×23,矩阵:385×385,NEX=1.5。T2-FLAIR:TR、TE分别为8000 ms、146.8 ms,层数、层厚、层间距分别为20、5.0 mm、1.0 mm,FOV:22×22,矩阵:322×190,NEX=1,OAx T1 FLAIR:TR、TE 分别为2690 ms、26.5 ms,层数、层厚、层间距分别为20、5.0 mm、1.0 mm,视野23×23,矩阵:330×225,NEX=1。SWI扫描:三维梯度回波序列,轴位TR、TE分别为49 ms、4.0 ms,FOV:23×23,矩阵:450×320,翻转角15°,NEX=0.69,层厚、层间距分别为2.0 mm、0。DSC-PWI扫描:梯度回波-平面回波成像,参数:TR、TE分别为1600 ms、23.8 ms,FOV:矩阵125×125,NEX=1,层数、层厚、层间距分别为18、5.0 mm、1.0 mm。静脉Gd-DTPA(0.1 mmol/kg,速率4 mL/s)团注,预扫描完成后,注射过程中开启PWI,时相50个,得到ROI增强图像,注射生理盐水20 mL,行横断、矢状、冠状面T1WI扫描。
1.2.2 图像分析 后处理图像由2位影像科医师共同评估,定量分析,结果协商一致。瘤内磁敏感信号强度(ITSS)分级[12]:肿瘤内部伴或者不伴成簇低信号细线或点状结构,分级:依据点或线状ITSS的数量,无为0级;1~5 个为I 级;6~10 个为II 级;11 个及以上为III 级。CBV伪彩图设置ROI,选择灌注最大层面,ROI置最丰富血供区域4~6次,选择单次最大值,另外将兴趣区置对侧镜像脑白质区,测定CBV值,两者相比得到相对脑血容量(rCBV)。
1.3 统计学分析
采用SPSS20.0统计学软件进行数据分析,计量资料以均数±标准差表示,组间两两比较采用t检验;计数资料以n(%)表示,组间比较采用χ2检验,等级资料比较采用非参数秩和检验;以病理检查结果作为金标准,通过ROC曲线确定SWI成像鉴别诊断价值。以P<0.05代表差异有统计学意义。
2 结果
2.1 高级别脑胶质瘤与单发脑转移瘤ITSS分级、肿瘤实质区rCBV值比较
高级别脑胶质瘤与单发脑转移瘤ITSS分级、肿瘤实质区rCBV值比较(P>0.05);高级别脑胶质瘤周水肿区rCBV值高于单发脑转移瘤(P<0.05,表1)。
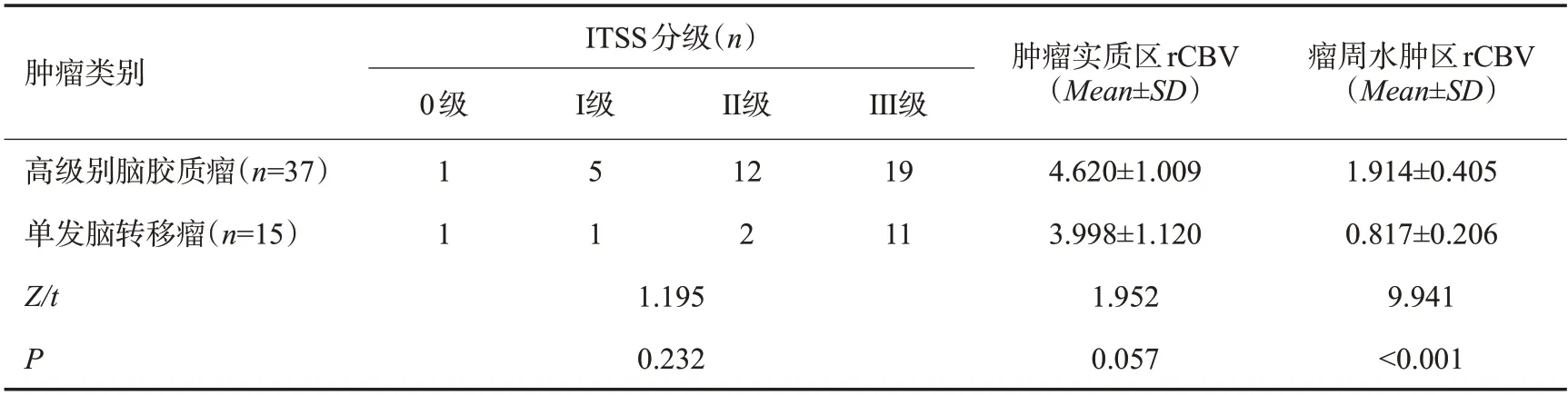
表1 高级别脑胶质瘤与单发脑转移瘤ITSS分级、肿瘤实质区rCBV值比较Tab.1 Comparison of ITSS grade and rCBV value in tumor parenchyma between high-grade glioma and single brain metastasis
2.2 高级别脑胶质瘤与淋巴瘤ITSS分级、出血率、血管结构半定量评分比较
高级别脑胶质瘤ITSS分级程度低于淋巴瘤,血管评分高于淋巴瘤(P<0.05,表2)。
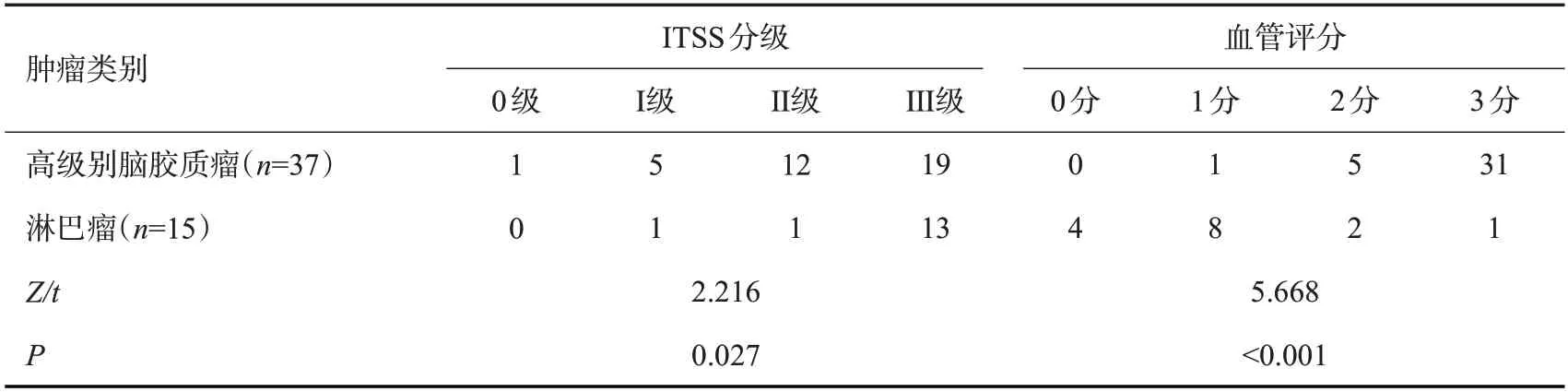
表2 高级别脑胶质瘤与淋巴瘤ITSS分级、出血率、血管结构半定量评分比较Tab.2 Comparison of high-grade glioma and lymphoma in ITSS grade,bleeding rate and semi-quantitative score of vascular structure(n)
2.3 高、低级别胶质瘤ITSS分级与肿瘤实质区rCBV值比较
高级别胶质瘤ITSS分级高于低级别胶质瘤,肿瘤实质区rCBV值高于低级别胶质瘤(P<0.05,表3)。
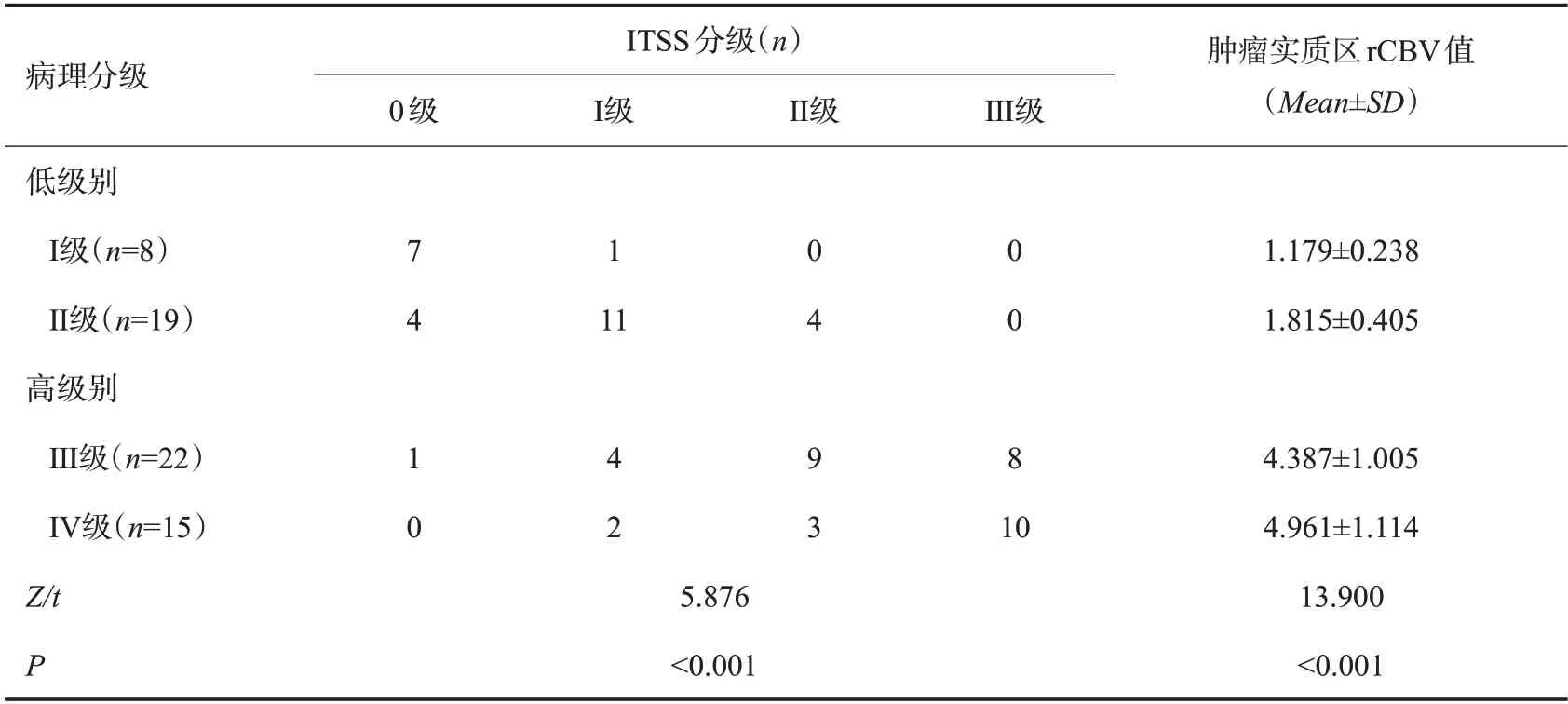
表3 高、低级别胶质瘤ITSS分级与肿瘤实质区rCBV值比较Tab.3 Comparison of ITSS grade and rCBV value in tumor parenchyma of high and low grade gliomas
2.4 胶质瘤分级与ITSS分级、rCBV值的相关性分析
Spearman相关性分析结果显示,胶质瘤分级与ITSS分级、rCBV值呈正相关关系(r=0.728、0.851,P<0.05)。
2.5 ITSS分级与rCBV值对脑胶质瘤分级的诊断评估价值
ITSS分级评估脑胶质瘤高级别ROC曲线下面积为0.894,敏感度、特异性、准确度分别为81.08%、85.19%、82.81%,rCBV值评估脑胶质瘤高级别ROC曲线下面积为0.937,敏感度、特异性、准确度分别为91.89%、88.89%、90.63%(表4、图1)。
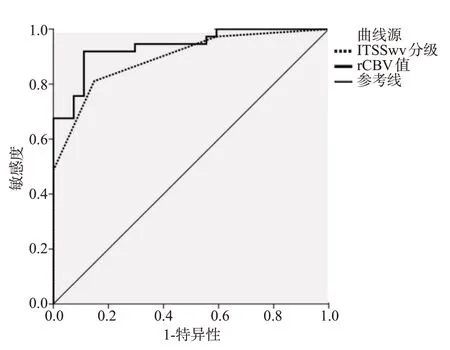
图1 ITSS分级与rCBV值对脑胶质瘤分级的诊断评估价值Fig.1 Diagnostic value of ITSS and rCBV for glioma grading.
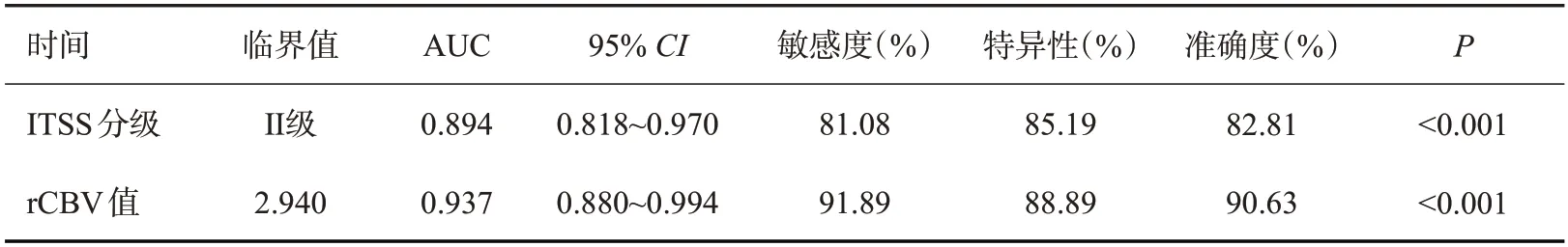
表4 ITSS分级与rCBV值对脑胶质瘤分级的诊断评估价值Tab.4 Diagnostic value of ITSS grading and rCBV value for brain glioma grading
2.6 SWI在脑胶质瘤手术指导中的应用
和常规序列相比,SWI序列对于肿瘤边界的显示更为清晰,同时可呈现肿瘤微小血管病变信息,手术证实SWI序列显示伴出血者该区域血运丰富,低级别脑胶质瘤、高级别脑胶质瘤肿瘤实质区rCBV值均高于瘤周水肿区rCBV值(P<0.05,表5)。
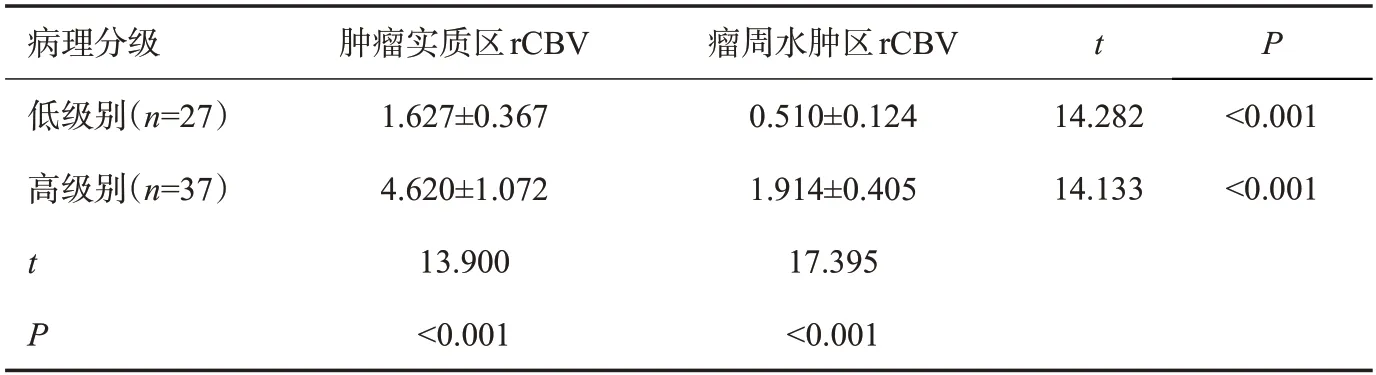
表5 脑胶质瘤肿瘤实质区、瘤周水肿区rCBV值比较Tab.5 Comparison of rCBV values in tumor parenchyma and peritumoral edema of glioma(Mean±SD)
2.7 病例分析
病例1:男,54岁,左侧肢体疼痛伴麻木无力1月,加重3 d。MRI表现:扣带回异常信号,呈稍长T1稍长T2信号,DWI为稍高信号或等高混杂信号,较大者大小约为26 mm×18 mm,部分病变显影不清,周围可见大片状水肿影。增强扫描呈明显不均匀强化,SWI示扣带回右旁病变周围可见半环形低信号。病理:多形性黄色星形胶质细胞瘤,世界卫生组织II级(图2)。
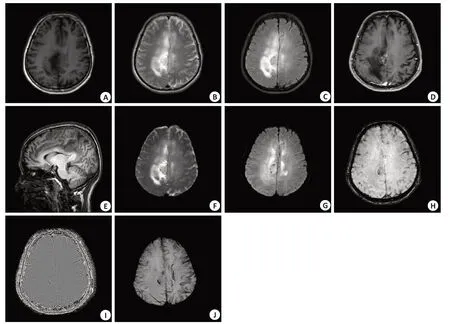
图2 病例1 MRI检查结果Fig.2 MRI results of case 1.
病例2:男,58岁,MRI表现:右额叶巨大混杂信号占位,大小约7.0 cm×6.1 cm×6.2 cm,病变在T1呈混杂稍低信号,其内斑片状更低信号及斑片状高信号,在T2呈混杂稍高信号,间以更高信号及线样、斑片状低信号,DWI混杂稍高信号,边缘可见环形高信号,病变内可见大片状低信号,占位效应明显,周围脑组织水肿,增强扫描显示实性成份不均匀强化明显,右侧侧脑室前角受压、变窄,中线结构向对侧移位明显。头颅SWI显示右额叶占位内可见团片状、结节状低信号影及粗大血管影。病理:间变性少突胶质细胞瘤,世界卫生组织III级(图3)。
3 讨论
脑胶质瘤是一种临床难治愈的中枢神经系统恶性肿瘤,侵袭性生长、易复发是导致疾病疗效差、预后不良的重要原因,即使经过手术切除治疗,复发率仍高达80%以上,5年生存率极低[13-14]。目前,常规MRI序列脑肿瘤扫描检测仅能显示肿瘤边界、囊变、强化,内部结构如出血灶、肿瘤血管增生等显示效果不佳,而SWI可有效弥补上述不足[15-16]。相关研究表明[17-18],肿瘤新生血管与其恶性程度的高低密切相关,恶性程度高者往往生长情况也更加活跃,血管大量生成,这些尚未成熟的血管具有较高的通透性,淋巴管引流较为缺乏,瘤体压力高、血液粘稠度高,再加上肿瘤细胞对血管的压迫,使得血液中去氧血红蛋白大量生成,有利于SWI成像,故SWI 可较为直观显示肿瘤血供,反映肿瘤恶性程度,同时SWI还可显示肿瘤周围静脉[19-20]。
脑转移瘤单发较为少见,但单发脑转移瘤与高级别胶质瘤的鉴别存在一定的困难。本研究中两种肿瘤ITSS分级无差异,且肿瘤实质区rCBV值亦无差异,两种肿瘤类型均属于富血供病变,均表现为rCBV值较大,根据肿瘤实质区rCBV值鉴别二者意义不大[21-22]。本研究中高级别脑胶质瘤周水肿区rCBV值高于单发脑转移瘤,这可能是由于胶质瘤为浸润性生长,肿瘤实质与周围脑组织的分界不明显;而脑转移瘤生长方式为膨胀性生长,肿瘤与正常组织分界较为清晰,同时因转移瘤膨胀性生长,血脑屏障破坏致使脑水肿发生,瘤周正常脑组织血管受压变细,rCBV值降低[23-24]。脑淋巴瘤临床较罕见,其与胶质瘤影像学特征存在交大相似性,临床鉴别存在一定困难。本研究中高级别脑胶质瘤与淋巴瘤ITSS分级、血管评分的差异均有统计学意义,高级别胶质瘤有明显的血管生成,此外因肿瘤血管迂曲、管壁脆、易破裂,形成点或片状出血灶;而颅内淋巴瘤缺乏血供,出血较为少见。
根据世界卫生组织分级可将胶质瘤分为I~IV级,其中I、II级为低级别,III、IV 级则为高级别,低级别一般预后良好,而高级别往往预后差,术后常需辅助治疗,术前准确分级对于患者治疗方案的制定具有重要意义。肿瘤血管生成是肿瘤病理分级重要指标,新生血管一方面为瘤细胞生长提供营养物质,另一方面也为瘤体侵袭提供相应途径。ITSS为磁敏感信号强度,MRI显示为瘤内低信号区域,表现为点、线状结构。有研究显示SWI发现胶质瘤内微出血及瘤体血供情况明显优于常规扫描序列,且对胶质母细胞瘤与低级别胶质瘤的诊断鉴别具有一定价值[25]。本研究中不同级别的脑胶质瘤ITSS分级差异有统计学意义,胶质瘤病理分级与ITSS分级二者呈正相关关系,相关系数为0.728。低级别胶质瘤内,通常无或少有ITSS;高级别瘤ITSS明显增多,且大部分伴不同程度聚集,静脉血管、出血灶融和,这是由于高级别瘤血管增长较为迅速,易出现微出血,同时临近层面的静脉增粗增大,这也印证了高级别胶质瘤高侵袭性、高代谢的特点。ITSS分级评估脑胶质瘤高级别ROC曲线下面积为0.894,敏感度、特异性、准确度分别为81.08%、85.19%、82.81%。此外本研究中低级别胶质瘤CBV图和对侧正常脑白质接近;高级别胶质瘤CBV图不均匀,瘤体呈红或红绿色,高于对侧脑白质,且随着肿瘤级别升高,rCBV值增加,二者呈正相关关系,相关系数为0.851,rCBV 值评估脑胶质瘤高级别ROC曲线下面积为0.937,敏感度、特异性、准确度分别为91.89%、88.89%、90.63%。
目前,临床上对于胶质瘤仍主要以手术治疗为主,并辅助以辅放化疗治疗等,胶质瘤手术操作复杂,为了保证在最小损伤下得到最佳疗效,这就要求术前明确肿瘤边界以及血运状态,以便术中能够在保护重要脑功能区的前提下,最大限度切除肿瘤。既往研究显示SWI可提供更细致的胶质瘤小静脉及出血方面的信息,以及提供更全面的肿瘤内部结构信息[26]。本研究中SWI可为肿瘤边界确定、肿瘤实质与水肿范围评估提供更多的信息。MRI常规序列对于已侵入邻近脑组织的血管显示较为困难,往往不能有效鉴别肿瘤周围水肿和未强化组织;而SWI图像中,脑脊液信号抑制,水肿较正常组织变现为高信号,低信号血液及其产物对比高信号瘤周水肿,可更好地区分肿瘤边界。
综上所述,SWI能够有效弥补常规MRI序列不足,有助于高级别胶质瘤与颅内淋巴瘤、单发脑转移瘤的鉴别,对于胶质瘤低级别与高级别的评估效能较高,可指导术中肿瘤边界的确定以及分辨肿瘤实质与水肿的范围。