乳腺乳头状癌病理亚型病例的临床及影像学特征
2022-11-29周成礼郭吉敏鄂占森
周成礼,郭吉敏,刘 阳,鄂占森
1汕头大学医学院,广东 汕头 515041;南方医科大学附属深圳市妇幼保健院2超声科,3放射科,广东 深圳 518028;4汕头大学医学院附属深圳市龙岗中心医院超声科,广东 深圳 518116
乳腺癌是女性最常见的恶性肿瘤,也成为女性主要的癌症死因[1]。乳腺乳头状癌是一种少见的乳腺癌类型,在乳头状肿瘤中占比不足2%[2],起源于导管-小叶系统[3],通常表现为乳房疼痛、乳头溢液和乳房肿块。据世界卫生组织2019年第5版乳腺肿瘤的最新分类,乳头状癌包括了伴导管原位癌的导管内乳头状瘤、乳头状导管原位癌(pDCIS)、包裹性乳头状癌(EPC)、实体性乳头状癌(SPC)、浸润性乳头状癌(IPC)5种亚型[4-5]。相对于常见的乳腺癌类型,乳头状癌亚型的临床治疗及预后存在差异。早期诊断和识别不同亚型的乳头状癌具有重要的临床意义。目前,国内外有关乳腺乳头状癌亚型的研究大多为某个单一类型,论述方向多集中在临床病理特征分析、分子表型分析及某单一类型的单一影像学诊断等方面,鲜有全面评估的报道。本课题拟研究乳腺乳头状癌亚型的超声(US)、乳房X线摄影(MG)和MRI影像学表现,对比分析乳腺乳头状癌病理亚型病例临床和影像特征差异及其临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选择2012年1月16日~2021年12月20日经病理确诊的1802例乳腺癌病例中的乳腺乳头状癌患者47例。纳入标准:病理诊断乳腺乳头状癌;具有乳腺US、MG或MRI检查;临床相关资料完整;入院前没有局部的手术和外伤史、未接受任何放化疗。排除标准:合并严重的乳腺炎;合并其他严重器质性疾病或恶性肿瘤。所有患者均完成了US检查,共计发现双侧乳腺病灶(变)89个(实性57个,囊性25个,混合性7个);45例完成了MG检查,其中3例显示正常,MG共计发现双侧乳腺病灶(变)50个(等密度22个,高密度14个,结构紊乱14个);14例完成了MRI检查,共计发现双侧乳腺病灶(变)28个(囊状1个,结节状10个,肿块12个,异常强化区5个)。根据空芯针活检或真空旋切术后病理结果对病灶进行定位,US确定乳头状癌病灶47个,MG确定乳头状癌病灶42个,MRI确定乳头状癌病灶16个。依据世界卫生组织2019年第5版最新的乳头状癌组织学分型[6],本研究没有收集到伴导管原位癌的导管内乳头状瘤这个亚型,故将47例患者(共49个乳头状癌病灶)分为4组:乳头状导管原位癌(pDCIS)组、包裹性乳头状癌(EPC)组、实性乳头状癌(SPC)组和浸润性乳头状癌(IPC)组,并记录患者相关临床资料。本回顾性研究获得本单位医学伦理委员会批准,免除受试者知情同意。
1.2 影像检查
1.2.1 US检查 采用PhilipsU22型和Siemens S2000型超声诊断仪,5~12 MHz的探头频率,选用乳腺检查条件。检查时患者仰卧,常规行乳腺横、纵、斜切面扫查,以乳头为中心,呈放射状沿各个象限有序扫查,重点对结节部位进行多切面扫查。根据BI-RADS乳腺超声评估标准记录肿块的形状、纵横比、边界、回声、钙化等。
1.2.2 MG检查 采用Giotto的FFDM摄像仪,型号为CR-190。患者取立位或坐位,适当调整位置,进行乳房轴位和斜侧位摄片。轴位检查时,嘱患者放松胸肌,下垂患侧手臂并外旋,以避免皮肤褶皱对结果的影响。斜侧位检查时,嘱患者将患侧手抱头,充分暴露腋窝投照区域,投照范围包括腋窝前部、乳腺及胸大肌等。使用压迫器摄片时,在患侧乳腺下半部放置压迫器,告知患者挺胸,使压迫器充分压到位,并标注乳腺的上下左右标识。在压迫过程中,应控制压迫力度以达到理想的拍摄效果为宜。
1.2.3 MRI检查 采用飞利浦Achiva1.5T双梯度MR扫描仪,搭配乳腺专用的相控阵表面线圈。患者取俯卧,双侧乳腺自然垂放于线圈洞穴内。扫描序列包括乳腺的T1WI(横断位及矢状位)、T2WI(横断位、矢状位及冠状位)、横断位动态增强T1WI 及扩散加权成像(DWI)。图像后处理由1 名经验丰富的技师独立完成。根据BI-RADS分类要求,进行多平面重组、测量表观扩散系数(ADC)、制作病灶动态增强曲线(TIC)等[7]。
1.2.4 影像数据定义及解读 肿块的形状分规则形(圆形、卵圆形或椭圆形)和不规则形(包含圆形、卵圆形、椭圆形有触角或星芒状);边缘清晰和边缘不清晰(包含部分清晰部分不清晰);后方回声改变(增强、衰减)和无改变;内部回声分为无回声(完全由液性成分构成,包含扩张的导管)、混合回声(指包含有部分液性成分的实体回声、囊实性回声)和低回声(包含均质、不均质回声);纵横比(与皮肤垂直长度除以与皮肤平行长度的比值);密度(表达的是影像的灰度)分低密度、等密度和高密度,依据影像灰度的分布状况分为均匀密度和不均匀密度;非肿块(指影像学上无形态学肿块,主要表现为乳腺结构紊乱:包含导管扩张、非对称性致密、结构扭曲、片状或团状不均密度影等);良性钙化:在MG上表现为粗大、圆形、点状、短棒状、光滑蛋壳状、光滑环状等;可疑钙化:在MG上表现为细小、线样、泥沙样或细分支钙化、不规整不均质钙化等。良性样分布:在MG上表现为散在、弥漫、区域分布等;非良性样分布:在MG上表现为簇状、线样、段样分布等。结构紊乱:非对称性致密、结构扭曲、片状或团状不均密度影等;T1WI突出组织T1弛豫(纵向弛豫)差别,T1越短,信号就越强;T1越长,信号就越低,长T1为黑色(低信号),短T1为白色(高信号);T2WI突出组织T2弛豫(横向弛豫)差别,T2越长,信号就越强;T2越短,信号就越弱,长T2为白色(高信号),短T2为黑色(低信号);DWI反映水分子的扩散情况,DWI高信号,ADC值降低,提示真正扩散受限,DWI 高信号,ADC 值不降低,提示并不是真正扩散受限;强化类型:在MRI上分为肿块均匀强化、肿块非均匀强化及非肿块样强化。
1.3 BI-RADS分类标准
根据BI-RADS分类标准[8],乳腺US、MG和MRI检查结论可分为0~6类,0类:临床表现,但评估不完全,需结合其他检查再评估;1类:影像学检查未见明显异常;2类:影像学检查显示良性征象,建议每年定期随访;3类:影像学检查提示良性病变可能,恶性可能低于2%,每3~6月随访1次;4类:影像学检查提示恶性可能,其中4A恶性可能性2%~10%,4B恶性可能性10%~50%,4C恶性可能性50%~95%;5类:影像学检查提示高度恶性,恶性可能性≥95%,有3项或以上征象提示恶性;6类:病理已证实为恶性病变,为实施外科切除、放化疗等治疗。本研究未发现6类的影像学诊断,故此类别不列入统计分类表中。根据BI-RADS分类≥4A被认为是阳性诊断,计算3种影像学诊断的误诊率。
1.4 图像分析
图像分析均由2名乳腺疾病诊断经验丰富的影像专业医师独立完成,意见不一致时商讨统一并形成最终诊断报告。评估及记录乳腺US、MG及MRI检查中病变的影像特征,并进行US、MG及MRI的BI-RADS分类。
1.5 统计学分析
采用SPSS21.0对数据进行统计学分析,计量资料以均数±标准差表示,计数资料以n(%)表示;采用Kolmogorov-Smirnov检验评价计量资料是否符合正态分布。比较不同分组间的临床特征、影像特征及BIRADS分类,计量资料采用单因素方差分析(正态分布)或Kruskal-Wails秩和检验(非正态分布或方差不齐),计数资料采用卡方检验;两样本比较的计量资料采用t检验或Wilcoxon秩和检验,计数资料采用卡方检验或精确概率法(n<40或理论频数T<1)。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺乳头状癌病理亚型患者的临床特征
47例乳腺乳头状癌病理亚型病例的临床病理特征:各组之间触到包块比见到乳头溢液的患者多,但两者差异无统计学意义(P>0.05)。亚组间在触诊包块的差异无统计学意义,pDCIS(9/16,56.3%)亚组乳头溢液占比最高,IPC 组触诊到包块的占比最高(9/11,81.8%)。亚组病例在患病年龄、临床症状和体征、病灶位置、病灶最大直径、乳房实质构成的差异均无统计学意义(P>0.05)。IPC亚组的肿块的平均直径最大,EPC、IPC 亚组发生淋巴结转移的几率相似(9%~10%),pDCIS亚组C类乳房占比最高(75%)(表1)。
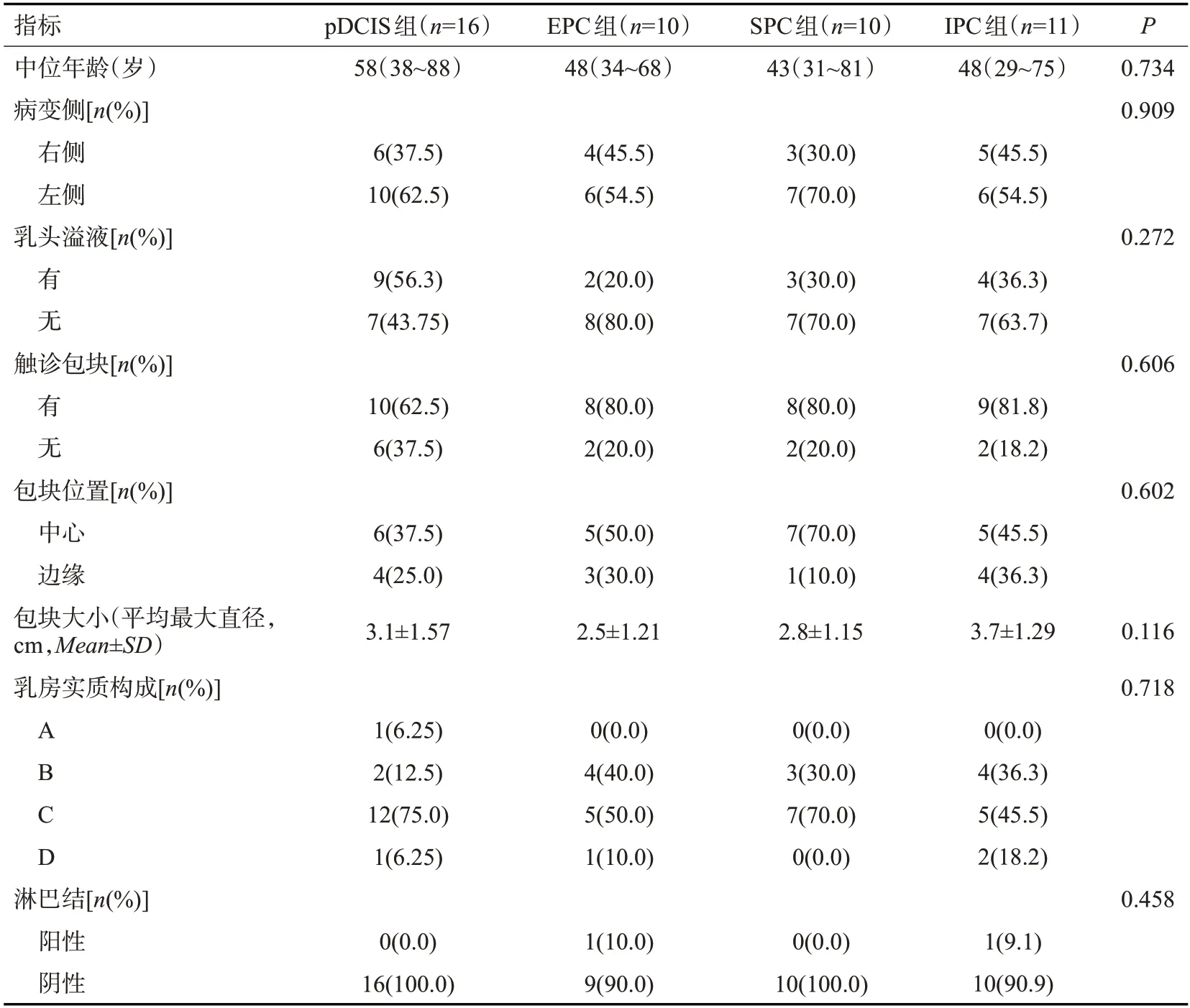
表1 乳腺乳头状癌病理亚型患者的一般临床特征Tab.1 General clinical characteristics of patients with pathological subtypes of breast papillary carcinoma
2.2 乳腺乳头状癌病理亚型患者的US特征
47例乳腺乳头状癌病理亚型US显示42例肿块,非肿块5例;其中23例肿块内有血流信号显示,亚组间差异无统计学意义(P>0.05)。SPC亚组肿块内检出无血流信号的占比最高(70%),IPC亚组肿块内检出有血流信号占比最高(63.6%),IPC亚组肿块内检出血流信号占比高于SPC亚组(P=0.023)。US显示肿块不规则形状特征在各亚组间的差异无统计学意义(P>0.05),IPC亚组肿块形态不规则的占比最高(72.7%),EPC亚组肿块形态规则的占比最高(70%)。IPC亚组肿块形态不规则占比高于EPC亚组(P=0.025,图1~2)。US显示肿块边界特征在各亚组间的差异无统计学意义(P>0.05),IPC组肿块边界不清的占比高于SPC亚组(P=0.025)。US显示肿块内部回声特征在各组之间的差异有统计学意义(P=0.041),与pDCIS组相比,EPC组的囊实性肿块占比更高(P=0.048)。亚组间测得肿块纵横比的差异无统计学意义,<1的肿块占多数,这与恶性特征不太相符。各组之间其他特征的差异无统计学意义(P>0.05,表2)。
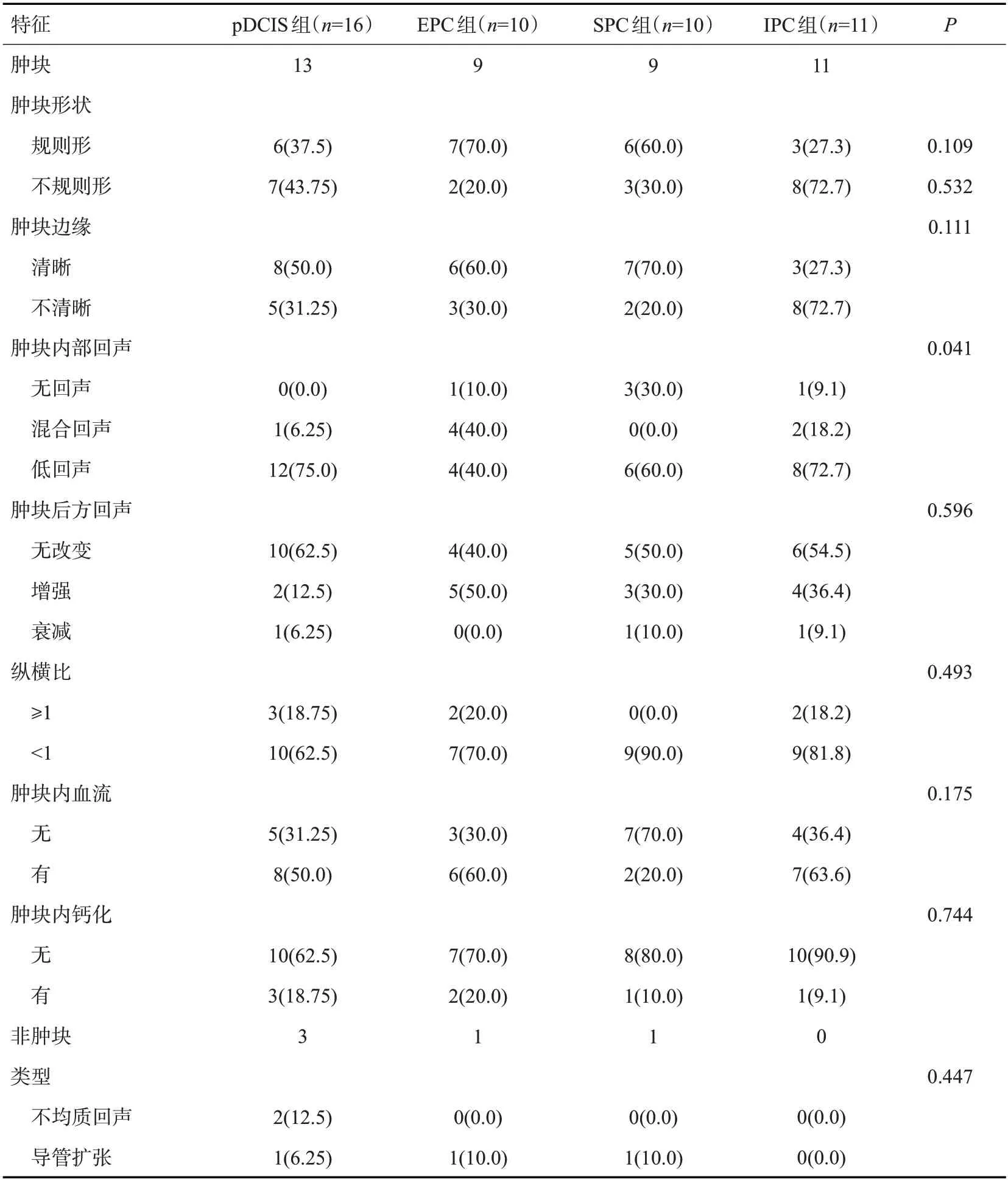
表2 乳腺乳头状癌病理亚型患者的US特征Tab.2 US characteristics of patients with pathological subtypes of breast papillary carcinoma[n(%)]
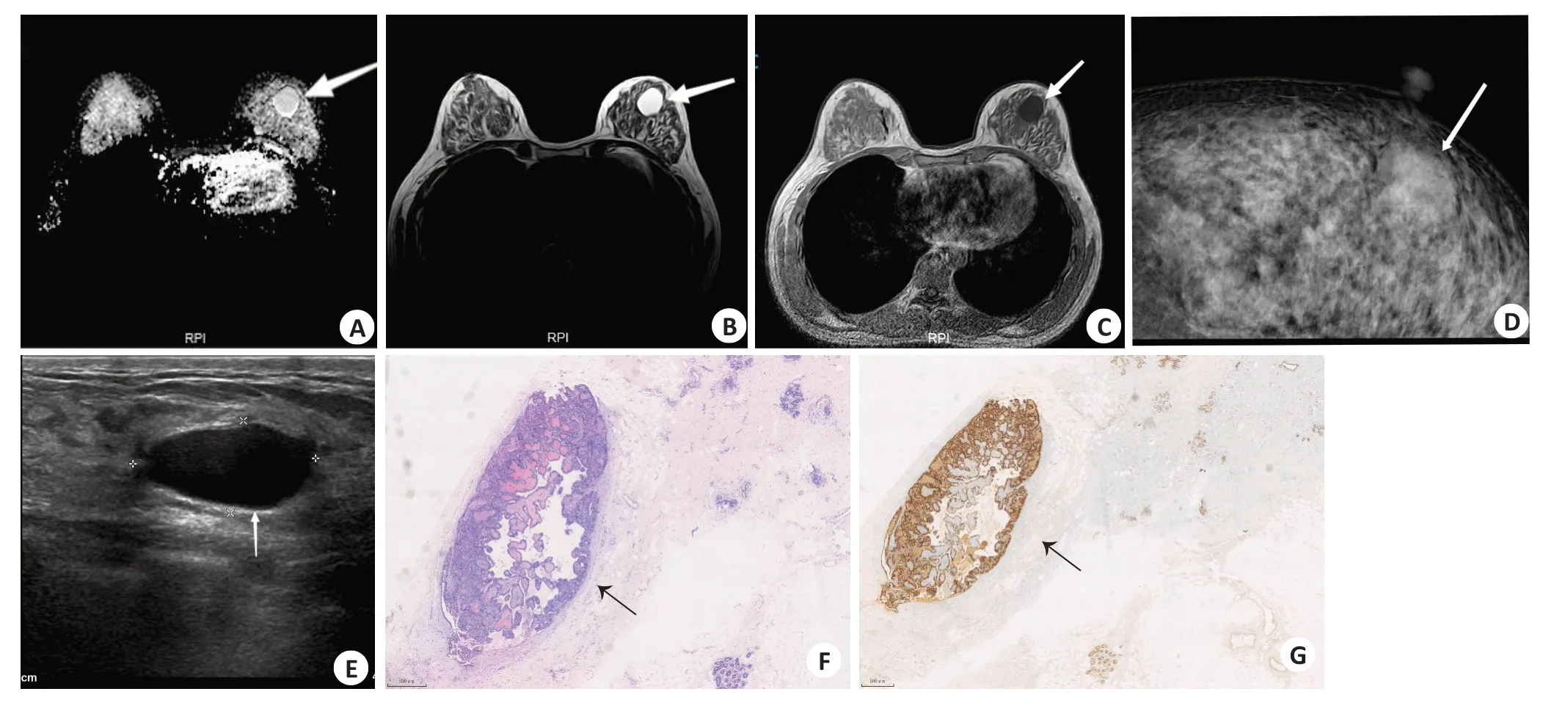
图1 某43岁女性SPC病例Fig.1 A43-year-old female patient with SPC.
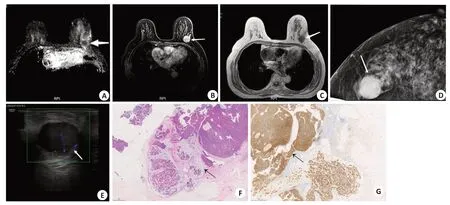
图2 某68岁女性EPC病例Fig.2 A68-year-old female patient with EPC.
2.3 乳腺乳头状癌病理亚型患者的MG特征
45例患者接受MG检查,发现肿块与非肿块分别为:pDCIS组6例和10例,EPC组6例和1例,SPC型6例和3例,IPC组8例和2例;3例MG检查正常。肿块与非肿块在亚组间的差异无统计学意义,IPC亚组MG检查为肿块的占比最高(8/11,72.7%),pDCIS亚组MG检查为非肿块的占比最高(10/16,62.5%)。亚组间肿块形状的差异无统计学意义(P>0.05),EPC亚组在MG检查中有62.5%(5/8)常显示为圆形或椭圆形,排除非肿块病例则占比更高(5/6,83.3%);而SPC组在MG检查中显示为不规则形肿块的占比40%(4/10),排除非肿块等病例占比亦更高(4/6,66.7%)。亚组间肿块边缘的差异有统计学意义(P=0.012),肿块边缘在MG检查中表现为边界不清或见星芒状特征方面,SPC亚组占比高于pDCIS亚组(P=0.015)。各亚组间肿块密度、肿块和非肿块钙化、钙化类型、钙化分布方面、非肿块特征等方面的差异无统计学意义(P>0.05)。IPC组出现钙化占比最高(63.6%,7/11),pDCIS 亚组出现钙化占非肿块类亚型最高(56.25%,9/16);钙化类型方面,4组亚型均以良性钙化为主(62.5%、62.5%、70.0%、45.5%),IPC组可疑钙化占比最高(36.4%);在钙化分布方面,pDCIS、SPC组以良性样分布为主(56.25%、60.0%),IPC组以非良性样分布为主(54.6%)。其他特征的差异无统计学意义(P>0.05,表3)。
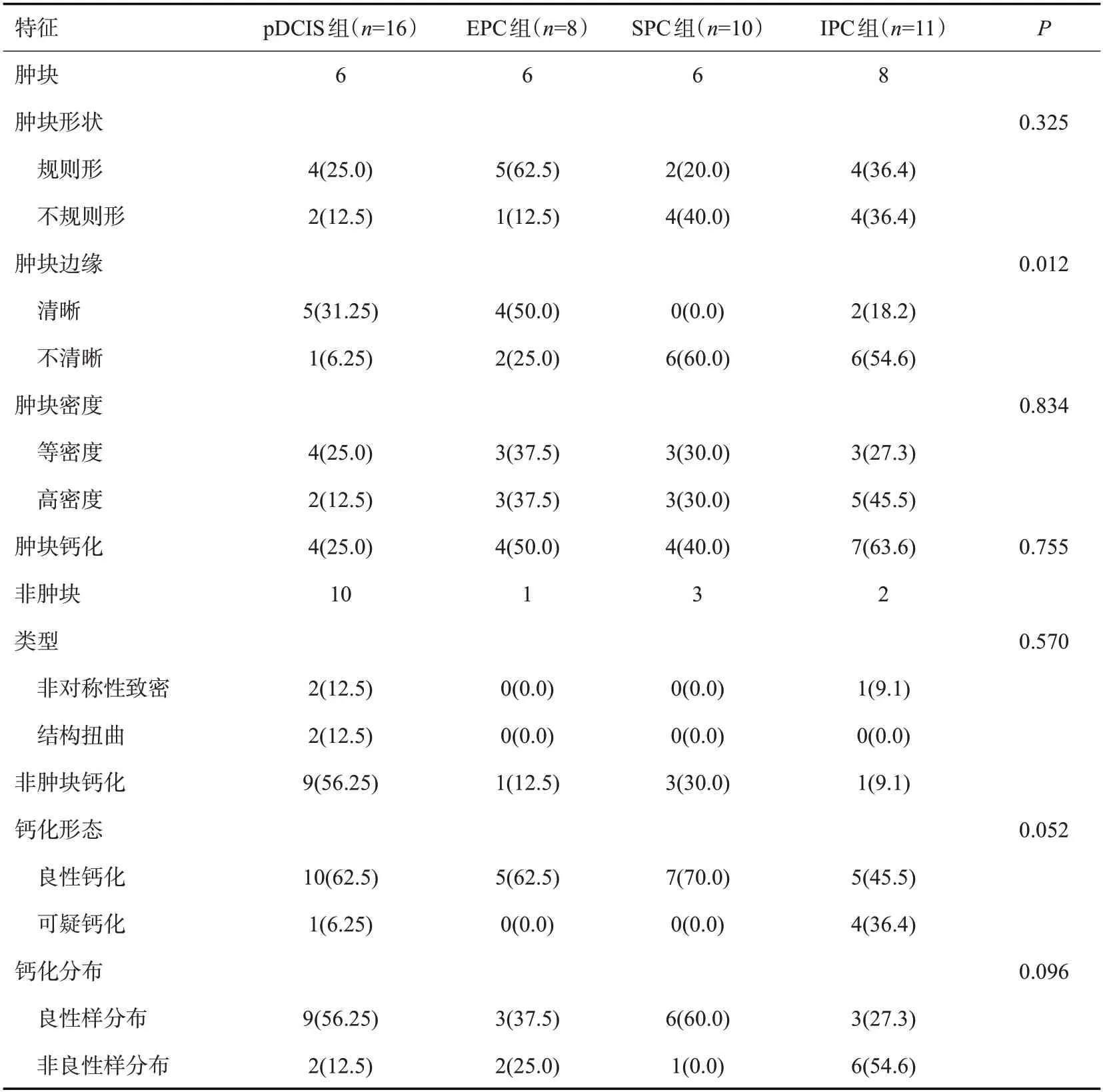
表3 乳腺乳头状癌病理亚型患者的MG特征Tab.3 MG characteristics of patients with pathological subtypes of breast papillary carcinoma[n(%)]
2.4 乳腺乳头状癌病理亚型患者的磁共振特征
14 例患者接受MRI 检查,包括肿块13 例,非肿块3 例,肿块和非肿块在各组间的差异无统计学意义(P=0.336)。亚组间MRI检查在肿块形态、肿块边缘、非肿块分布、T1WI、T2WI、DWI、强化类型、TIC曲线等方面的差异无统计学意义(P>0.05)。DWI在各组非肿块病灶内均显示为高信号,在肿块病灶内绝大多数显示轻度高信号。ADC值范围为0.12×10-3mm2/s~1.55×10-3mm2/s。各组间ADC水平的差异有统计学意义(P=0.003),SPC组低于其他亚组(P=0.005),EPC亚组低于pDCIS亚组(P=0.017,表4)。
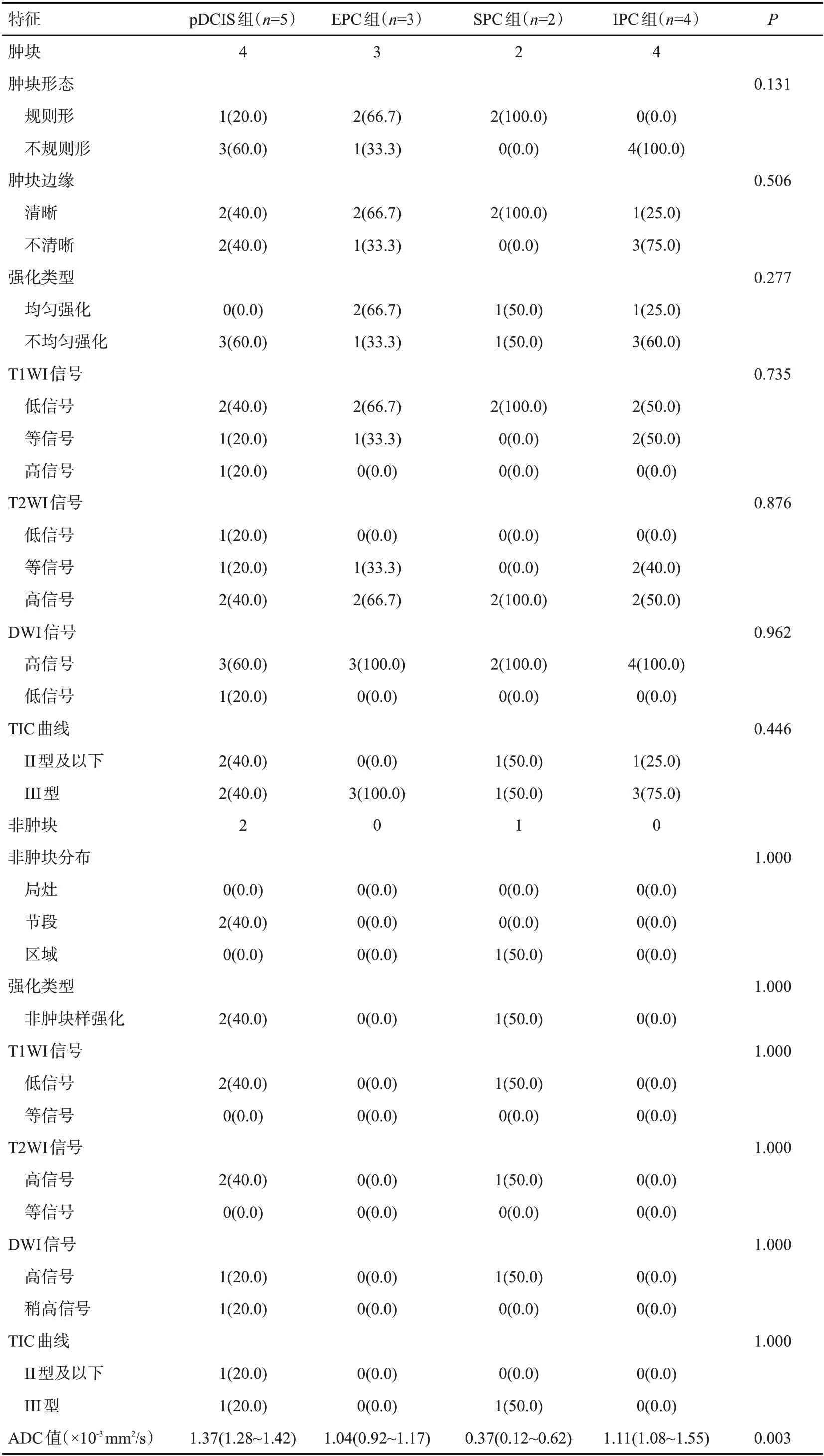
表4 乳腺乳头状癌病理亚型患者的MRI特征Tab.4 MRI characteristics of patients with pathological subtypes of breast papillary carcinoma[n(%)]
2.5 乳腺乳头状癌病理亚型患者的影像学BI-RADS分类及误诊率
不同影像学BI-RADS 分类在4 组亚型病例的差异均无统计学意义(P>0.05)。本研究以BI-RADS分类≥4A为阳性诊断,计算3种影像学诊断的误诊率。47例US BI-RADS分类≥4A的有25例,3类及以下的22例,误诊率46.8%(22/47);45例MG BI-RADS分类≥4A的有28例,3类及以下的17例,误诊率37.8%(17/45);14例MRI BI-RADS分类≥4A的有12例,3类及以下的2例,误诊率14.3%(2/14)。相比MRI来说,US的误诊率最高(P=0.029),MG次之(表5)。
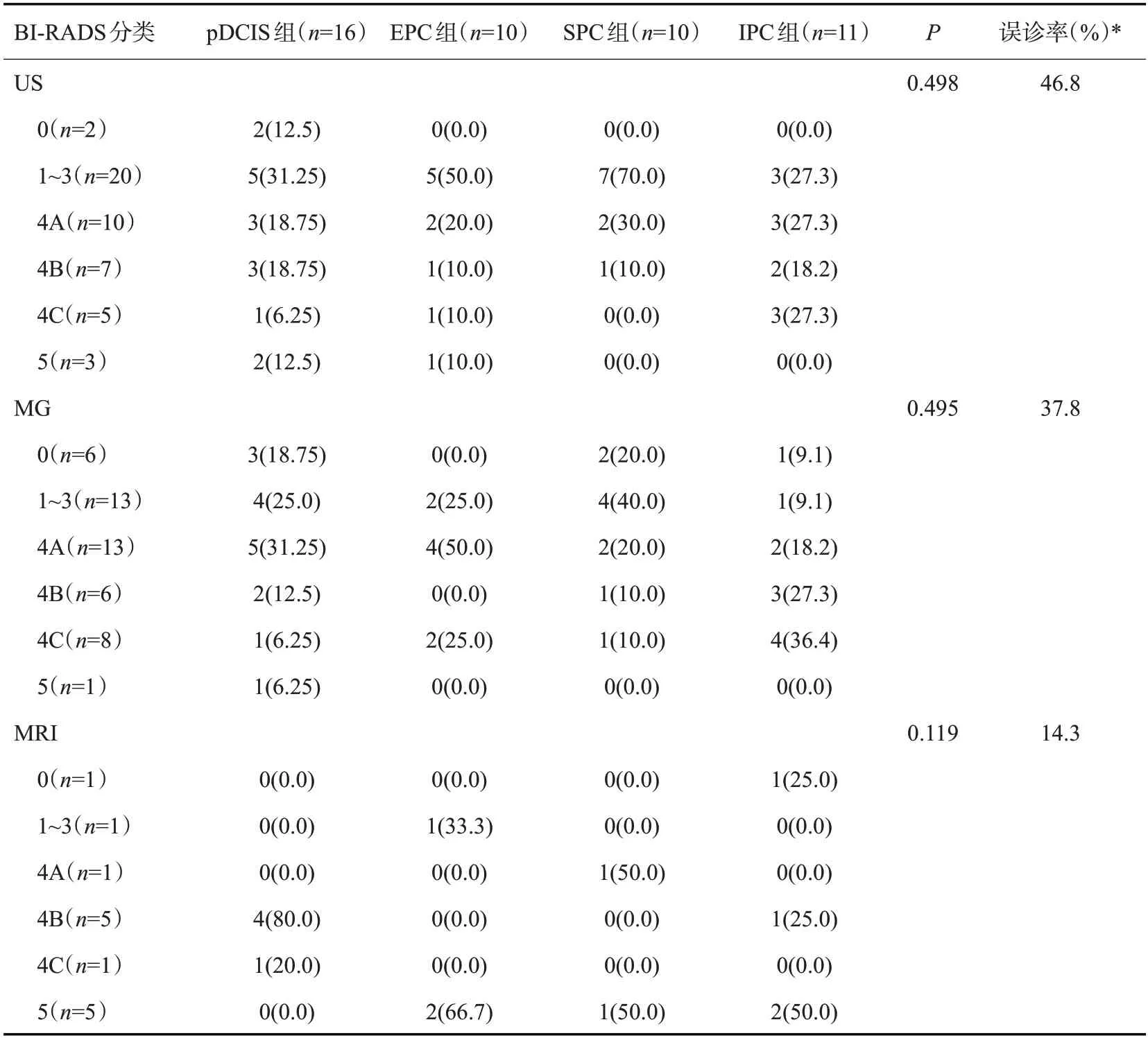
表5 BI-RADS分类在US、MG及MRI检查中的误诊率Tab.5 Misdiagnosis rate of BI-RADS classification in US,MG and MRI[n(%)]
3 讨论
本研究中,乳腺乳头状癌病理亚型的乳头溢液占比低于乳房肿块;乳头溢液的占比为10%~56%,较常见于pDCIS(56.3%)和EPC 组(40.0%)。有文献报道至少有1/3的EPC出现乳头血性分泌物[9],而乳房肿块的占比为62%~95%。IPC(81.8%)中观察到的肿块比例高于其他亚组。肿瘤的大小直接关系到女性就诊的迫切性,也关系到临床早期干预及预后,在我们的研究中,EPC组的平均直径最小,IPC组的平均直径最大。EPC被认为是乳腺导管内原位癌,但也有一些EPC 表现为侵袭性[10];IPC有1/3的病例可出现淋巴管侵犯,但预后也相对较好[11]。故需要早诊断早治疗,不要因为肿瘤的大小而区别对待。
本研究中,4组发病年龄的差异没有统计学意义。统计资料显示,发生在39岁以前的有16例,40~59岁的有28例,60岁以上的有23例,中年妇女是发病高峰年龄段;也有研究表明,SPC也可能出现在20多岁的患者中[12]。本研究中最年轻的28岁诊断为IPC,年龄最大的患者在88岁时诊断为pDCIS,由此可见,恶性肿瘤病理类型和级别与年龄没有相关性,患者有越来越年轻化的趋势。肿瘤大小虽然在一定条件上也可以反映出肿瘤的良恶性程度[13],但我们的研究组均为恶性肿瘤,没有发现组间差异。
乳腺乳头状癌亚型的影像学表现多样,在BI-RADS分类上可能会互相混淆。US诊断为4类的病例,在MG上仅表现为散在钙化而诊断为0或1~3类;X线摄影上表现为不定形或簇状钙化而诊断为4类的病例,在US上表现为光滑的良性肿块表现而判定为0或1~3类;磁共振BI-RADS分类与US和X线摄影存在重叠,但磁共振增强扫描发现病灶明显强化并伴周缘区域内片状结节状强化或周缘区域皮肤强化时,BI-RADS通常判定为5类。本研究中,BI-RADS分类在4组病例中的差异无统计学意义。我们根据BI-RADS分类≥4A为阳性计算3种影像学诊断的误诊率,乳腺乳头状癌US误诊率约46.8%,MG误诊率约37.8%,MRI误诊率约14.3%。相比MRI来说,US的误诊率最高,MG次之。
US影像学是乳腺癌常用的检查方法。US可以观察到乳腺乳头状病变的囊性或实性成分以及与周围扩张导管的关系,但对于外周细小导管US难以显示,因而发生于外周导管的乳头状肿瘤很难与其他乳腺浸润性肿瘤相鉴别。彩色多普勒超声可以显示乳头状肿瘤内血流信号、检测肿瘤内血流阻力指数,并对肿瘤性质及类型进行初阶段分析。在我们的研究中观察到47例亚型病例中有23例可显示血流,组间差异无统计学意义,IPC 亚组肿块内检出血流信号占比明显高于SPC 亚组。本研究发现,US显示肿块内部回声特征在组间的差异有统计学意义,与pDCIS亚组相比,EPC组的囊实性肿块占比更高。有学者研究认为,EPC以复杂囊性肿块伴囊壁内实性乳头状突起的特征居多[14-15]。我们的统计资料显示,EPC组有50%的病例出现了典型的复杂囊实性US表现,而乳腺叶状肿瘤、髓样癌、粘液癌等也可以有类似表现[16],因此在鉴别诊断中应引起重视。US显示肿块不规则形状及边界特征方面在各组之间比较无差异。IPC亚组肿块形态不规则占比高于EPC亚组,IPC组显示肿块边界不清的比例高于SPC组。SPC组多表现为圆形或不规则实性肿块,边缘有微分叶状或毛刺,此种特征往往被认为具有侵袭性成分,与IPC亚组的US表现有重叠。各组间US测得肿块的纵横比值差异无统计学意义,纵横比<1的肿块占大多数(82.1%,55/67),这与恶性特征不太相符,需要引起注意。
MG影像学是乳腺癌筛查的重要工具。本组研究中MG检出肿块26例(57.8%)、非肿块16例(35.6%)、正常3例(6.6%)。非肿块病例发病隐蔽,MG极易漏诊,BI-RADS常诊断为0~3类。本研究中MG检出肿块比例最高的是IPC(72.7%)组,而pDCIS组占非肿块的比例最高(62.5%),这与既往研究[17]的IPC占比最高不太一致,分析原因可能是与pDCIS的C型乳房占比较高有关。本研究发现,EPC、SPC及pDCIS亚组在MG检查中显示圆形或椭圆形肿块为主;而IPC组在MG检查中则显示以不规则形肿块为主。MG在显示肿块边缘模糊或见星芒状特征方面,SPC亚组占比远高于pDCIS组。本研究显示,各组间钙化方面的比较,IPC组出现钙化占比最高(63.6%,7/11),pDCIS亚组出现钙化占非肿块类亚型最高(56.25%,9/16);钙化类型方面,4组亚型均以良性钙化类为主,但IPC组占可疑钙化类最高;在钙化分布方面,pDCIS、SPC组以良性样分布为主,IPC组则以非良性样分布为主。
MRI是乳腺癌重要的诊断技术,具有US和MG难以媲美的优势,特别是动态增强磁共振成像,能发现病灶局部扩散及伴发的同时性肿瘤,本研究与既往研究[18]的结果相似。我们发现14例中有16个异常MRI增强病灶,其中2 个病灶被US 和MG漏诊,分别是1 例SPC合并IDC,1例pDCIS合并IDC。MRI动态增强扫描在各组中具有不同的成像特征,EPC、IPC亚组只显示为肿块增强,而其他组则均显示为肿块和非肿块样增强;EPC组的肿块显示均匀强化为主,而其他组的肿块则显示不均匀强化为主。除pDCIS外,DWI在其他组的肿块病灶内均显示增高信号。各亚组间ADC的比较发现,SPC亚组ADC值低于其他亚组,EPC亚组ADC值低于pDCIS亚组,差异有统计学意义。既往研究认为SPC 表现出最低的恶性病理ADC 值,范围为(0.56~1.24)×10-3mm2/s[19],也有学者测得EPC的ADC平均值为(876.3±128.5)×10-6mm2/s[20],这些与我们的研究结果一致。在动力学曲线分类中,IPC、EPC、SPC及pDCIS组表现为流出型的比例分别为75%、66.7%、50.0%及40.0%,分析其原因可能与不同亚型病理级别相关。
本研究表明,US、MG及MRI影像学特征很难区分乳腺乳头状癌亚型病例。当肿块与导管结构的形态关系密切,或表现为复杂的囊性和囊实性结构时应考虑乳头状病变的可能性。US和MRI在显示肿块的具体形态结构方面比MG更有效,对大多数囊性或囊实性病灶,MG只能显示钙化,US、MRI均能够显示囊性或囊实性病灶边界,US可能因侧边声影伪像影响而无法确定,而MRI可确定EPC具有典型囊内实性肿块的形态学特征[21-22]。
由于我们的研究为回顾性设计,病例数量有限,影像学难以完全反映这种少见肿瘤的异质特征,在没有进行组内及组间对照研究的情况下,其可靠性还需加大数据量进一步论证。
综上所述,乳腺乳头状癌是很少见的乳腺癌类型之一,在影像学表现上相互重叠,在观察肿瘤形态学特征时,US 和MRI 可以相互补充,但US 的误诊率高于MRI。MG对肿瘤钙化类型和分布更敏感,MRI在发现肿瘤扩散及伴发的同时性肿瘤方面更有效。US显示的肿块内血流信号、US和MG显示的肿块边缘及形态、MRI表观扩散系数等影像特征在乳腺乳头状癌病理亚型病例中存在差异,这种差异可为影像医生诊断、临床医生治疗提供参考。