急性脑桥梗死与基底动脉特征参数的相关性
2022-11-29孙雨雨于泽霏赵艺涵
宋 新,孙雨雨,于泽霏,赵艺涵,胡 涛,包 权
1牡丹江医学院影像学院,黑龙江 牡丹江 157011;2牡丹江医学院附属红旗医院磁共振科,黑龙江 牡丹江 157011
颅内动脉粥样硬化好发于亚洲人群,发病率高,多累及大脑中动脉及基底动脉,疾病的发展容易导致缺血性脑卒中的发生,继而引起严重后果[1]。有研究表明累及基底动脉(BA)缺血性卒中死亡率高于大脑中动脉,这可能与BA解剖结构及血流动力学相关[2]。为减少颅内动脉粥样硬化造成的严重后果,早期及时评估管腔狭窄程度、斑块特征等危险因素至关重要。目前,高分辨血管壁磁共振成像(HR VW-MRI)技术发展迅速,HR VW-MRI通过抑制流动的血液信号而清楚显示静态的管壁结构,拥有较高的软组织对比度和良好的信噪比,是直接显示血管疾病特征的最佳方法,对于斑块的分析和血管疾病的诊断具有很大优势[3]。既往有研究表明应用HR VW-MRI可更加明确阐述大脑中动脉斑块特征与急性脑梗死之间相关性,而BA相关报道较少,同时联合BA迂曲度及斑块特征指标分析与后循环梗死相关性研究未进行深一步探讨[4-5]。本研究联合应用HR VW-MRI、弥散加权成像(DWI)及三维时间飞跃法磁共振血管成像(3D-TOF-MRA)进行急性脑桥梗死与BA迂曲度及动脉粥样硬化斑块特征的相关性分析。
1 资料与方法
1.1 一般资料
选取2021年5月~2021年12月牡丹江医学院附属红旗医院神经内科收治的急性或非急性脑桥梗死患者。纳入标准:急性脑桥梗死患者经临床及影像检查定义为急性脑桥梗死,非急性脑桥梗死患者经临床及影像检查定义为脑桥区域未发生缺血性卒中;所有患者在2周内均行DWI、3D-TOF-MRA、HR VW-MRI检查,BA存在粥样硬化斑块;研究所涉及临床资料完整。排除标准:非动脉粥样硬化患者;心源性栓塞患者;BA血管畸形;BA或双侧椎动脉显示不清;HR VW-MRI检查前有急性期溶栓、血管内介入治疗;合并MRI检查禁忌证;无法配合检查或者图像不清晰。最终纳入35例(46.7%)急性脑桥梗死患者(图1A~B)和40例(53.3%)非急性脑桥梗死患者,共75例,其中男性43例。女性32例,年龄42~85(65.81±9.621)岁。两组一般资料差异无统计学意义(P>0.05,表1),具有可比性。本研究通过牡丹江医学院附属红旗医院伦理委员会审批,所有患者检查前均签署MR检查知情同意书。

表1 两组患者一般资料Tab.1 Baseline data of patients in the two groups
1.2 研究方法
1.2.1 影像学检查 采用飞利浦Achieva 3.0T TX MRI扫描仪,使用8通道头颅专用线圈,仰卧位,头先进,定位于眉弓。均行DWI、3D-TOF-MRA、HR VW-MRI检查。DWI检查扫描范围为颅底到颅顶之间,矢状定位像平行于胼胝体下缘。MRA检查扫描范围为扣带回至枕骨大孔水平之间,矢状定位像平行于胼胝体前缘。HR VW-MRI技术采用T1-VISTA序列,扫描范围为脑干区域,矢状定位像垂直于脑干进行定位。扫描序列参数如下:(1)DWI 序列:重复时间2303 ms,回波时间88 ms,视野230 mm×230 mm×125 mm,体素15 mm×189 mm×6 mm,矩阵152×122×18,NSA=1,扫描时间28 s;(2)MRA序列:重复时间25 ms,回波时间3.5 ms,视野203 mm×203 mm×76 mm,体素0.66 mm×1.16 mm×1 mm,矩阵308×176×153,NSA=1,扫描时间2 min 57 s;(3)T1-VISTA序列:重复时间800 ms,回波时间18 ms,视野200 mm×181 mm×33 mm,体素0.6 mm×0.6 mm×0.6 mm,矩阵332×300×110,NSA=1,扫描时间5 min 9 s。
1.2.2 图像分析 将获取图像传输到飞利浦工作站,由2位资历10年以上影像诊断医师采用双盲法预处理及诊断图像(图1)。DWI像脑桥区域表现高信号,ADC图表现低信号,定义为急性脑桥梗死,反之DWI及ADC图脑桥区域无异常信号改变定义为非急性脑桥梗死。MRA图像及T1VISTA图像上手动绘图测量指标。
1.2.3 测量指标 BA迂曲度:MRA图像正侧位上,取BA两端分别沿管壁迂曲做两条假象延长线,取两条线交点的角度测量其迂曲度。
斑块负荷:手动勾画出血管壁外径及内径的周长,梗死组选择梗死灶邻近层面最狭窄处的责任斑块测量其管周及管腔面积,非梗死组选取最狭窄处测量管周及管腔面积。参考处管周及管腔面积为血管远端和近端的平均值。狭窄处壁面积=狭窄处管周面积-狭窄处管腔面积。斑块负荷=(狭窄处管周面积-狭窄处管腔面积)/狭窄处管周面积。
动脉重构:重构率=狭窄处管周面积/参考处管周面积。重构率≥1.05,为正性重构;0.95<重构率<1.05,为中性重构;重构率≤0.95,为负性重构。
1.3 统计学分析
采用SPSS26.0软件进行统计分析,计量资料以均数±标准差或M(Q1,Q3)表示;组间比较采用t检验或秩和检验。计数资料以n(%)表示,组间比较采用卡方检验,P<0.05时表示差异有统计学意义,采用多因素二元Logistic回归分析急性脑桥梗死的危险因素。
2 结果
2.1 两组患者影像特征比较
两组患者BA正侧位迂曲度(图1C~D)比较,差异无统计学意义(t=1.668,P=0.1;t=1.546,P=0.127,表2)。
两组狭窄处血管、管腔、壁面积(图1E)差异无统计学意义(t=1.095,P=0.277;t=-0.737,P=0.464;t=1.621,P=0.109),参考处血管、管腔面积(图1F、G)差异无统计学意义(t=-0.578,P=0.565;t=-1.259,P=0.208),急性脑桥梗死组斑块负荷高于无急性脑桥梗死组,差异有统计学意义(t=2.170,P=0.033),急性脑桥梗死组中,20例正性重构,7例中性重构,8例负性重构,重构率为1.09%±0.21%;无急性脑桥梗死组中,10例正性重构,10例中性重构,20例负性重构,重构率为0.96%±0.16%,差异有统计学意义(χ2=8.711,P=0.013;t=2.937,P=0.004,表2、图2)。

图1 男,54岁,发现言语不清伴右侧肢体无力6 h来我院就诊Fig.1 A54-year-old male patient came to our hospital for treatment with slurred speech accompanied by right limb weakness for 6 h.

图2 急性脑桥梗死组和非急性脑桥梗死组动脉重构分布情况Fig.2 Distribution of arterial remodeling in the acute and non-acute pons infarction groups.
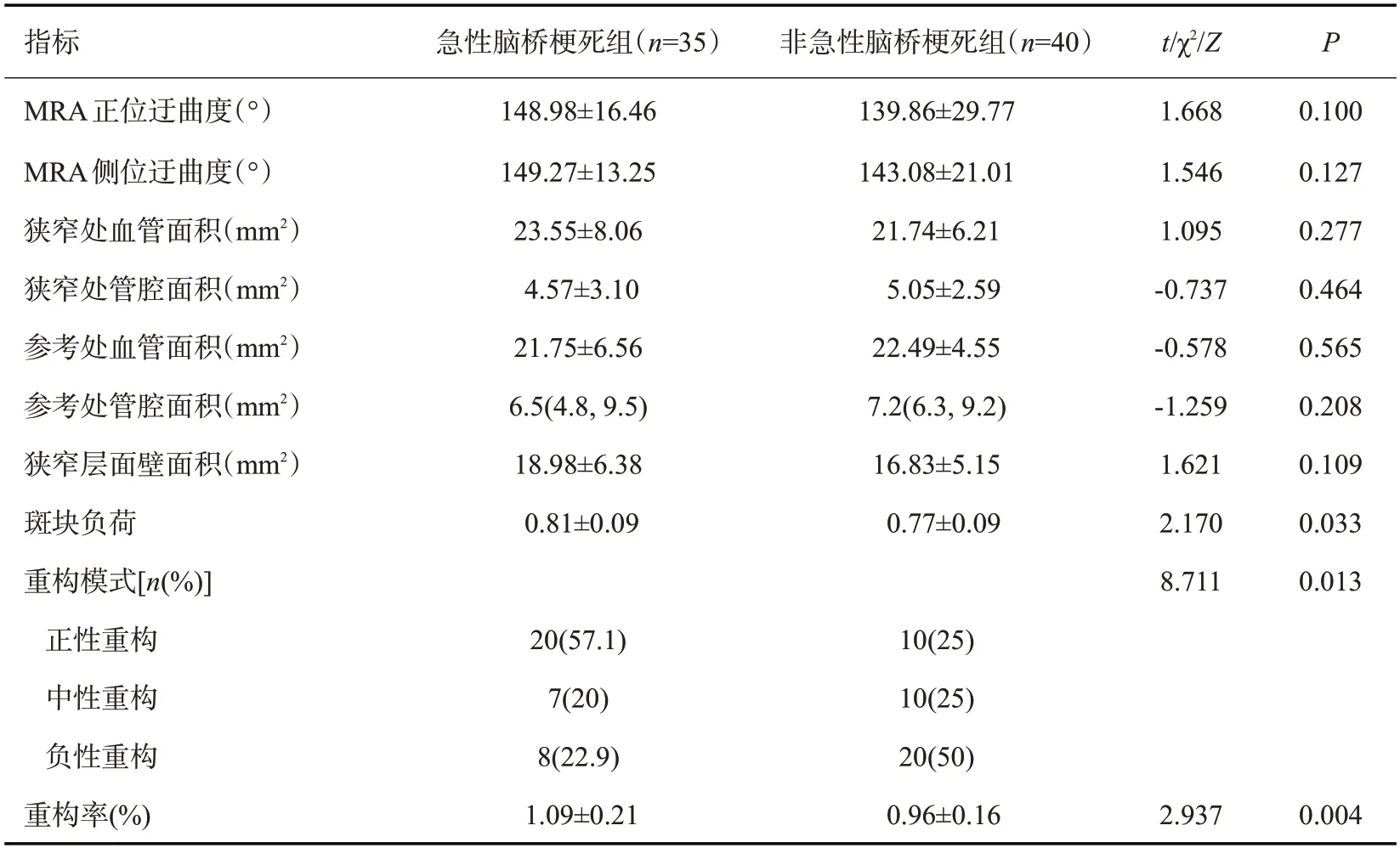
表2 两组患者BA角度及斑块特征比较Tab.2 Comparison of BAangle and plaque characteristics between the two groups(Mean±SD)
2.2 急性脑桥梗死的危险因素分析
斑块负荷和重构方式均可影响急性脑桥梗死事件的发生,斑块负荷OR=0.001,95%CI=0.000~0.306,P=0.019。重构模式OR=2.514,95%CI=1.380~4.580,P=0.003。斑块负荷为急性脑桥梗死事件发生的独立保护因素。正性重构为急性脑桥梗死事件发生的独立危险因素(表3)。

表3 急性脑桥梗死的独立因素分析Tab.3 Independent risk factors of acute pontine infarction
3 讨论
BA在脑桥腹侧基底沟延续走行,是后循环主要供血血管。后循环缺血性卒中发作时常累及BA,致死率高,严重威胁患者的生命安全。本研究应用多模态MRI技术对急性脑桥梗死患者和无急性脑桥梗死患者的BA迂曲度及斑块特征进行分析,发现急性脑桥梗死患者的BA斑块负荷更大,正性重构发生率更高。同时,斑块负荷是急性脑桥梗死事件发生的独立保护因素,正性重构为急性脑桥梗死事件发生的独立危险因素,表明HR VW-MRI检查在评估易损斑块方面诊断价值很高,提示斑块负荷、正性重构对于缺血性脑卒中的预测、诊断及治疗具有一定意义。
研究发现患者发病年龄、性别、糖尿病史、吸烟史、饮酒史、高血压、高脂血症、高血糖及高同型半胱氨酸与急性脑桥梗死无相关性。既往研究发现后循环动脉粥样硬化症患者高血压及糖尿病更多见[6],本研究与其不相符,这可能与选取人群相关,实验组选取脑桥梗死患者,对照组选取前循环梗死和无梗死人群,其中脑桥梗死患者与后循环梗死患者危险因素不一致。因此,脑桥梗死患者与前循环梗死或无梗死人群的高血压及糖尿病史无显著差异。
BA由左右两条椎动脉汇合而成,超过50%的人左右椎动脉直径不等[7]。因此BA走行受椎-基底动脉先天解剖形态及位置影响,左右直径不等的椎动脉汇入BA的不对称性血流致使BA迂曲。有学者发现双侧椎动脉走行及直径差异大、BA迂曲度大,有利于BA斑块形成,形成的斑块好发于迂曲BA的内壁[8]。因为椎基底动脉几何形状影响管腔内血流动力学及壁剪切应力分布,BA曲度内壁所受到血流冲击力小,血流与管壁摩擦产生的壁面剪切应力低,低剪切应力区域容易引起动脉粥样硬化颗粒的沉积形成斑块。由此可见,BA迂曲容易引起动脉粥样硬化斑块的形成,并且斑块好发于BA曲度的内壁。本研究发现BA迂曲与急性脑桥梗死无相关性(P>0.05),提示BA迂曲度增大不会导致急性脑桥梗死的发生。一项回顾性研究分析了颅内动脉粥样硬化性疾病患者的MRA和HR VW-MRI图像,发现BA的曲度与斑块负荷没有相关性,表明血管曲度与血小板形成相关,而与斑块发展无关[9]。斑块发展与缺血性卒中事件密切相关。所以,BA血管曲度增大可促进BA斑块形成,但是不会导致斑块的不稳定性继而引发急性脑桥梗死。
斑块负荷常作为评估斑块稳定性的指标之一,多用管腔面积、管壁面积及厚度表示。有学者回顾性分析后循环急性脑梗死或短暂性缺血发作患者的MRI图像,发现相比较非梗死患者,梗死患者的斑块负荷更大[10]。有研究发现,与非责任斑块比较,责任斑块拥有更大的体积,更高的管腔狭窄率,更大的斑块负荷[11]。本研究发现急性脑桥梗死与斑块负荷成正相关,急性脑桥梗死组斑块负荷更大(P<0.05),经多因素分析发现斑块负荷为影响急性脑桥梗死的独立保护因素(OR=0.001,95%CI:0.000~0.306,P=0.019)。提示随着斑块负荷的降低,急性脑桥梗死发病率逐渐下降。这可能与血管病变进展机制相关,血管病变早期可发生代偿性血管扩张以维持管腔的大小,随着病变进展,血管代偿能力减弱,斑块体积及斑块负荷增大,管腔狭窄率增高,影响局部脑组织供氧、供血,造成神经功能性改变[12-13]。有学者对有症状和无症状患者大脑中动脉血管壁图像分析,发现有症状患者的斑块负荷更大[4]。并且其研究结果的潜在发生机制可能与以下事实有关:随着斑块负荷的增加,斑块张力相应增加,导致管腔狭窄率增高,血流动力学灌注不足而引起灌注时间延长。此时,由于管腔中的血压升高以及斑块表面的低剪切应力,斑块容易发生破裂或脱落[14]。有学者发现斑块负荷是脑卒中复发的独立因素,斑块负荷每增加10%,卒中复发风险就会增加2.26倍[15]。所以在颅内血管动脉粥样硬化性改变中,斑块负荷增加容易诱发不良事件。因此,临床可以尝试通过控制、降低BA斑块负荷来达到稳定患者病情、减少急性脑桥梗死发生的目的。
动脉重构可以由动脉粥样硬化性斑块引起而形成多种重构模式,是血管壁发生的一种代偿现象[16]。有研究发现相比较前循环动脉,后循环动脉更容易发生正性重构[17]。这可能受血流动力学影响,研究发现后循环血流量明显低于前循环,管壁受到血流冲击时产生的壁剪切应力低,易引起动脉粥样硬化颗粒的沉积[18]。动脉重构也可能与交感神经分布相关,后循环交感神经分布相对稀疏,大脑自动调节受交感神经支配影响,自动调节功能受损而代偿性引起管壁向外扩张[19-20]。有研究发现正性重构组急性脑梗死患者数量更多[21];也有研究发现DWI阳性组的正性重构比DWI阴性组更常见[22]。本研究中,急性脑桥梗死组容易发生正性重构(χ2=8.711,P=0.013),经多因素分析发现正性重构是急性脑桥梗死的独立危险因素(OR=2.514,P=0.003,95%CI=1.380~4.580),与既往研究结果一致,表明正性重构容易导致急性脑桥梗死的发生。这与正性重构组斑块面积较大、壁面剪切力较高相关。高壁面剪切力可能通过削弱内皮细胞功能、降低斑块稳定性、增加斑块面积而诱发缺血性卒中[21]。
本研究局限性体现在:样本量少;对于发病机制、病理过程尚不清楚;无法获取颅内BA病理结果。
综上所述,本研究应用多序列探讨急性脑桥梗死和基底动脉曲度及斑块特征参数的相关性,发现斑块负荷是急性脑桥梗死独立保护因素,正性重构为急性脑桥梗死的独立危险因素。提示临床可以通过降低BA斑块负荷减少急性脑桥梗死的发病率。早期通过对血管重构模式的判断预测疾病走向,提早采取临床治疗。从形态学角度出发,针对斑块特征预测、降低缺血性卒中的发生,为进一步探讨管腔内血流参数的变化对脑血管疾病的影响和易损斑块特征的发病机制做铺垫,更好应用于临床。