生物反应器培养BHK-21悬浮细胞增殖伪狂犬病病毒工艺优化
2022-11-29王家敏李自良马芳芳康碧静马忠仁乔自林
王家敏,李自良,马芳芳,康碧静,田 玲,李 倬,马忠仁,乔自林
(1.西北民族大学 生物医学研究中心 甘肃省动物细胞技术创新中心,兰州 730030;2.四川大学 生物治疗国家重点实验室,成都 610041;3.西北民族大学 生命科学与工程学院,兰州 730030)
伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(pseudorabies virus,PRV)引起的急性传染病,最早发生于美国,1902年,由匈牙利学者Aujeszky成功分离到伪狂犬病病毒,在欧洲、美洲、非洲及亚洲都有发病报道[1-2]。近年来,PR在我国持续流行,给畜牧业发展造成了严重的经济损失。2017年,我国发现了PRV变异毒株感染人的确诊病例,基因测序显示与近年流行的变异毒株高度同源,具有较高的人畜共患、跨物种传播风险。研发生产周期短、过程控制能力强的PR疫苗生产工艺势在必行[1-5]。目前国内主要以原代鸡胚细胞、传代ST和BHK-21细胞培养工艺生产PR疫苗,但由于该工艺需要消耗大量的动物血清、细胞培养容器以及劳动力,特别是当进行大规模生产时具有局限性[6]。开发无血清悬浮培养工艺优势突出,BHK-21悬浮细胞可在无血清培养基中培养、生长速率快、PRV敏感,是目前研发PR疫苗的优选细胞株。悬浮细胞更容易利用生物反应器实现线性放大培养,且无血清培养基的使用使疫苗产品具有更好的稳定性和安全性,完全摆脱对血清的依赖,降低生产成本[7-9]。因此,研发BHK-21悬浮细胞无血清培养生产PR疫苗工艺具有一定的现实意义。
1 材料与方法
1.1 细胞与病毒
BHK-21贴壁细胞:由甘肃省动物细胞技术创新中心先后从ATCC、生产企业引进3株BHK-21贴壁细胞,本研究中分别标记为BHK-21-01、BHK-21-02、BHK-21-03细胞;用含10%FBS的MEM培养基培养。
BHK-21悬浮细胞:由本课题组自主驯化、冻存3株全悬浮细胞,分别命名为BHK-21-XF01、BHK-21-XF02、BHK-21-XF03细胞;可用SFM-BHK无血清培养基或含3%NBS的SLM-BHK低血清培养基培养。
疫苗生产用伪狂犬病病毒:弱毒Bartha-K61株,为gE和gI基因缺失株,购自山东华宏生物工程有限公司。
1.2 主要试剂与设备
MEM培养基、SLM-BHK低血清培养基、SFM-BHK无血清培养基和PBS购自兰州百灵生物技术有限公司。新生牛血清购自兰州民海生物工程有限公司。0.25%胰蛋白酶购自Gibco。0.2%台盼蓝购自Sigma。二甲基亚砜购自Thermo Scientific。
CKX-41型生微倒置显微镜购自Olympus。3111型CO2培养箱购自ThermoFisher。IC1000细胞计数仪购自Countstar。ZCZY-AS8型震荡培养箱购自上海知楚仪器有限公司。DASGIP四联平行生物反应器、BioFlo 320型生物反应器购自Eppendorf。
1.3 BHK-21细胞对PRV敏感性研究
在T25细胞培养瓶中,以1∶4比例传代BHK-21-01、BHK-21-02、BHK-21-03贴壁细胞,待细胞生长至80%~90%单层时,按病毒感染复数(MOI) 0.01接种PRV,每株细胞平行3组,另设1组空白对照,置于37 ℃、5% CO2静置培养。
在125 mL摇瓶中,以5.0×105cells·mL-1初始密度接种BHK-21-XF01、BHK-21-XF02、BHK-21-XF03悬浮细胞,待细胞密度达到6.0×106cells·mL-1以上时,稀释至3.0×106cells ·mL-1,按照MOI=0.01接种PRV,每株细胞平行3组,另设1组空白对照,置于37 ℃、5% CO2、120 r·min-1悬浮培养。
BHK-21贴壁和悬浮细胞接种PRV后,在24、48、72 h取样测定细胞活率和半数细胞感染量(TCID50),观察细胞形态和病变程度[10]。
1.4 BHK-21-XF02悬浮细胞生长特性分析
BHK-21-XF02细胞在含3% NBS的SLM-BHK低血清培养基和SFM-BHK无血清中连续培养3代后,分别以不同初始密度接种至摇瓶,置于37 ℃、5% CO2、120 r·min-1悬浮培养,每个接种密度平行3组,每12 h取样计数,绘制细胞生长曲线。比较不同初始接种密度培养BHK-21-XF02细胞的最大增殖密度、倍增时间和比生长速率。两种培养基中,待细胞密度达到6.0×106cells·mL-1以上时,稀释至3.0×106cells·mL-1,然后分别按MOI=0.01接种PRV,平行3组,置于37 ℃、5% CO2、120 r·min-1培养。病毒接种24、48、72 h取样测定TCID50[11-13]。
倍增时间=T/A,A=log2(Y/X)
(1)
式(1)中:X为初始接种细胞数,Y为细胞最大增殖密度前一天的细胞数,T为培养时间。
比生长速率=(lnXn/Xn-1)/(tn-tn-1)
(2)
式(2)中:X为活细胞密度,t为培养时间,n和n-1为2个取样计数时间点。
1.5 生物反应器BHK-21-XF02悬浮细胞培养条件优化
在1.2 L DASGIP四联平行生物反应器中,利用响应面法探究无血清培养基中细胞初始接种密度、搅拌转速和溶氧三个自变量对BHK-21-XF02细胞增殖密度的影响。Box-Behnken中心组合设计每个变量分为三个水平(-1为最小值,1为最大值,0为中心点),三因素三水平试验设计见表1。根据1.2 L生物反应器优化得到的最优培养参数,将BHK-21-XF02细胞接种于5 L生物反应器,进行批培养验证,每12 h取样测定细胞密度和活率,连续培养72 h,绘制细胞生长曲线[14-15]。
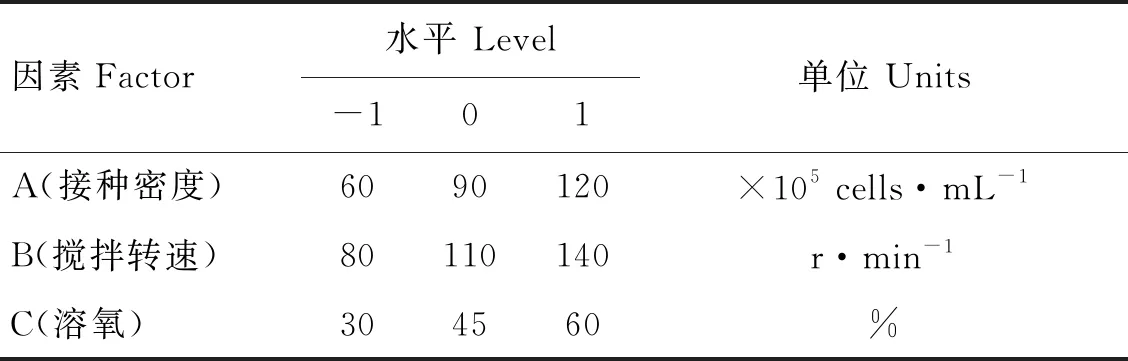
表1 三因素三水平试验设计
1.6 生物反应器PRV增殖条件优化
在1.2 L DASGIP四联平行生物反应器中,按照表2,分别以不同MOI、细胞密度、培养温度、搅拌转速条件,接种PRV,病毒接种24、48、72 h取样测定TCID50[16-17]。
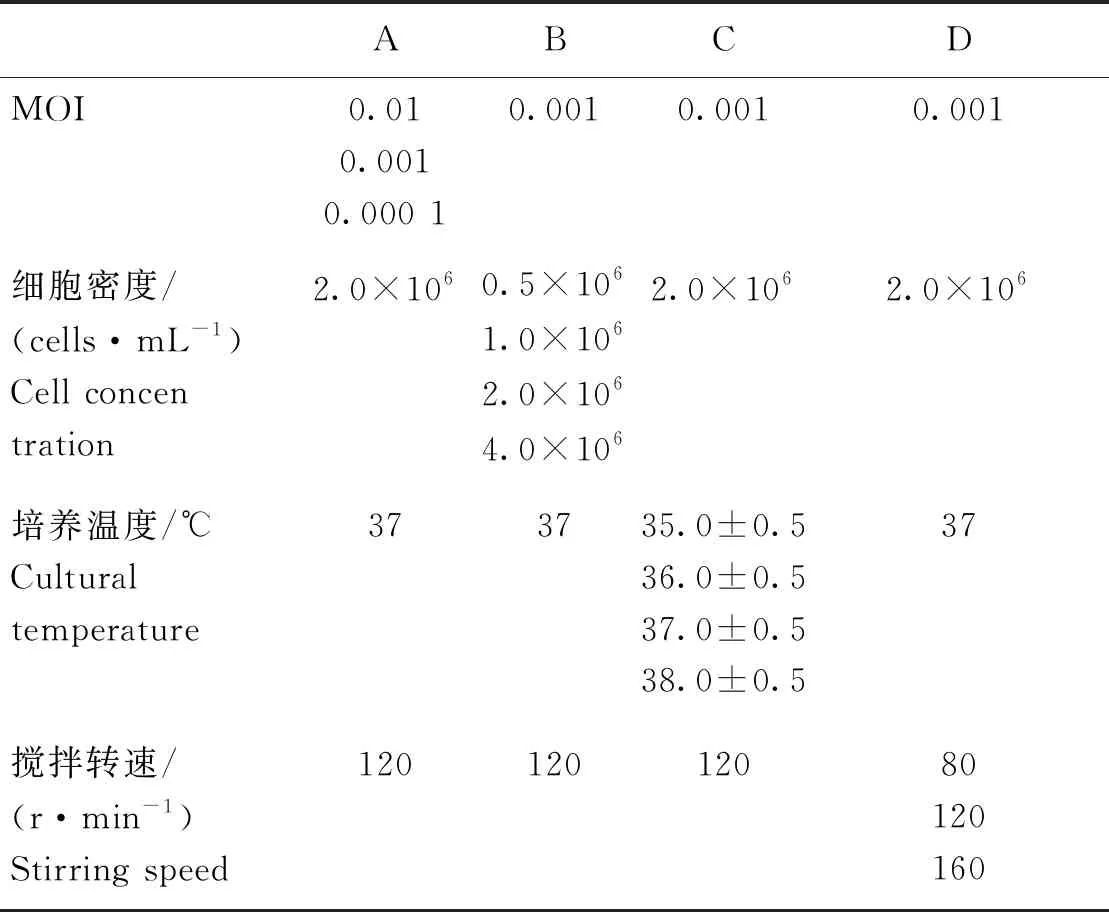
表2 生物反应器中PRV增殖条件
根据响应面法确定的细胞培养最佳条件和单因素试验确定的病毒增殖最佳条件,扩大培养至5 L生物反应器,接种病毒,连续培养至72 h,每24 h取样计数,绘制细胞生长曲线,并测定TCID50[15]。
1.7 数据分析

2 结 果
2.1 BHK-21细胞PRV敏感性研究
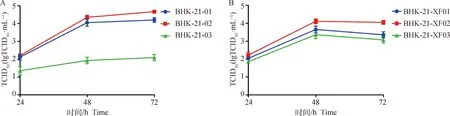
BHK-21-01、BHK-21-02、BHK-21-03三株贴壁细胞常规培养形态有差异,BHK-21-01、BHK-21-02细胞长势优于BHK-21-03细胞。接种PRV后24 h,BHK-21-02细胞出现少量细胞圆缩,产生轻微CPE,而BHK-21-01、BHK-21-03细胞未见明显CPE;48 h,BHK-21-02细胞出现大量细胞圆缩,产生明显CPE,BHK-21-01、BHK-21-03细胞有轻微CPE产生;72 h,BHK-21-02细胞几乎所有细胞圆缩、破碎,CPE完全,TCID50为(4.67±0.09)lgTCID50·mL-1(P<0.05),BHK-21-01、BHK-21-03细胞有明显CPE产生,TCID50分别为(4.20±0.13) lgTCID50·mL-1、(2.09±0.17)lgTCID50·mL-1(P<0.05);BHK-21-02细胞最敏感,作为后续TCID50病毒滴度检测细胞(图1、3)。
BHK-21-XF01、BHK-21-XF02、BHK-21-XF03三株悬浮细胞常规培养形态无差异,细胞圆亮、边缘整齐,大小均一。接种PRV后24 h,细胞发生明显CPE;48 h,细胞直径变大,开始崩解;72 h,细胞大量崩解、出现大量细胞碎片,TCID50分别为(3.35±0.17)、(4.05±0.11)、(3.07±0.18)lgTCID50·mL-1(P>0.05),BHK-21-XF02细胞最敏感,用于后续研究(图2、3)。

A1. BHK-21-01细胞;A2. BHK-21-01接毒后72 h;B1. BHK-21-02细胞;B2. BHK-21-02接毒后72 h;C1. BHK-21-03细胞;C2. BHK-21-03接毒后72 h
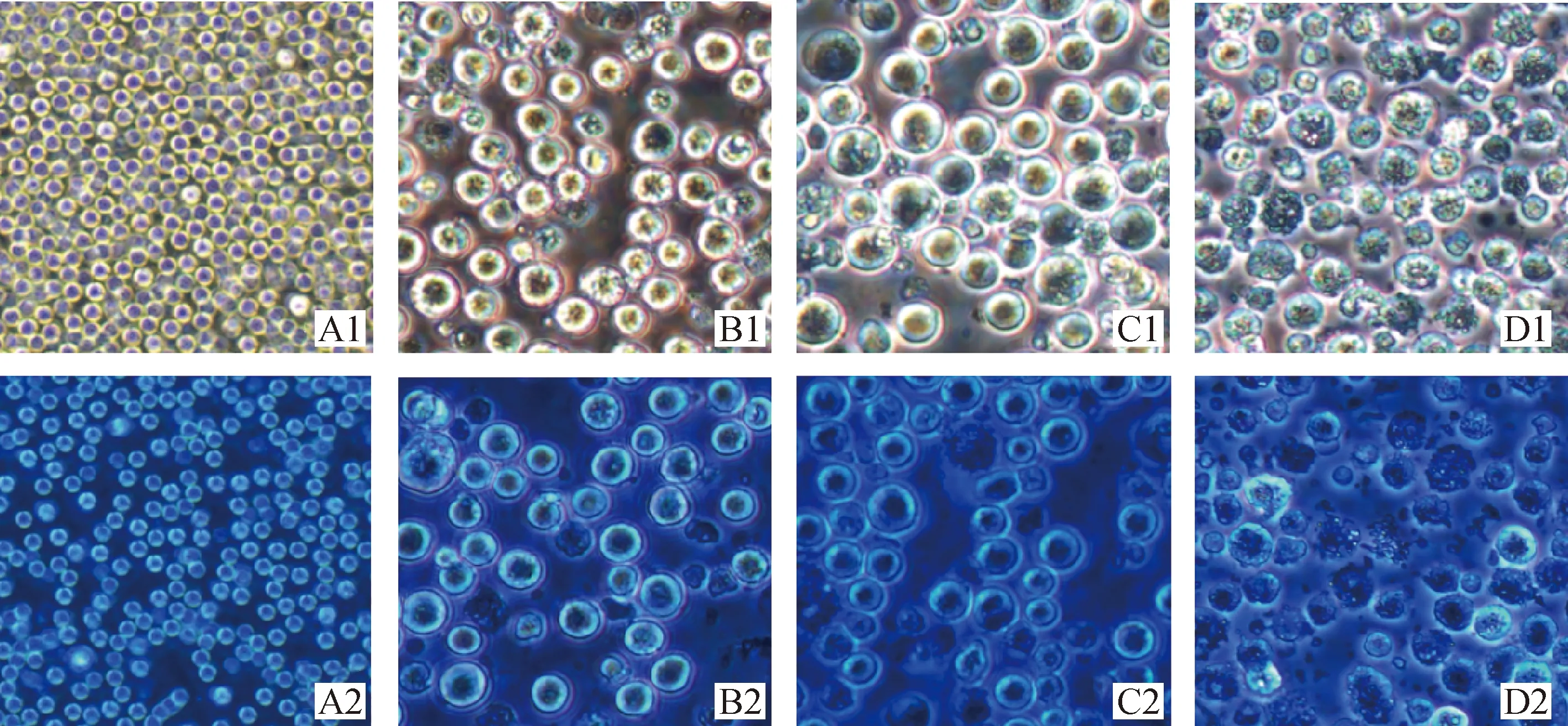
A1、A2. BHK-21-XF02悬浮细胞;B1、B2. 24 h;C1、C2. 48 h;D1、D2. 72 h;1. 未染色;2. 台盼蓝染色
A. BHK-21贴壁细胞;B. BHK-21悬浮细胞
2.2 BHK-21-XF02悬浮细胞生长特性分析
摇瓶中,BHK-21-XF02细胞在含3% NBS的SLM-BHK低血清培养基和SFM-BHK无血清中连续传代培养3代后,分别以0.3×106、0.6×106、0.9×106、1.2×106、1.5×106cells·mL-1的密度接种培养,生长曲线均呈近“S”型(图4)。
在含3%NBS的SLM-BHK低血清培养基中,不同接种密度细胞的最大增殖密度分别为(12.59±1.28)×106、(15.69±1.47)×106、(18.13±0.68)×106、(17.21±1.48)×106、(18.09±0.86)×106cells·mL-1,差异显著(P<0.05);倍增时间分别为(19.03±0.49)、(22.13±0.67)、(23.51±0.78)、(25.68±0.89)、(24.45±0.63) h(图5);不同密度接种培养BHK-21-XF02细胞的倍增时间随着接种密度的增大逐渐增加,比生长速率均在36 h时达到最大比生长速率,最大比生长速分别为(0.059±0.016)、(0.063±0.020)、(0.067±0.010)、(0.058±0.018)、(0.052±0.016) h-1,随后比生长速率迅速下降,差异显著(P<0.05)(图6)。
在SFM-BHK无血清中,不同接种密度细胞的最大增殖密度分别为(7.34±0.25)×106、(8.14±0.47)×106、(8.95±0.47)×106、(8.81±0.44)×106、(8.72±0.44)×106cells·mL-1,0.3×106与0.6×106cells·mL-1组差异不显著(P>0.05),与其他组差异显著(P<0.05);倍增时间分别为(21.71±0.61)、(23.15±0.70)、(26.06±0.74)、(30.66±0.82)、(33.56±0.60)h(如图4)。比生长速率BHK21-XF02悬浮细胞均在36 h时达到最大比生长速率,最大比生长速分别为(0.054±0.006)、(0.051±0.009)、(0.055±0.008)、(0.055±0.007)、(0.042±0.014) h-1,随后比生长速率迅速下降,差异显著(P<0.05)(图6)。

A1、A2. 低血清培养基;B1、B2. 无血清培养基
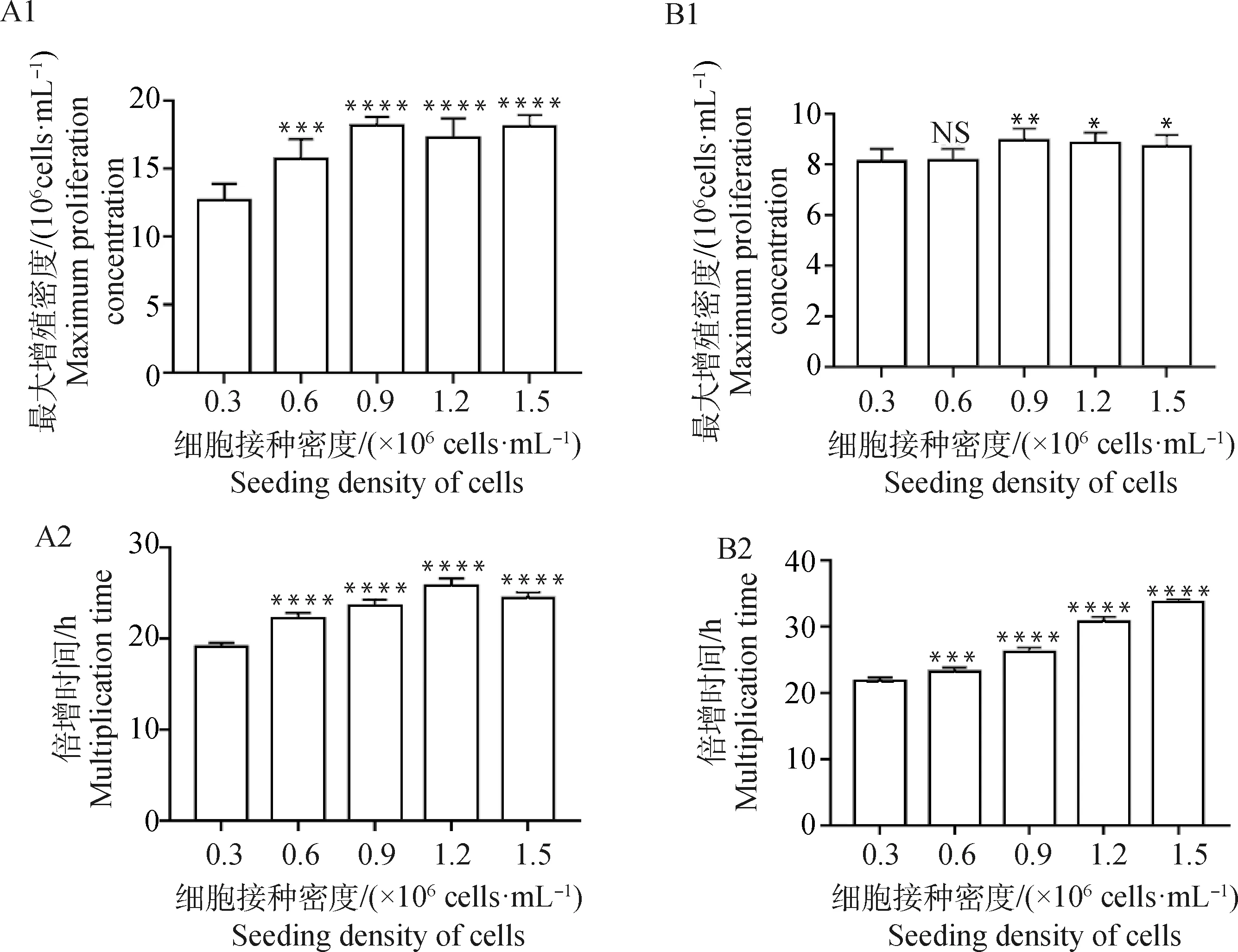
A1、A2. 低血清培养基;B1、B2. 无血清培养基; NS.P>0.05, *.P<0.05, **.P<0.01, ***.P<0.001, ****.P<0.000 1

A1、A2. 低血清培养基;B1、B2. 无血清培养基; **.P<0.01, ***.P<0.001, ****.P<0.000 1
BHK-21-XF02细胞接种PRV,相比于含3% NBS的SLM-BHK低血清培养基,SFM-BHK无血清培养基中病毒增殖效果较好,差异显著(P=0.023 7),培养至24 h病毒滴度为(2.28±0.07) lgTCID50·mL-1,48 h为(4.89±0.20) lgTCID50·mL-1,72 h为(3.47±0.20) lgTCID50·mL-1(图7),故选择SFM-BHK无血清培养基进行后续反应器条件优化。
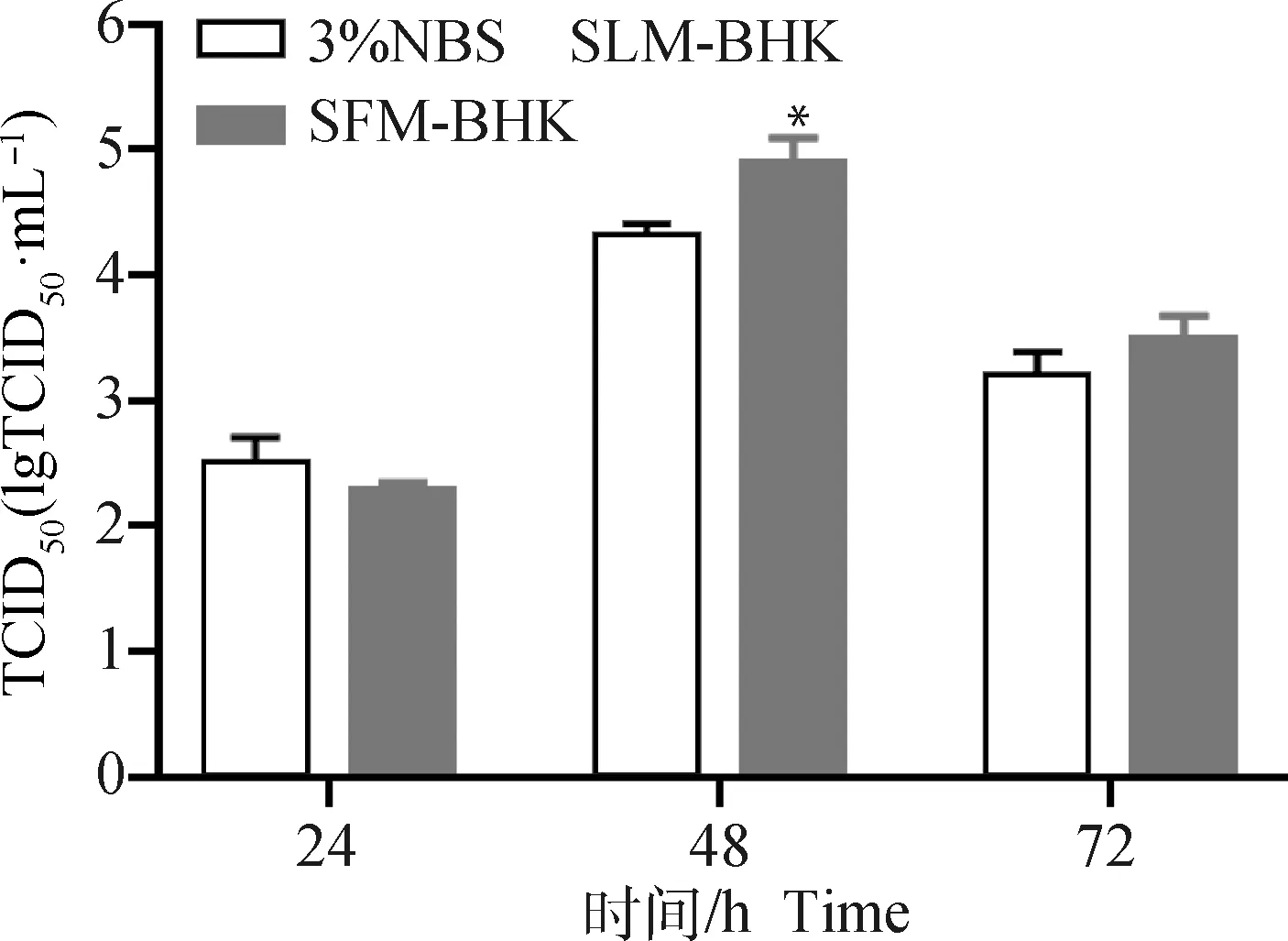
*.P=0.023 7
2.3 生物反应器BHK-21-XF02悬浮细胞培养条件优化
采用Box-Behnken中心组合设计了17组试验,对中心点重复了5组试验(如表3)。每24 h取样计数,以培养至72 h的细胞增殖密度作为评价指标,评价三个变量对培养过程中细胞增殖产生的影响。根据17组试验的结果,使用Design-Expert.V8.0.6.1软件对试验数据进行多元回归拟合,得到了1.2 L反应器培养BHK-21悬浮细胞增殖密度与三个变量之间关系的二次多项回归方程(3):

表3 Box-Behnken中心组合试验设计与结果
细胞密度(cells·mL-1)=726.20+72.38×A-18.62×B+ 6.50×C+31.00×A×B-40.75×A×C-74.25×B×C+14.90×A2-55.10×B2-81.85×C2
(3)
通过对该多元二次模型进行F检验和方差分析(ANOVA)(见表4),本试验建立的多元二次模型具有显著性(P<0.000 1),失拟项差异不显著(P=0.130 9>0.05),说明未知因素对试验的结果干扰小。决定系数R2=0.983 3,校正决定系数为R2Adj=0.961 9,建立的二次多项模型能解释96.19%的响应值变化,结果表明该模型的拟合度良好,用此模型对1.2 L反应器培养BHK-21-XF02细胞增殖条件进行优化。
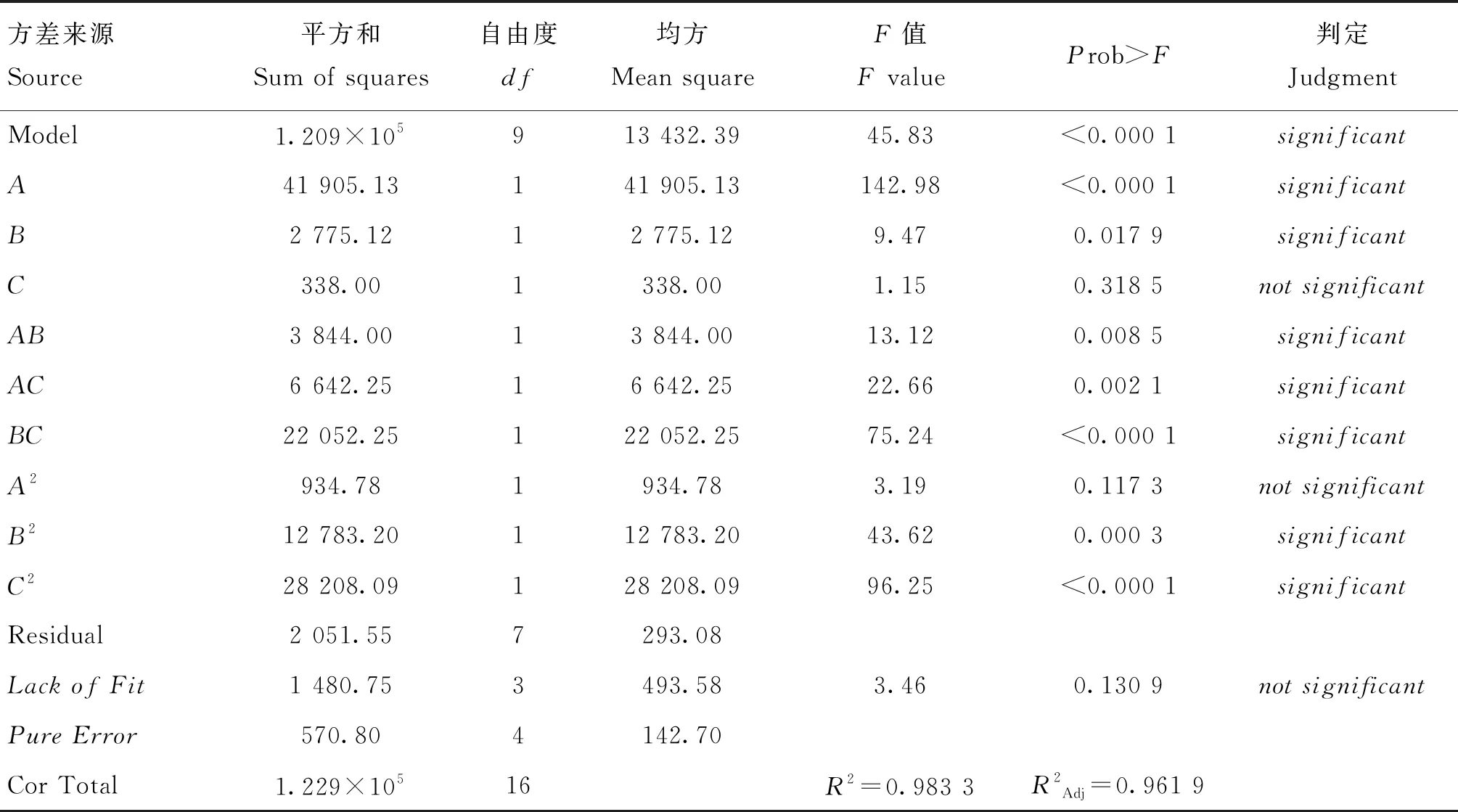
表4 多元二次模型统计学分析
对回归方程的回归系数进行显著性检验,结果表明,试验中A、B、AB、AC、BC、B2、C2对BHK-21-XF02细胞增殖密度影响显著(P<0.05),在1.2 L反应器培养BHK-21-XF02细胞增殖的过程中,接种密度和搅拌转速对细胞增殖具有显著的影响,而且三个因素(AB、AC、BC)交互作用也会对细胞增殖造成显著影响。
通过多元二次模型方程的建立得到了3个因素交互作用的响应面3D图(图8),从动态图和等高线的形状可以看出搅拌转速与接种密度对BHK-21-XF02细胞增殖密度的交互作用的影响显著(P<0.05),细胞增殖密度随着接种密度和搅拌转速的升高而增加;将溶氧固定在0水平时,细胞增殖密度伴随着接种密度和搅拌转速的升高而增加;当接种密度和搅拌转速过高时细胞增殖密度呈下降趋势;低接种密度和(低搅拌转速/高搅拌转速)均不利于细胞增殖。溶氧与接种密度对细胞增殖密度的交互作用的影响极显著(P<0.000 1),等高线呈椭圆形,细胞增殖密度与接种密度呈正相关,连续培养至72 h,细胞增殖密度达到7.69×106cells·mL-1。溶氧与搅拌转速对细胞增殖密度的交互作用的影响显著(P<0.05)。从图8可以看出当溶氧和搅拌转速过低时,在培养过程中对细胞增殖影响较大,连续培养至72 h,细胞增殖密度仅仅为5.10×106cells·mL-1,低溶氧和低搅拌转速会造成细胞增殖速率下降。
根据所建立的模型及试验结果,利用Design-Expert.V8.0.6.1软件分析得到了1.2 L反应器培养BHK-21-XF02细胞增殖的最佳培养条件:接种密度为1.20×106cells·mL-1、搅拌转速为120.97 r·min-1、DO值为39.36%,在此条件下细胞增殖密度理论值为8.22×106cells·mL-1。在反应器中实际设定值分别为接种密度为1.20×106cells·mL-1、搅拌转速为120 r·min-1、DO值为40%,1.2 L反应器中进行了3次重复试验验证,连续培养至72 h,细胞增殖密度为(7.75±0.27)×106cells·mL-1、细胞活率为95.43%;相比于预测理论值误差为0.47×106cells·mL-1,符合度为94.26%。
按1.2 L反应器优化得到的培养参数,进行5 L反应器扩大批培养,细胞生长曲线和活率如图8d所示,从图中可以看出生长曲线近成“S”型,培养至72 h时细胞密度为(7.61±0.18)×106cells·mL-1、细胞活率为(96.93±1.18)%,在线性放大过程中,BHK-21-XF02悬浮细胞生长动力学较稳定,实现了5 L生物反应器的扩大培养。
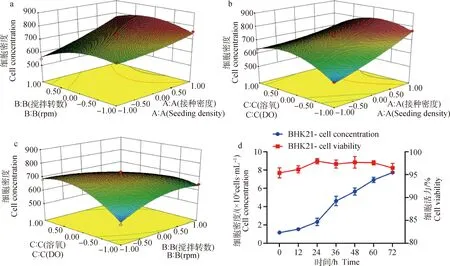
a.接种密度与搅拌转速;b.接种密度与溶氧;c.溶氧与搅拌转速;d.5 L反应器生长曲线
2.4 生物反应器PRV增殖条件优化
利用单因素分析法在1.2 L反应器中优化PRV增殖条件,结果显示(图9)按MOI=0.001接种PRV增殖效果更好,24、48、72 h病毒滴度TCID50分别为(2.77±0.23)、(5.45±0.051)、(4.21±0.11) lgTCID50·mL-1(P<0.05)。按2×106cells·mL-1细胞密度接种病毒更有利于病毒的增殖,24、48、72 h病毒滴度TCID50分别为(3.80±0.27)、(6.34±0.15)、(6.0±0.10)lgTCID50·mL-1(P<0.05)。病毒增殖的最适温度为(37.0±0.5)℃,培养至24、48、72 h病毒滴度TCID50分别为(4.06±0.18)、(6.27±0.16)、(6.01±0.19)lgTCID50·mL-1(P<0.05)。培养转速为120、80 r·min-1时病毒增殖效果较好,但在80 r·min-1时培养效果最佳,24、48、72 h病毒滴度TCID50分别为(4.52±0.38)、(7.06±0.17)、(6.38±0.15)lgTCID50·mL-1(P<0.05)。

A.MOI;B.细胞浓度;C.搅拌转速;D.温度;*.P<0.05, **.P<0.01, ***.P<0.001, ****.P<0.000 1
按1.2 L生物反应器优化得到的病毒增殖参数,进行5 L生物反应器扩大批培养,接毒后连续培养至72 h,每12 h取样测定细胞密度和细胞活率,细胞生长曲线和活率曲线见图10A,培养至12 h时细胞快速增殖、24 h时病毒开始增殖,抑制了细胞的增殖,细胞密度和细胞活率逐步下降,48 h时病毒大量扩增,细胞密度和细胞活率分别为(2.96±0.17)×106cells·mL-1、(66.69±6.66)%,72 h时细胞密度和细胞活率分别为(2.19±0.17)×106cells·mL-1、(20.58±7.23)%(P<0.05);接种病毒后培养至24 h后,每12 h取样检测病毒滴度,病毒滴度TCID50见图10B,接种病毒后24~72 h病毒滴度先升高后下降,48 h时病毒滴度达到最大值(7.13±0.11)lgTCID50·mL-1(P<0.05)。
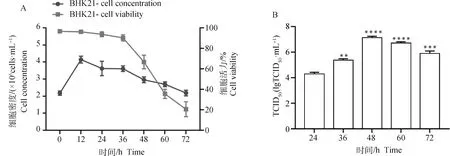
A. 接毒后细胞生长曲线;B. TCID50;**.P<0.01, ***.P<0.001, ****.P<0.000 1
3 讨 论
PRV在世界各地猪场流行已有近百年,给许多国家造成了巨大的经济损失[6]。20世纪90年代以来,一些欧美国家如英国、丹麦、荷兰、美国等利用gE基因缺失的PRV制备疫苗,大规模免疫动物并淘汰感染动物,已经消灭了PR。但是,对于部分发展中国家和地区,猪PR仍是动物传染病中危害最严重的疾病之一[1]。我国也在1974年引进gE基因缺失PRV疫苗,经过相关部门的安全性和有效性评价后,在鸡胚、猪肾和鸡胚原代细胞系中生产并应用,使得PRV一度得到了良好的控制。2011年底以后,包括PR疫苗免疫合格猪场陆续发生PRV变异株的感染疫情,迅速扩大至数省并席卷全国,给我国养猪业造成了巨大的经济损失。1947年,我国学者刘永纯等首次分离得到PRV,随后在牛和猪群中相继发现该病毒。近年来,我国学者大量分离获得野生PRV,调查显示,23个地区有80.1%的农场受变异PRV的影响,导致部分疫苗不能提供有效的完整保护。PRV出现了大范围的跨种传播现象,尤其2018年和2020年,我国学者分别报道了两例PRV变异毒株感染人的确诊病例,引起了研究人员的重视[5,18]。因此,适用于我国PR疫情防控的疫苗生产用毒株和高产能PR疫苗生产工艺的开发是解决现状的重要课题。
生物反应器无血清全悬浮培养技术应用于疫苗生产工艺具有极大优势,Bissinger等[12]开发MDCK悬浮培养技术生产流感疫苗工艺,实现了细胞高密度培养和病毒的高效增殖。Petiot等[10]首次建立了DuckCelt®-T17悬浮细胞系,进行了禽流感病毒增殖条件研究。另外,CHO-K1、HEK-293、SF9等细胞也实现了大规模悬浮培养,广泛用于抗体药物、病毒载体疫苗的生产,国际上生物反应器CHO-K1悬浮培养最大规模可达25 000 L,我国反应器悬浮培养技术规模与发达国家还存在一定差距[15-16, 19]。Nie等[20]探索了利用固定床生物反应器片状载体培养Vero贴壁细胞增殖PRV,发现按照0.2×106cells·mL-1接种Vero细胞,培养7 d后细胞密度可达5.8 × 106cells·mL-1,接毒后5 d,病毒滴度最高可达 11.13 lgTCID50。固定床片状载体细胞培养较悬浮培养换液容易、可实现多次收毒,但该培养模式较难实现线性放大,工艺过程需要胰蛋白酶、血清等动物来源辅料,片状载体原料基本依赖进口、价格昂贵。
本研究针对我国PR疫苗生产现状和技术瓶颈,开展BHK-21细胞增殖PRV工艺研究[6,19]。从本单位细胞库中,筛选出PRV敏感细胞株BHK-21-02贴壁和BHK-21-XF02悬浮细胞,比较了低血清和无血清培养基中BHK-21-XF02细胞生长特性和增殖病毒特性,研究发现细胞接种密度高低会直接影响细胞的生长动力学特性,接种密度过高导致细胞快速达到最大增殖密度,大量细胞代谢副产物急剧增加,迅速进入衰亡期。接种密度过低会导致培养时间增加,大大增加了生产成本和污染风险。选择合适倍增时间不仅有利于细胞最佳的生长状态也有利于生产实际结合,降低生产成本[21]。从细胞生长状态、病毒扩增、疫苗生产三个方面综合考虑,虽然在含3% NBS的低血清培养基中细胞生长较SFM无血清悬浮培养基中优势明显,但血清的添加将带来生物安全的威胁、大大增加了生产成本,除此之外,血清的使用会对下游纯化造成困难[11]。在无血清培养基中细胞最大增殖密度也可达到(8.95±0.47)×106cells·mL-1,满足生产需求。因此,优选SFM无血清培养基进行BHK-21-XF02细胞反应器培养条件的优化。从摇瓶到生物反应器的比例通常是不一致的,不同的培养体积、溶解氧浓度以及搅拌转速直接影响细胞的代谢水平和生长速率;因此,优化影响细胞生长生理参数,包括操作变量(温度、pH、接种密度、搅拌转速和溶解氧浓度)、培养基组分和补充剂(如葡萄糖和氨基酸)是十分重要的。在此基础上,本文筛选出了对PRV敏感的BHK-21-XF02细胞株,优化了BHK-21-XF02细胞株在SFM-BHK无血清培养基中培养的条件和PRV增殖条件,并实现了5 L生物反应器扩大培养,为相关研究和规模化生产奠定了基础[22-24]。
4 结 论
筛选获得PRV高敏感的BHK-21-02贴壁细胞和BHK-21-XF02悬浮细胞各1株,BHK-21-XF02悬浮细胞在含3%血清的SLM-BHK低血清培养基和SFM-BHK无血清培养基中均能实现良好的生长和病毒增殖。1.2 L反应器最佳培养条件为接种密度1.20×106cells·mL-1、搅拌转速120 r·min-1、DO值40%;5 L反应器批培养72 h细胞密度可达(7.61±0.18)×106cells·mL-1、细胞活率为(96.93±1.18)%。1.2 L反应器最佳病毒增殖条件为MOI 0.001、培养温度37 ℃、细胞密度2.0×106cells·mL-1、搅拌转速80 r·min-1;5 L反应器批培养接毒后48 h病毒滴度达到最大值(7.13±0.11)lgTCID50·mL-1。
