多模态影像技术在胶质瘤复发与放射性坏死鉴别诊断中的价值
2022-11-28麦麦提依明托合提王继超杨小朋吴永刚
张 诚 麦麦提依明·托合提 王继超 杨小朋 吴永刚
胶质瘤约占颅内恶性肿瘤的80%[1]。目前,胶质瘤的治疗方案主要为在保功能的前提下最大范围切除肿瘤,术后辅助放/化疗[2]。术后辅助放/化疗明显延长生存期[3],但术后放疗会对周围脑组织造成放射性坏死[4]。放射性坏死的临床表现及MRI 表现与胶质瘤复发高度相似,难以鉴别,而两者的治疗方案及预后又截然不同。准确诊断及鉴别胶质瘤复发与放射性坏死是目前临床的难题。两者鉴别的金标准是病检检查,但需手术取材,有风险。目前单一检查方式对胶质瘤术后复发与放射性坏死鉴别困难。本文探讨多模态影像技术在胶质瘤放射性坏死与术后复发鉴别中的价值。
1 资料与方法
1.1 研究对象 回顾性分析2016 年6 月至2021 年12月手术治疗并经术后病理检查确诊的45 例胶质瘤的临床资料,其中男25 例,女性20 例;年龄26~57岁,平均(41.9±15.1)岁;汉族24 例,维吾尔族17 例,其他民族4例。术后均行放疗,术后3~6个月复查灌注加权成像(perfusion weighted imaging,PWI)、弥散成像(dffusion weighted imaging,DWI)、磁共振波谱(magnetic resonance spectroscopy,MRS)等MRI 及PET-CT。本文符合“赫尔辛基宣言”原则,经我院伦理委员会批准。
以二次手术或穿刺活检病理检查结果为依据,作为诊断胶质瘤复发和放射性坏死的金标准。45例中,胶质瘤复发34 例(复发组),放射性坏死11 例(坏死组)。复发组34 例,其中男19 例,女15 例;平均年龄(40±13.6)岁;汉族20 例,维吾尔族12 例,其他民族2例。坏死组11例,其中男6例,女5例;平均年龄(47±20.1)岁;汉族4 例,维吾尔族5 例,其他民族2例。两组基线资料无统计学差异(P>0.05)。
1.2 诊断标准[5]胶质瘤复发诊断标准:随访期内术区强化、病灶增大或出现新发强化灶,伴周围水肿加重,临床症状恶化;穿刺活检或二次手术病理检查证实。放射性坏死诊断标准:随访期内强化缩小、病灶缩小或无变化、水肿减轻,临床症状减轻;穿刺活检或二次手术病理检查证实。
1.3 检查方法 避开坏死区、血管及出血区域。
1.3.1 MRI 检查 采用西门子3.0 T 磁共振机。PWI:选择肿瘤强化区域,测量同侧强化区域与对侧正常区域脑血容量(cerebral blood volume,CBV),计算rCBVmax=病灶侧CBVmax/对侧正常脑实质CBV⁃max。DWI:采用轴位扫描,选取3 个典型区域测量表观弥散系数(apparent diffusion coefficient,ADC),取平均值。MRS:采用化学位移选择激励法进行采集,体素大小为2 cm×2 cm×2 cm,主要测量N-乙酰天门冬氨酸(N-acetyal aspartic,NAA)、胆碱(cho⁃lion,Cho)、肌酸(creatine,Cr)等参数并计算Cho/NAA、Cho/Cr比值。
1.3.2 PET-CT 检查 应用德国西门子HR16 型PET/CT 仪,静脉注射18氟-脱氧葡萄糖,选取典型区域测量其标准摄取值(standard uptake value,SUV)并计算均值,SUV=(像素值/像素体积)/(放射性核素活度/体积)×校正因子[17]。见图1。
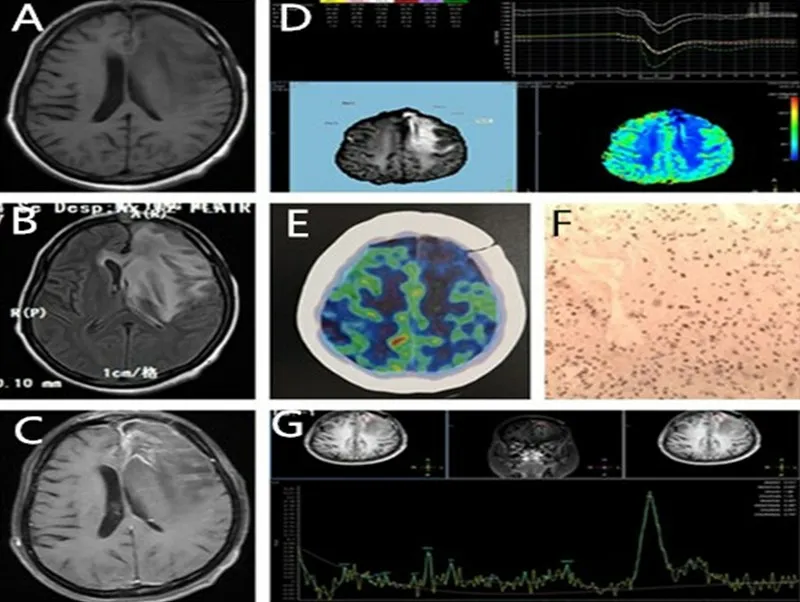
图1 胶质瘤术后放射性坏死的影像及病理表现
1.4 统计学分析 采用medcalc15.2软件分析;计量资料用±s描述,进行t检验;计数资料采用χ2检验;采用多因素logisitc 回归模型和ROC 曲线分析多模态影像指标鉴别诊断的效能;以P<0.05 为差异具有统计学意义。
2 结果
2.1 两组多模态影像指标比较 复发组rCBV、SUV、Cho/NAA 值明显大于坏死组(P<0.05),而ADC 值明显小于坏死组(P<0.05)。两组Cho/Cr值无统计学差异(P>0.05)。见表1。
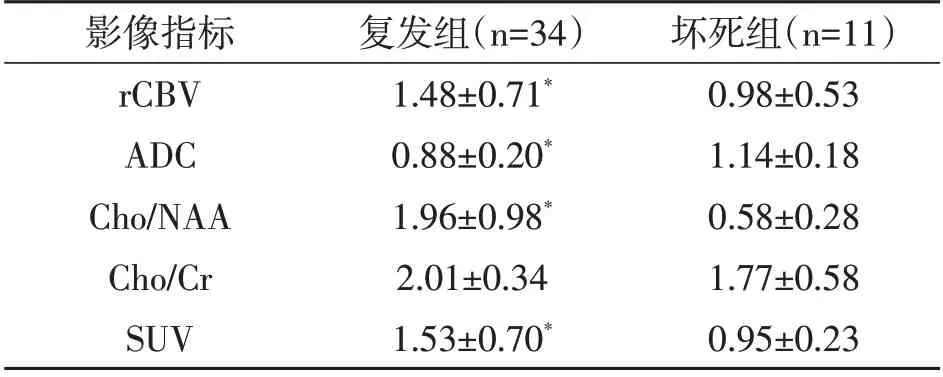
表1 两组多模态影像指标的比较
2.2 多模态影像指标鉴别诊断的效能ROC 曲线分析显示,rCBV、ADC、Cho/NAA、Cho/Cr、SUV 均具有鉴别价值,其中rCBV 效果最佳(P<0.05;表2、图2);而Cho/Cr 无明显鉴别意义(P>0.05;表2、图2)。rCBV、ADC、Cho/NAA、Cho/Cr、SUV 联合鉴别的敏感度、特异度分别为99%和100%,明显优于单一指标(P<0.01;图3)。
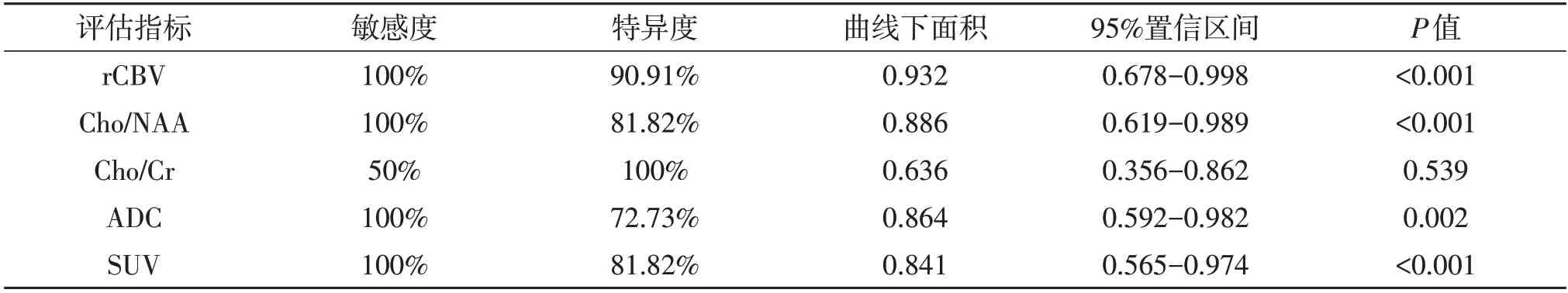
表2 多模态影像参数鉴别脑胶质瘤复发与放射性坏死的效果
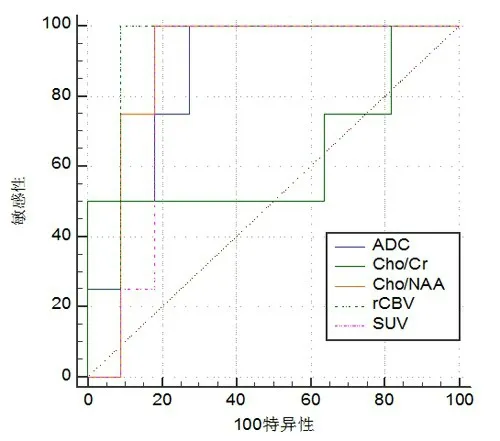
图2 ROC 曲线分析多模态影像参数鉴别脑胶质瘤复发与放射性坏死的效果
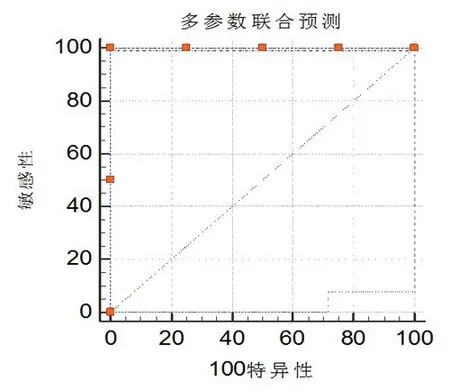
图3 ROC 曲线分析多模态影像多参数联合鉴别脑胶质瘤复发与放射性坏死的效果
3 讨论
DWI、PWI、MRS、PET-CT 等检查对胶质瘤有重要的鉴别诊断及定位诊断价值[5]。有研究指出胶质瘤术后1 年内复发率高达80%,复发病灶多在手术区域2 cm 范围内,少有超出此范围[6]。放射性坏死为放疗后慢性反应,多在6~18个月内发生[7],为放疗的严重并发症之一。放射性坏死可出现颅内压增高、神经功能缺失及癫痫发作等类似于肿瘤复发的临床表现[8];两者均会造成血脑屏障破坏、通透性增加,常规MRI增强后均表现为强化,很难鉴别。
PET-CT 是由分子水平描绘细胞组织的细微代谢差异[9,10],而多模态MRI通过交叉联用多种方式分别检测血供、代谢物和脑实质形态来多方位完整构建机体信息[11,12]。本文采用多模态磁共振技术,利用MRS、DWI、PWI 及PET-CT 联合鉴别脑胶质瘤复发与放射性坏死,结果显示,rCBV、ADC、Cho/NAA、SUV等指标在鉴别脑胶质瘤复发与放射性坏死方面具有较高价值,其中以rCBV 鉴别能力最佳;这些指标联合鉴别诊断的敏感度、特异度分别为99%和100%。
PWI 能反映局部微循环分布与血容量灌注水平,在鉴别复发肿瘤病灶与放射性坏死病灶中最常用的参数是rCBV[13]。有研究证实复发肿瘤因细胞增殖,组织代谢旺盛,新生血管增多,局部血容量增加,呈高灌注状态,rCBV明显高于正常组织[14];而放射性坏死组织因毛细血管减少,组织活跃性减少,纤维瘢痕组织形成,呈低灌注状态,rCBV 低于正常组织[15]。本文结果发现脑胶质瘤复发组rCBV 明显大于放射性坏死组(P<0.05),ROC曲线分析显示rCBV鉴别诊断的敏感度为100%、特异度为90.91%。
临床上,准确鉴别胶质瘤术后复发与放射性坏死具有重要意义,但单独MRI 或PET-CT 的鉴别作用有限且存在一定困难[12]。本文结果显示联合应用多模态MRI 及PET-CT 成像数据rCBV、Cho/NAA、Cho/Cr、SUV 及ADC,鉴别诊断的敏感度、特异度分别为99%和100%,明显优于单个指标,具有良好的临床应用价值,可避免不必要的二次手术。
本文尚有诸多不足:样本量较小,其中NAA/Cr结果与相关文献报道不符合,考虑样本量较小造成偏倚可能;MRI联合PET-CT的敏感度和特异度分别为99%和100%,过于理想,后续仍需进一步研究证实结果可靠性;多因素logistic 回归模型纳入变量不够全面,后续研究中应纳入更多临床及影像指标。
综上所述,单纯应用MRI 或PET-CT 某一序列或单一检查手段鉴别胶质瘤复发与放射性坏死具有一定局限性,联合应用PWI、DWI、MRS、PET-CT,可显著提高鉴别诊断准确率,对制定个体化治疗方案具有重要临床意义。
