vWF、HIF-1α、IL-6与动脉瘤性蛛网膜下腔出血后迟发性脑缺血的相关性
2022-11-28王栋华王波元周胜富郑富钧李跃平樊朝军
王栋华,王波元,周胜富,肖 寒,兰 超,郑富钧,李跃平,樊朝军
迟发性脑缺血(DCI)是导致动脉瘤性蛛网膜下腔出血(aSAH)预后不佳的严重并发症之一。据报道,约30%的aSAH患者发病后2周内可出现脑组织缺血或脑梗死,并引起肢体活动受限、失语等神经功能障碍症状,严重者可导致残疾或死亡[1-2]。如能对aSAH后DCI的发生进行早期预测,并及时采取针对性措施,可很大程度降低aSAH后DCI发生率,改善患者预后。血管性假血友病因子(vWF)由血管内皮细胞及巨核细胞合成和分泌,能反映血管内皮细胞激活或损伤的程度[3]。缺氧诱导因子-1α(HIF-1α)作为氧调节亚单位,与aSAH的发生、发展有密切联系[4]。白细胞介素-6(IL-6)是促炎细胞因子,其水平升高可增加aSAH后并发症发生风险[5]。vWF、HIF-1α及IL-6在aSAH后DCI的作用备受关注,但研究结论不尽一致。因此,本研究选取120例aSAH,分析vWF、HIF-1α、IL-6与aSAH后DCI的相关性,以期为aSAH后DCI的早期诊治提供参考。
1 资料与方法
1.1一般资料 选取2019年1月—2022年1月我院收治的120例aSAH。纳入标准:符合aSAH诊断标准[6];经全脑血管造影检查明确责任动脉瘤;初次发病;发病至就诊时间<24 h;家属签署知情同意书。排除标准:影像学检查未发现颅内动脉瘤;心、肺、肾严重功能障碍;急、慢性感染者;免疫系统、血液系统及恶性肿瘤者;入院后48 h内死亡者;临床资料缺失者。根据是否继发DCI将120例aSAH分为DCI组38例和非DCI组82例。本研究符合《世界医学会赫尔辛基宣言》要求。
1.2方法
1.2.1DCI诊断标准[7]:①aSAH发病4 d后出现如肢体活动受限、失语等新发神经功能障碍症状,持续≥1 h;②复查颅脑CT或MRI可见新低密度病灶;③排除因手术操作意外导致的脑出血、脑积水等。
1.2.2一般资料收集:包括性别、年龄、发病至入院时间、高血压病史、糖尿病史、有无脑水肿、动脉瘤最大直径、动脉瘤位置、手术方式、Hunt-Hess分级、改良Fisher分级。
1.2.3实验室指标测定:采集2组入院时肘静脉血3 ml,以酶联免疫吸附试验测定vWF、HIF-1α、IL-6水平,试剂盒购自上海酶联生物科技有限公司,由同一组检测人员严格按照试剂盒说明书检测。
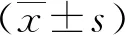
2 结果
2.1一般资料比较 2组性别、年龄、发病至入院时间、高血压病史、糖尿病史、动脉瘤最大直径、手术方式比较差异无统计学意义(P>0.05);DCI组脑水肿、前循环、Hunt-Hess分级≥Ⅲ级和改良Fisher分级≥Ⅲ级患者比例高于非DCI组(P<0.05)。见表1。
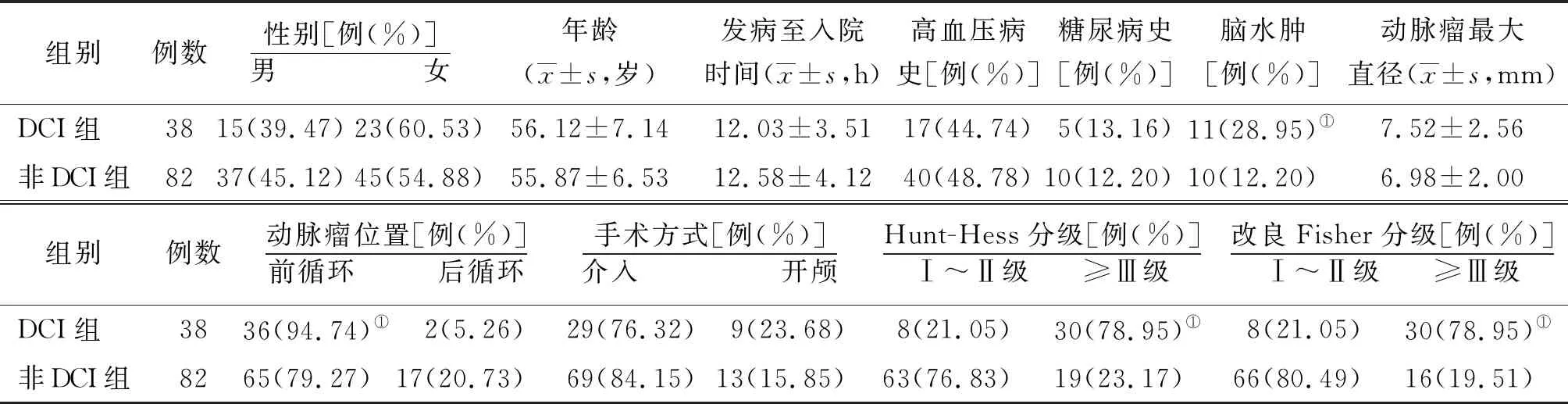
表1 2组aSAH一般资料比较
2.2vWF、HIF-1α、IL-6水平比较 DCI组vWF水平低于非DCI组,HIF-1α、IL-6水平高于非DCI组(P<0.01)。见表2。

表2 2组aSAH vWF、HIF-1α、IL-6水平比较
2.3vWF、HIF-1α、IL-6水平的相关性 vWF与HIF-1α、IL-6水平呈负相关(r=-0.445、-0.471,P<0.05),HIF-1α与IL-6水平呈正相关(r=0.452,P<0.05)。
2.4aSAH后DCI发生的危险因素 以aSAH是否继发DCI为因变量(是=1,否=0),以脑水肿(是=1,否=0)、动脉瘤位置(前循环=1,后循环=0)、Hunt-Hess分级(≥Ⅲ级=1,Ⅰ~Ⅱ级=0)、改良Fisher分级(≥Ⅲ级=1,Ⅰ~Ⅱ级=0)、vWF(升高=1,正常=0)、HIF-1α(升高=1,正常=0)、IL-6(升高=1,正常=0)为自变量。多因素Logistic回归分析显示,脑水肿、Hunt-Hess分级≥Ⅲ级和改良Fisher分级≥Ⅲ级以及vWF、HIF-1α、IL-6水平升高是aSAH后发生DCI的危险因素(P<0.01)。见表3。

表3 aSAH后DCI发生的危险因素多因素Logistic回归分析
2.5vWF、HIF-1α、IL-6水平对aSAH后DCI的诊断价值 vWF、HIF-1α、IL-6联合诊断aSAH后DCI的曲线下面积(AUC)大于vWF、HIF-1α、IL-6单独检测(P<0.05)。见图1、表4。
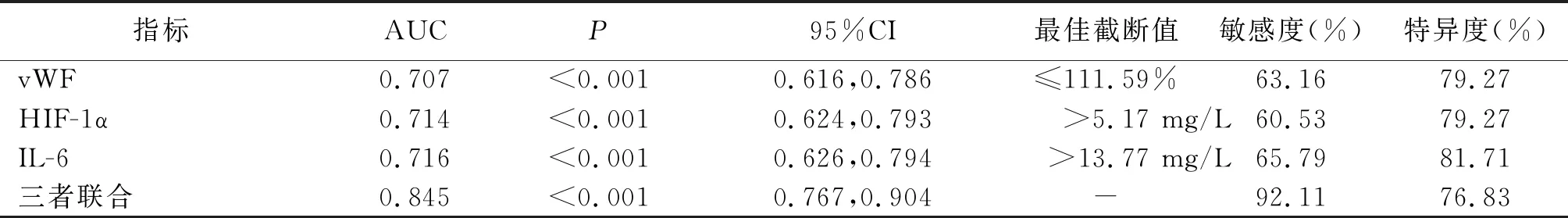
表4 vWF、HIF-1α、IL-6水平对aSAH后DCI的诊断价值
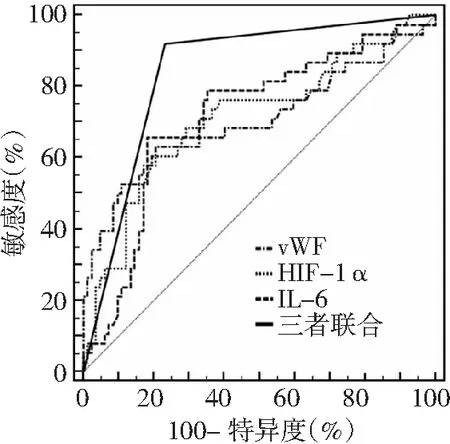
图1 vWF、HIF-1α、IL-6单独及联合诊断aSAH后DCI的ROC曲线
3 讨论
目前关于DCI的发病机制尚无统一标准,脑血管痉挛(CVS)、微循环功能障碍、神经炎症反应、早期脑损伤等均提示与aSAH后DCI发生相关[8-9]。近些年随着诊疗技术、显微外科的发展,早期手术及介入治疗使aSAH患者预后得到明显改善,但DCI作为aSAH的严重并发症之一,致残、致死率很高[10]。既往临床预测aSAH后DCI常用脑灌注压、CT血管造影、脑电图等影像学检查手段,但存在耗时长,费用相对昂贵等不足,临床应用受限。因此,临床致力于寻找可靠的生物标志物,以期为早期防治aSAH后DCI提供可靠依据。
vWF是一种具有黏附能力的大分子糖蛋白,可调控血管增生、参与血栓形成。在机体正常状态下,vWF对维持正常凝血功能发挥重要作用。vWF主要经内皮细胞合成,其分泌标志着内皮细胞受损而被激活[11]。LI等[12]通过检测aSAH患者血浆vWF水平发现,预后良好组血浆vWF水平低于预后不良组,提示vWF与aSAH患者预后相关,推测vWF可能参与DCI发生。HIF-1α是在机体缺氧适应过程中产生的转录因子,在多种细胞中均有表达。研究发现HIF-1α表达强度与脑损伤程度密切相关[13]。动物实验表明,蛛网膜下腔出血(SAH)组大鼠HIF-1α蛋白含量明显高于正常大鼠[14]。另有研究显示,炎症反应贯穿aSAH发生、发展的整个过程,且是导致aSAH后DCI的重要机制之一[15-16]。aSAH后,大量血液进入蛛网膜下腔,导致出血部位红细胞分解代谢产物沉积,引起炎性因子如IL-6的分泌和释放,损伤血管内皮功能,诱发CVS,从而导致DCI[17]。国外研究显示,aSAH患者在发病后脑脊液、血清IL-6显著升高[18]。推测vWF、HIF-1α、IL-6与aSAH后DCI有关。本研究结果显示,与非DCI组相比,DCI组vWF表达水平降低,而HIF-1α、IL-6表达水平升高,且经Pearson相关分析,vWF与HIF-1α、IL-6呈负相关,HIF-1α与IL-6呈正相关,提示vWF、HIF-1α、IL-6可能共同参与aSAH后DCI的发生、发展。
本研究结果显示,DCI组脑水肿、动脉瘤位于前循环、Hunt-Hess分级≥Ⅲ级和改良Fisher分级≥Ⅲ级患者比例高于非DCI组,提示除vWF、HIF-1α、IL-6外,aSAH患者合并脑水肿、动脉瘤位置、Hunt-Hess分级和改良Fisher分级情况均可能与DCI发生有关。进一步多因素Logistic回归分析发现,脑水肿、Hunt-Hess分级≥Ⅲ级和改良Fisher分级≥Ⅲ级以及vWF、HIF-1α、IL-6水平升高均是影响aSAH患者继发DCI的危险因素。脑水肿一方面提示脑血管初次破裂出血所造成的早期脑损伤较严重,另一方面可引起颅内高压,导致脑血流灌注不足,从而增加DCI发生的风险[19]。Hunt-Hess分级可反映aSAH患者的意识障碍程度以及对缺血、出血的耐受性,分级越高,提示患者预后越差[20]。改良Fisher分级以蛛网膜下腔出血的严重程度划分,分级越高,提示蛛网膜下腔出血量越大,发生CVS的可能性越大,故DCI发生的风险更高[21]。此外,本研究ROC曲线分析结果显示,vWF、HIF-1α、IL-6预测aSAH后DCI发生的AUC分别为0.707、0.714、0.716,提示三者均可作为预测aSAH后DCI发生的血清学指标,但敏感度较低,单独预测准确率待提高;三者联合预测aSAH后DCI发生的AUC为0.845,高于三者单独预测,进一步证实了vWF、HIF-1α、IL-6联合检测可作为预测aSAH后DCI发生的可靠生物学标志物。
综上所述,vWF、HIF-1α、IL-6与aSAH后DCI发生密切相关,测定vWF、HIF-1α、IL-6水平有利于预测aSAH后DCI发生情况,影响aSAH后DCI发生的因素众多,针对上述危险因素,应尽早采取针对性干预措施,以便早期防治aSAH后DCI。
