芍药苷对TNF-α诱导的川崎病血管内皮细胞氧化应激和炎症的影响
2022-11-28杨艳娟李洁滢
杨艳娟,胡 琳,李洁滢,田 正,周 忠,焦 蓉
川崎病(kawasaki disease, KD)是一种以全身性血管炎为特征的儿童发热性疾病,5岁以下儿童多见。冠状动脉病变为其严重并发症,经静脉注射免疫球蛋白治疗后仍有25%的患儿发生冠状动脉病变。KD发病机制尚不清楚,但临床普遍认为,氧化应激和炎症导致的内皮功能障碍可能参与了KD的起始和发展[1]。红系衍生核因子相关因子2(Nrf2)是一种调节抗氧化基因表达的转录因子,能结合抗氧化反应元件(ARE)控制细胞保护基因的表达,如血红素氧化酶-1(HO-1)[2]。有研究发现,与健康儿童比较,KD急性期患儿外周血Nrf2及HO-1水平显著降低,静脉注射免疫球蛋白治疗后升高,这说明KD血管内皮损伤可能受Nrf2/HO-1信号通路的调控[3]。芍药苷(PF)是芍药的主要有效成分,不仅具有多种生物学效应,且不良反应较小。已有研究发现,PF可通过激活Nrf2/HO-1信号通路抑制脂多糖刺激的人Caco-2细胞炎症反应、抵抗H2O2诱导的黑素细胞氧化应激等[4-5]。但PF能否预防或治疗KD血管内皮损伤少见报道。本研究拟采用肿瘤坏死因子-α(TNF-α)处理人冠状动脉内皮细胞(HCAECs)建立KD细胞损伤模型[6-7],观察PF对KD血管内皮细胞是否具有保护作用,并进一步探讨其机制。
1 材料与方法
1.1主要材料 HCAECs细胞株购自深圳Otwo Biotech公司;PF(纯度>98%)购自上海阿拉丁生化科技股份有限公司;超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)试剂盒购自南京建成生物工程研究所;活性氧(ROS)试剂盒购自北京索莱宝科技有限公司;TNF-α、β-actin一抗、Nrf2一抗、闭锁小带蛋白-1(ZO-1)一抗、兔二抗、鼠二抗购自Proteintech公司;白细胞介素-1β(IL-1β)、HO-1、白细胞介素-6(IL-6)一抗购自ABclonal公司;磷酸化核因子-κB(p-NF-κB)、Keap1一抗购自沈阳万类生物科技有限公司。
1.2方法
1.2.1细胞培养与药物制备:HCAECs细胞接种于含10%牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM培养基,置于37 ℃含5% CO2的培养箱中常规培养,根据细胞生长密度进行换液和传代培养。PF用DMSO稀释至100 mg/ml并用培养基调节其终浓度为25 μg/ml。TNF-α用蒸馏水稀释至25 μg/ml并用培养基调节其终浓度为50 ng/ml。
1.2.2实验分组与给药:HCAECs细胞随机分为Control组、PF组、KD组、PF+KD组。各组细胞均给予含10%牛血清的DMEM培养基培养12 h,Control组不给予任何处理,PF组和PF+KD组给予浓度为25 μg/ml的PF预处理24 h,随后KD组和PF+KD组给予浓度为50 ng/ml的TNF-α处理6 h。
1.2.3CCK-8法检测HCAECs细胞增殖:取对数生长期的HCAECs细胞接种于96孔培养板(4000个/孔),置于细胞培养箱中过夜,待细胞贴壁生长良好,分别以不同浓度PF(0、12.5、25、50、100、200 μg/ml)处理HCAECs细胞24 h,或不同浓度TNF-α(0、12.5、25、50 ng/ml)处理HCAECs细胞6 h,结束后每孔加入10 μl CCK-8试剂,避光孵育2.5 h,取出后于酶标仪450 nm处测定各孔吸光度值,以上实验每组至少4个复孔,至少重复3次。
1.2.4细胞内ROS水平测定:将处于对数生长期的HCAECs细胞制成细胞悬液,以2.5×104/ml浓度接种于24孔培养板,每孔1 ml。待细胞贴壁生长良好后分组处理,结束后吸去上清,每孔加入500 μl Hoechst处理5 min,吸去上清,温热PBS冲洗3次,按照说明书原位装载DCFH-DA探针,荧光显微镜下检测ROS的水平,以上实验至少重复3次。
1.2.5细胞内SOD和T-AOC检测:HCAECs细胞分组处理后,用细胞刮收集细胞并使用BCA试剂盒检测蛋白含量,然后使用相应试剂盒分别应用WST-1检测SOD活性和ABTS法检测T-AOC,以上实验每组至少4个复孔,至少重复3次。
1.2.6qRT-PCR法检测细胞内炎性因子及黏附分子mRNA含量:按照细胞RNA提取试剂盒说明书提取各组总RNA,严格按照逆转录试剂盒说明书将RNA逆转录为cDNA,实时荧光定量PCR仪进行检测。β-actin、IL-6、白细胞介素-8(IL-8)、IL-1β、细胞间黏附因子-1(ICAM-1)、血管细胞黏附因子-1(VCAM-1)、E-选择素扩增引物由武汉金开瑞生物工程有限公司合成。引物序列见表1。以β-actin为内参,采用2-ΔΔCt法计算IL-1β、IL-6、IL-8、ICAM-1、VCAM-1、E-选择素的mRNA相对表达量,以上实验至少重复3次。

表1 实时荧光定量PCR引物序列
1.2.7Western blot法检测细胞中IL-1β、IL-6、Nrf2、HO-1、p-NF-κB、ZO-1蛋白表达:收集细胞,预冷PBS冲洗,加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解缓冲液提取总蛋白,BCA法测定细胞提取液中总蛋白浓度。取总蛋白25 μg上样至SDS-PAGE凝胶,恒压电泳,转膜至PVDF膜,5%脱脂奶粉(TBST溶解)室温下封闭1 h,加入一抗4 ℃条件下孵育过夜。TBST缓冲液洗涤,加入相应的二抗室温孵育1 h,ECL化学发光法显色,以上实验至少重复3次。
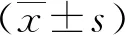
2 结果
2.1PF及TNF-α对HCAECs细胞增殖的影响 不同浓度PF均对HCAECs细胞增殖无明显影响(P>0.05);TNF-α浓度<50 ng/ml对HCAECs细胞增殖无明显影响(P>0.05),而TNF-α浓度为50 ng/ml能明显抑制HCAECs细胞增殖(P<0.01)。见图1。
图1 CCK-8法检测PF和TNF-α对HCAECs细胞增殖的影响
2.2PF对HCAECs细胞ROS、SOD和T-AOC的影响 免疫荧光示,ROS荧光染色后细胞核呈蓝染,胞质中ROS呈绿染。Control组细胞ROS荧光较弱,PF组细胞ROS荧光强度较Control组无明显变化,KD组细胞ROS荧光强度较Control组增强,PF+KD组细胞ROS荧光强度较KD组降低。与Control组比较,PF组SOD活性和T-AOC差异无统计学意义(P>0.05),KD组SOD活性和T-AOC降低(P<0.05,P<0.01);与KD组比较,PF+KD组SOD活性和T-AOC升高(P<0.05,P<0.01)。见图2。

图2 PF对HCAECs细胞ROS、SOD、T-AOC的影响
2.3PF对HCAECs细胞炎性因子及黏附分子mRNA表达的影响 与Control组比较,PF组IL-1β、IL-6、IL-8、ICAM-1、VCAM-1、E-选择素mRNA表达差异无统计学意义(P>0.05),而KD组上述mRNA表达明显升高(P<0.01);与KD组比较,PF+KD组IL-1β、IL-6、IL-8、ICAM-1、VCAM-1、E-选择素mRNA表达明显降低(P<0.05,P<0.01)。见图3。
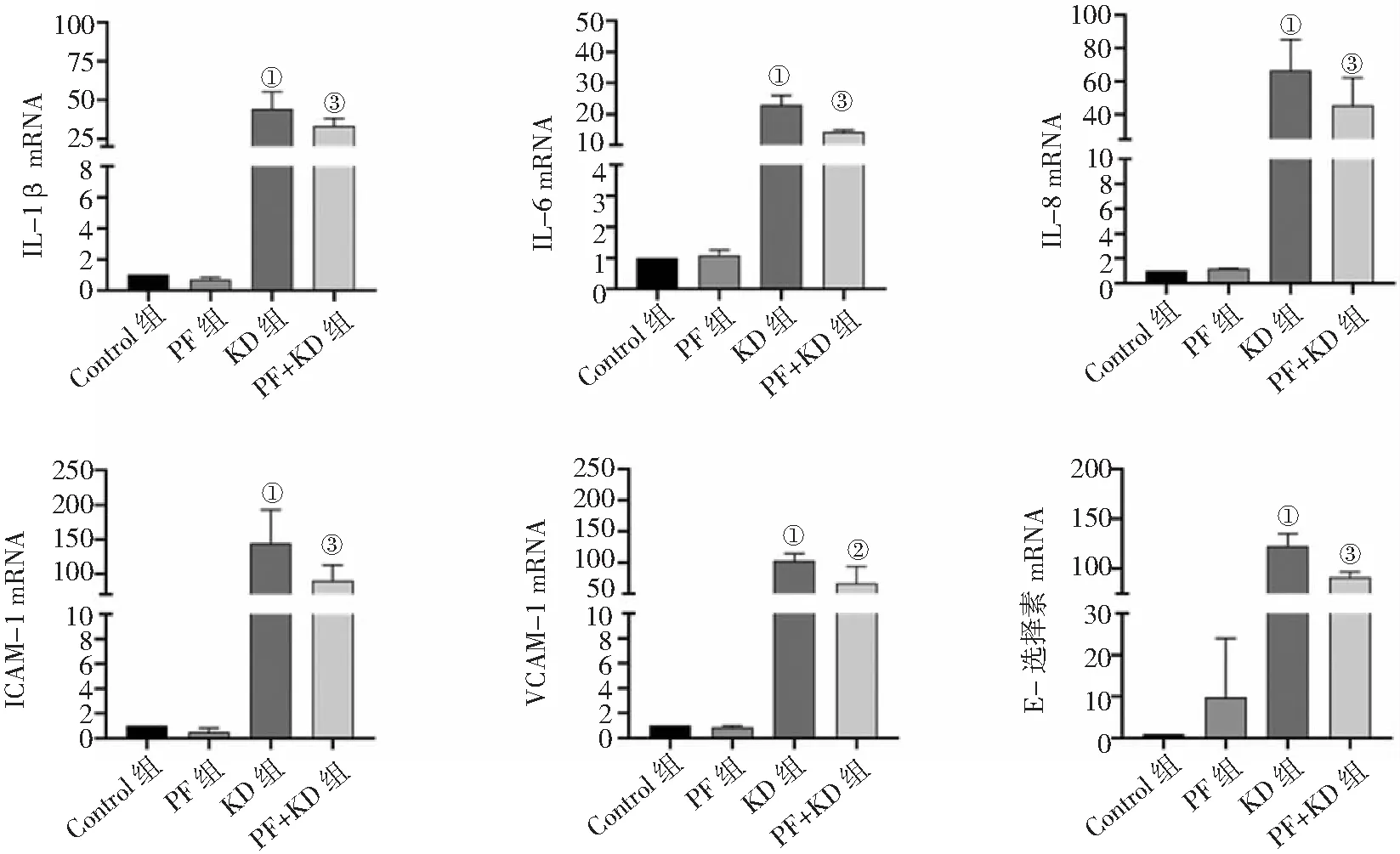
图3 PF对HCAECs细胞炎性因子及黏附分子mRNA表达的影响
2.4PF对HCAECs细胞IL-1β和IL-6蛋白表达的影响 与Control组比较,PF组IL-1β和IL-6蛋白表达差异无统计学意义(P>0.05),而KD组上述蛋白表达升高(P<0.01);与KD组比较,PF+KD组IL-1β和IL-6蛋白表达降低(P<0.01)。见图4。

图4 PF对HCAECs细胞IL-1β和IL-6蛋白表达的影响
2.5PF对HCAECs细胞Nrf2/HO-1和p-NF-κB信号通路蛋白表达的影响 与Control组比较,PF组Nrf2、HO-1、Keap1、p-NF-κB蛋白表达差异无统计学意义(P>0.05),而KD组Nrf2、HO-1蛋白表达明显降低(P<0.05),Keap1、p-NF-κB蛋白表达明显升高(P<0.05);与KD组比较,PF+KD组Nrf2、HO-1蛋白表达显著升高(P<0.01),Keap1、p-NF-κB蛋白表达显著降低(P<0.01)。见图5。

图5 PF对HCAECs细胞Nrf2/HO-1和p-NF-κB信号通路蛋白表达的影响
2.6PF对HCAECs细胞紧密连接蛋白ZO-1表达的影响 与Control组比较,PF组ZO-1蛋白表达差异无统计学意义(P>0.05),而KD组ZO-1蛋白表达明显降低(P<0.05);与KD组比较,PF+KD组ZO-1蛋白表达显著升高(P<0.05)。见图6。

图6 PF对HCAECs细胞ZO-1蛋白表达的影响
3 讨论
KD的病因及发病机制尚不明确,环境、免疫、遗传等均可导致其发生[8-10]。目前,多认为KD血管内皮细胞损伤和功能障碍与T淋巴细胞和B淋巴细胞介导的免疫应答及细胞因子级联放大效应密切相关。在KD急性期异常活化的免疫细胞释放大量的炎性介质和细胞因子可直接损伤血管内皮细胞,导致内皮细胞功能障碍。受损的内皮细胞在TNF-α等炎性介质的刺激下,引起细胞间黏附分子、内皮淋巴细胞间黏附分子等过表达,致使循环中活化的免疫细胞、血小板等向受损血管表面募集,引起更深层次血管壁的免疫损伤。其中,TNF-α作为KD最重要的促炎细胞因子,在体内和体外的不同研究中已证实可增加内皮细胞屏障的通透性[11],降低内皮细胞间紧密连接蛋白ZO-1的表达[12]。同时,研究也发现KD冠状动脉病变患儿血清中ZO-1水平较低[13],这意味着ZO-1可能参与了KD血管内皮损伤的发生和(或)发展。本研究采用TNF-α刺激HCAECs细胞,在体外建立KD血管内皮细胞损伤模型。
氧化应激通常是由氧化与抗氧化能力失衡引起的,ROS过量产生或抗氧化能力下降通常会引起氧化应激,导致严重的细胞损伤和(或)细胞凋亡[14]。此前报道称,TNF-α处理可诱导细胞ROS的产生[15]。升高的ROS激活典型的NF-κB途径,导致下游炎性因子的分泌。Nrf2是一种细胞内转录因子,原则上Nrf2可通过上调抗氧化能力来阻止TNF-α介导的NF-κB活化。然而NF-κB和Keap1的相互作用导致Nrf2-ARE通路被抑制[16]。还有学者发现,在慢性炎症过程中,Nrf2激活可使氧化还原平衡恢复,促进细胞修复并限制TNF-α诱导的ROS产生及炎症[17]。
目前,KD治疗主要采用静脉注射免疫球蛋白,但静脉注射免疫球蛋白对部分难治性病例作用有限,且免疫球蛋白价格昂贵。因此,积极寻找治疗KD的替代性或辅助性药物意义重大。PF是芍药的主要活性成分,是一种单帖苷类化合物[18-20]。以往对PF的研究表明,PF可通过改变多种核转录因子的表达或活性发挥生物学效应,如抑制在调节转录、炎性因子产生和细胞存活中起重要作用的NF-κB活化[21],抑制在癌症、炎症和免疫应答调节中具有有益作用的转录激活因子STAT3激活[22-23],减少在抗氧化、抗炎和抗凋亡中发挥重要作用的核转录因子Nrf2降解等[24-26]。本研究结果显示,PF可抑制TNF-α诱导HCAECs细胞Nrf2的降解和NF-κB的活化。
综上所述,PF可通过抑制氧化应激和炎症,减轻TNF-α诱导的KD血管内皮屏障功能损伤,这可能与PF激活Nrf2/HO-1和抑制NF-κB信号通路有关,本研究可为中药防治KD冠状动脉损伤提供新的理论依据。但本研究仅观察了PF对体外KD血管内皮细胞模型中氧化应激和炎症的影响,并未在动物实验中进行验证,后续将通过完善动物实验来验证该结论。
