甲状腺乳头状癌患者BRAF V600E突变与术后TSH抑制治疗达标所需L-T4剂量的关系
2022-11-27张洁任红臻郭艳英
张洁,任红臻,郭艳英
1新疆维吾尔自治区人民医院内分泌科新疆糖尿病临床医学研究中心,乌鲁木齐 830000;2新疆医科大学研究生学院
在过去十几年里,甲状腺肿瘤发病率大幅度上升[1]。接受甲状腺腺叶或全叶切除术的患者,术后需接受不同剂量的L-T4治疗以恢复正常的TSH水平并预防肿瘤复发。然而,L-T4治疗窗窄,且L-T4剂量受残存甲状腺功能、体质量、TSH目标值、胃肠道疾病、食物与药物等多因素的影响;另外,L-T4起始剂量需结合患者年龄和合并疾病情况进行调整,年轻患者可给予足量,老年或合并心血管疾病等患者给予L-T4时要慎重选择剂量。在临床实践中,TSH抑制不足或过度抑制现象经常发生[2],抑制过度会导致心血管及骨骼系统等多种不良反应。所以,合适的L-T4治疗剂量在甲状腺肿瘤术后管理中起重要作用[3]。目前临床上根据2015年美国甲状腺协会(ATA)指南中甲状腺癌复发风险分层制订术后TSH初始控制目标,结合患者个体情况调整L-T4剂量[4]。BRAF V600E突变是甲状腺肿瘤患者最常见的基因突变[5]。多项研究表明,BRAF V600E突变与甲状腺乳头状癌的侵袭性密切相关,并且是甲状腺乳头状癌复发和不良预后的预测指标[6-8]。对于BRAF V600E突变状态是否影响甲状腺乳头状癌患者术后TSH抑制治疗达标所需L-T4的剂量,目前尚不明确。为此,本研究分析了甲状腺乳头状癌患者BRAF V600E突变与术后TSH抑制治疗达标所需L-T4剂量的关系,为L-T4个体化治疗提供参考。
1 资料与方法
1.1 研究对象选择2018年1月—2019年8月收治的甲状腺乳头状癌患者291例进入研究。患者男75例、女216例;年龄22~82(46.26±9.49)岁;接受甲状腺全切或腺叶切除术;术后遵医嘱,清晨空腹顿服L-T4;根据ATA指南,复发风险分层为低危76例、中危215例;术后随访6~36个月,随访期间无肿瘤复发病例。排除既往有甲状腺疾病史、有甲状腺癌家族史、有服用甲状腺相关药物史者,资料不全的患者。
1.2 BRAF V600E基因突变检测及分组情况采用实时荧光PCR法检测BRAF基因突变情况。根据是否合并BRAF V600E突变,将291例患者分为突变组240例、对照组51例。两组患者一般资料比较见表1。<55岁患者中,合并突变者比例低于无突变者;≥55岁患者中,合并突变者比例高于无突变者(P均<0.05)。
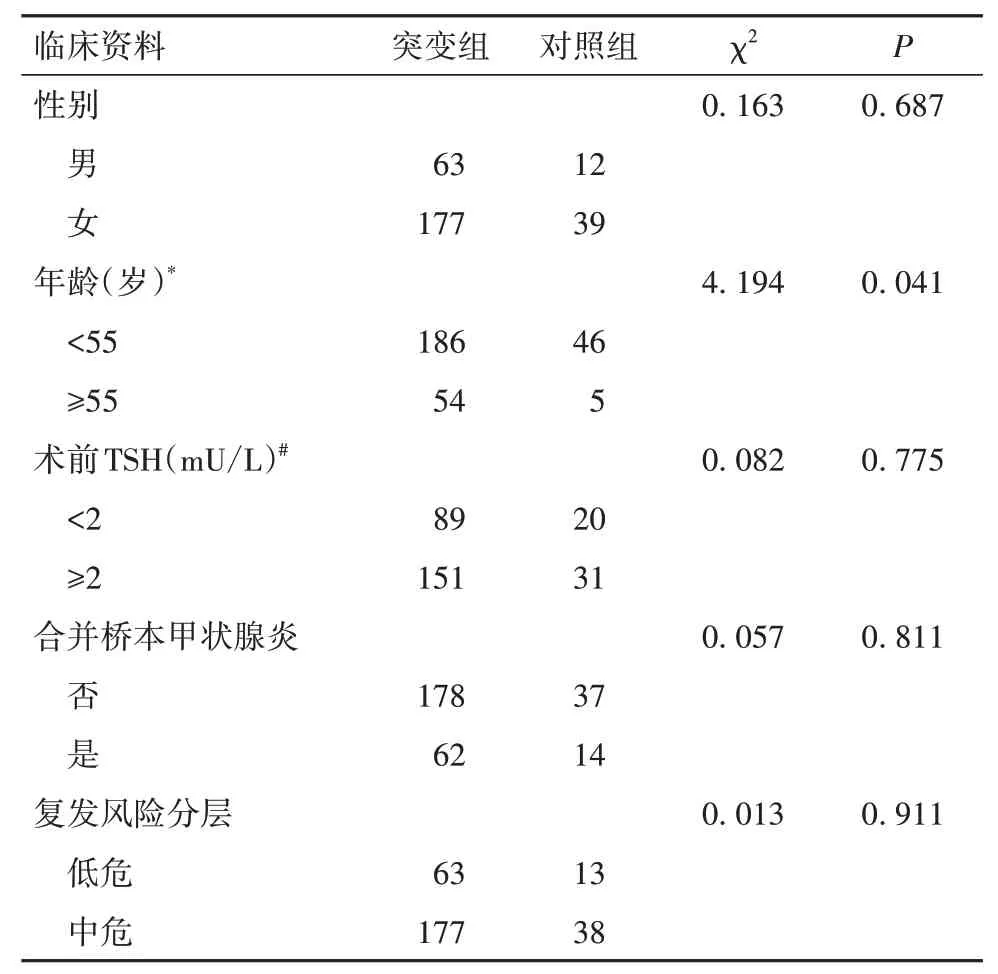
表1 两组患者一般资料比较(例)
1.3 术后治疗情况及L-T4剂量统计术后根据患者手术方式及病情严重程度给予L-T4治疗,定期监测甲状腺功能,根据病情变化调整治疗剂量。依据ATA指南,对于复发低危患者,不论是否已行131I治疗,TSH控制在0.5~2.0 mU/L;对于腺叶切除患者,TSH控制在0.5~2.0 mU/L;对于复发中危患者,TSH控制在0.1~0.5 mU/L。复发低危患者TSH<2 mU/L即为达标,复发中危患者TSH<0.5 mU/L即为达标。记录L-T4治疗剂量。
1.4 统计学方法 采用SPSS26.0统计软件。计数资料采用频数表示,采用χ2检验。服从正态分布的计量资料以±s表示,两组比较采用t检验。L-T4剂量的影响因素采用多元线性逐步回归分析法进行分析,若纳入影响因素中含有二分类变量,则在赋值后直接纳入模型。P<0.05为差异有统计学意义。
2 结果
2.1 不同BRAF V600E突变情况患者TSH抑制治疗达标时L-T4剂量比较突变组、对照组TSH抑制治疗达标时L-T4剂量分别为1.44±0.38、1.36±0.42μg/(kg·d),两组差异无统计学意义(P>0.05)。复发低危患者中,合并突变者、无突变者治疗达标时L-T4剂量分别为(1.32±0.45)、(1.02±0.30)μg/(kg·d);复发中危患者中,合并突变者、无突变者治疗达标时L-T4剂量分别为(1.56±0.30)、(1.41±0.45)μg/(kg·d)。复发中危患者中,合并突变者TSH抑制治疗达标时L-T4剂量高于无突变者(P<0.05)。
2.2 BRAF V600E突变与术后TSH抑制治疗达标所需L-T4剂量的关系291例患者中,复发低危者有61例治疗达标,复发中危者有98例治疗达标。以L-T4剂量为因变量,BRAF V600E突变情况、性别、年龄、术前TSH水平、桥本甲状腺炎、复发风险分层为自变量,进行多元线性逐步回归分析。自变量中二分类变量赋值:无BRAF V600E突变=0,BRAF V600E突变=1;性别女=0,男=1;桥本甲状腺炎否=0,是=1;复发风险分层中危=0,低危=1。P≤0.05为纳入方程标准,P≥0.10为排除方程标准。最终BRAF V600E突变、复发风险分层进入方程。回归分析结果显示,BRAF V600E突变、复发风险分层是TSH抑制治疗达标时L-T4剂量的影响因素。BRAF V600E突变的影响程度高于复发风险分层。见表2。
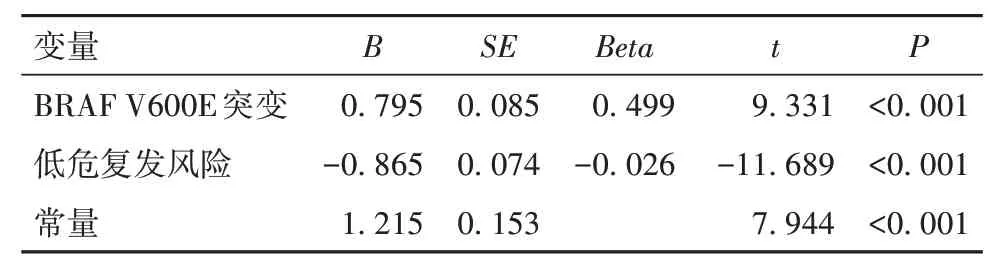
表2 TSH抑制治疗达标时L-T4剂量的影响因素
3 讨论
行甲状腺乳头状癌全叶切除或腺叶切除术的患者术后需接受TSH抑制治疗。TSH抑制过度即L-T4治疗剂量过量,将会导致骨质疏松、冠心病和缺血性卒中等发生风险增高[10-11]。然而,L-T4治疗剂量不足将会增加甲状腺癌患者复发风险,并且降低患者生存率[12]。另外,L-T4剂量易受残存甲状腺功能、体质量等多种因素的影响。BRAF V600E突变是甲状腺乳头状癌患者最常见的突变[13],本研究结果与之一致。多项研究报道,BRAF V600E突变与甲状腺乳头状癌的临床病理参数及复发风险密切相关[14]。为平衡肿瘤抑制过度的不良反应和复发风险,L-T4治疗剂量是否要考虑到BRAF V600E突变状态,这是本研究的主要目的。
TSH抑制治疗是甲状腺肿瘤术后标准的治疗流程,甲状腺肿瘤的复发、转移与TSH抑制水平密切相 关[15]。2015年ATA指南评估复发危险分级和TSH抑制治疗的不良反应,制定了TSH的抑制目标:建议复发低危患者TSH控制在0.5~2 mU/L,复发中危患者TSH控制在0.1~0.5 mU/L,复发高危患者TSH应<0.1 mU/L[16]。然而由于L-T4剂量治疗窗窄,且易受多种因素的影响,所以精确的给药剂量至关重要,要达到治疗目标需全方面、多角度衡量。本研究结果显示,患者复发风险分层、BRAF V600E突变状态与L-T4剂量密切相关,且BRAF V600E突变的影响程度高于复发风险分层,剩余的影响因素可能还有胃肠道疾病、食物与药物、L-T4制剂质量等[2,17-18]。然而是否还存在其他相关因素,还有待多中心、大样本量的研究证实。
随着患者年龄增长,所需要的L-T4剂量减少。中国甲状腺疾病诊治指南提出,老年患者达到TSH抑制目标水平的L-T4剂量较年轻患者低20%~30%。这是因为老年患者口服吸收率大于自身甲状腺激素外周降解速度,同时考虑到TSH抑制过度的不良反应,对于老年患者,L-T4治疗剂量要酌情降低[4]。本研究中,多重线性回归分析结果显示,年龄并非TSH抑制治疗达标时L-T4剂量的影响因素,考虑与本研究纳入人群平均年龄为(46.26±9.49)岁、年龄差别不大有关。但根据第8版AJCC癌症分期手册年龄风险分层,本研究中年龄≥55岁的患者合并BRAF V600E突变比例更高。在本研究多元逐步线性回归分析中发现,BRAF V600E突变是TSH治疗达标所需L-T4剂量的影响因素之一,所以对于合并BRAF V600E突变的老年患者,既要考虑年龄这一影响因素,还要兼顾BRAF V600E突变情况,综合考虑各方面因素,制定个体化治疗方案。
对于BRAF V600E突变与L-T4治疗剂量的相关性分析,既往少有文献报道。本研究选取甲状腺腺叶或全叶切除手术后行L-T4治疗的患者,分别比较复发低危、中危患者TSH抑制治疗达标时BRAF V600E突变组与对照组的L-T4治疗剂量,结果显示,复发中危患者中,BRAF V600E突变者比无突变者所需L-T4剂量增高。有研究发现,在甲状腺乳头状癌患者中,合并BRAF V600E突变者促甲状腺激素受体(TSHR)表达水平明显低于无突变者[19]。TSHR可识别垂体分泌的TSH,并与之特异性结合。BRAF V600E突变可导致TSH受体基因甲基化,使基因表达沉默,引起甲状腺素生成不足,从而导致TSH水平升高[20]。TSH是甲状腺生长因子,其具有促进甲状腺滤泡上皮细胞增殖的能力,当TSH与甲状腺滤泡上皮细胞上的受体结合时,可刺激分化型甲状腺癌患者肿瘤细胞恶性生长[21]。有研究显示,术前TSH≥2.0 mU/L是TSH抑制不足的危险因素[9]。最近国外一项研究也认为,术前TSH水平较高者术后需要补充甲状腺激素的可能性显著增加[22]。甲状腺癌术后患者TSH抑制不足,所需要的L-T4剂量就会更多,这在一定程度上解释了本研究的结果。另外,还有研究显示,BRAF V600E突变组患者血清TSH水平显著高于对照组[23]。
综上所述,对于复发风险为中危的甲状腺乳头状癌术后患者,合并BRAF V600E突变者较无BRAF V600E突变者在TSH抑制治疗达标时需要更高剂量的L-T4。影响L-T4治疗剂量的因素是多方面的,因此,对于甲状腺乳头状癌术后TSH抑制治疗,需要综合衡量,制订更为完善的L-T4个体化治疗方案。然而,本研究样本量较少,未纳入复发高危的甲状腺癌患者,以上结论仍需要大样本量、多中心的前瞻性研究进一步证实。
