基于模型认知的高中化学复习教学实践与探索
——以“电化学三个基础考点的复习”教学为例
2022-11-27广西师范大学附属中学541213刘达富
广西师范大学附属中学(541213)刘达富
一、问题的提出
高考是选拔性考试,能力考查是高考永恒的主题。认真分析高考试题不难发现,无论是全国卷还是地方卷,在突出学科核心素养考查和选拔性功能的同时,保持了基础性、稳定性和能力性的特点,一些典型的基础性试题更是频繁出现在高考试题中,年年考查但常考常新。针对这些高考化学的典型试题,如何让学生能够快速并正确规范地答题,是每一位高中化学教师需要思考的问题。在一些高三复习教学中,囿于复习方式方法的陈旧以及个人能力不足或是对复习教学的不重视,教师多是就题论题,对知识和解题方法没有拓展和延伸,也没有归纳和总结。这样的复习教学带来的后果是学生在课堂上似乎听懂了,也掌握了知识,但当问题稍作变通就不会应对了,学生不能形成良好的认知结构,学科核心素养也得不到发展。
《普通高中化学课程标准(2017 年版2020 年修订)》在描述化学学科核心素养时指出:“知道可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。”“能运用多种认知模型来描述和解释物质的结构、性质和变化,预测物质及其变化的可能结果;能依据物质及其变化的信息建构模型,建立解决复杂化学问题思维框架。”[1]本教学研究正是基于模型认知建构问题解决模型,旨在帮助学生对“大概念”建立系统认识,发展学生的系统思维,更好地提升学生的化学认知水平。只有在复习教学中积极引导学生建构问题解决模型,使学生掌握的知识系统化、条理化,并相互关联形成有机整体,才能提升学生在新情境中的知识迁移能力。因此,教师在高中化学复习教学中要高度重视典型试题的答题建模,充分认识答题建模对于发展学生化学学科核心素养的重要性。
本文以“电化学三个基础考点的复习”教学为例,探讨如何基于典型高考试题进行答题建模教学设计并加以实施。
二、电化学的定位、考查方式
(一)电化学在课程标准中的定位
在高中化学中,“电化学”的有关内容主要分布在必修课程主题3“物质结构基础与化学反应规律”[2]和选择性必修课程模块1“化学反应原理”[3]。必修课程主题3 只简单要求“以原电池为例认识化学能可以转化为电能,并能从氧化还原反应角度初步认识原电池的工作原理”。选择性必修课程模块1 中的主题1“化学反应与能量”是对必修课程相应内容的深化与拓展。《普通高中化学课程标准(2017年版2020 年修订)》要求:“认识化学能与电能相互转化的实际意义及其重要应用。了解原电池及常见化学电源的工作原理。了解电解池的工作原理,认识电解在实现物质转化和储存能量中的具体应用。”[1]选择性必修课程是升学考试要求选择修习的课程,因此高三复习教学目标的制订应基于课程标准对“选择性必修”的要求之上。
(二)电化学在高考中的考查方式
有关“电化学”方面的考题是现行高考中的高频题型,即典型题。高考试题中关于“电化学”的考查主要有如下几个方面:原电池和电解池的构成、电子(流)和离子的运动方向、电极的判断、电极上的反应类型判断、电解质溶液组成变化判断、电极方程式和电池总方程式的书写、简单的原电池与电解池的设计、二次电池和新型电池的认识与应用、电解的应用和简单计算、电解的规律和离子交换膜的作用等。试题呈现的方式多为选择题或填空题。
三、本教学研究的根本任务
高中化学中的“电化学”内容从必修课程螺旋式上升至选择性必修课程,涉及各类判断、各种书写、设计应用和简单计算,概念多、规律复杂,且原电池与电解池的工作原理容易相互混淆。学生要理解电化学核心知识的内涵,就应围绕核心知识建立知识体系,形成系统的认知模型。设计基于学生模型认知核心素养的典型题答题建模教学可提高课堂教学的有效性,发展学生的学科核心素养。因此,本教学研究的根本任务是:(1)构建电化学各概念之间相互关系的认知模型和书写电极方程式的方法模型;(2)通过电化学典型题的答题建模进一步发展学生的模型认知核心素养;(3)设计与实施基于模型认知的电化学典型题答题建模教学,并检验应用模型解题的效果。
四、教学设计
(一)教学流程
根据上述教学任务设计如下教学流程(见表1)。
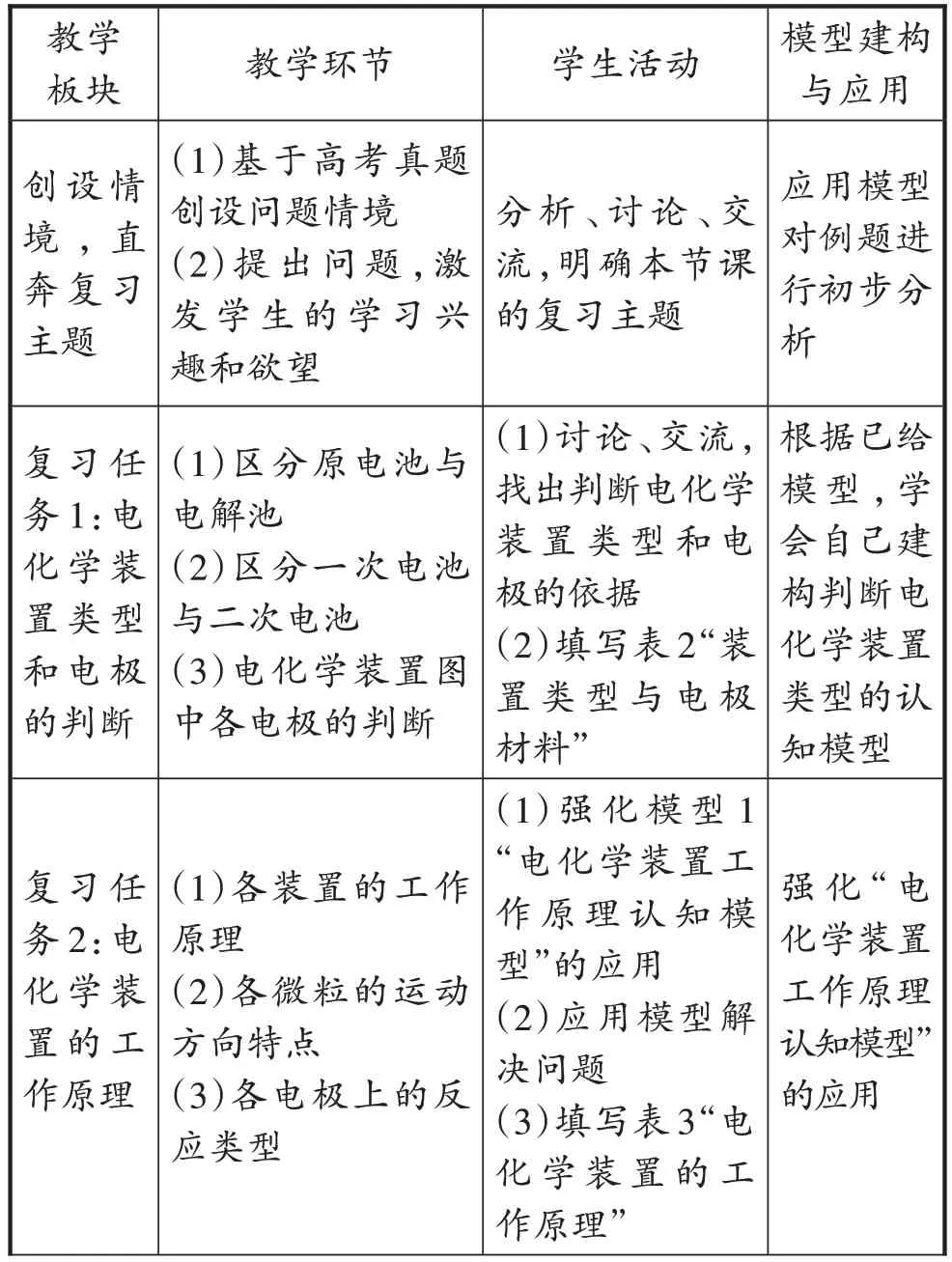
表1 教学流程
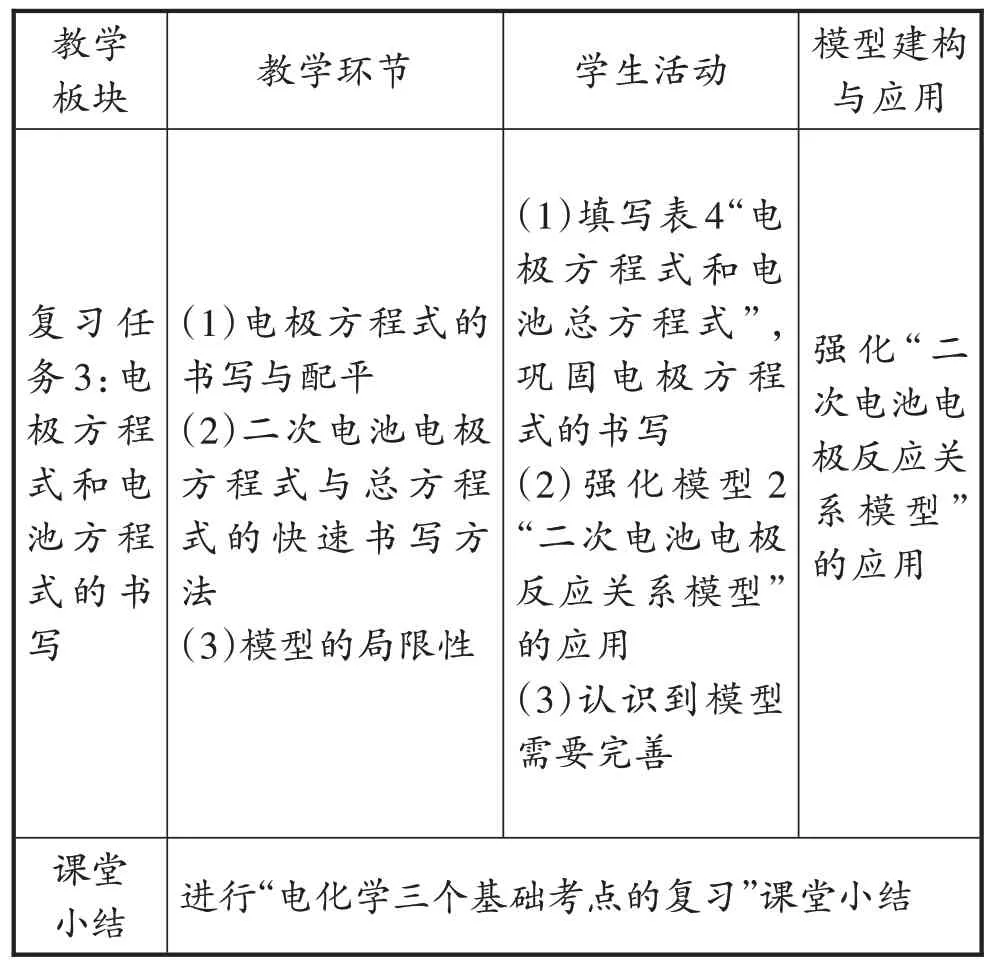
续表
(二)建构认知模型
电化学装置是建立在氧化还原反应基础上的能量转换装置,其中有很多概念之间看似相互矛盾,实则相互依存、互有联系。因此,首先建构概念之间相互联系的认知模型,有助于学生理解电化学装置的工作原理,提高学生的解题能力。图1 把电化学的两个分支“原电池”和“电解池”总结在一个模型图中,按照“离子流向→电极名称→反应物质→电子得失→反应类型→电极产物”的顺序连成两条概念关系链,帮助学生建立概念之间的系统认识。该模型(模型1)不仅体现了概念之间的关系,还有助于电极方程式的书写:负极(阳极)的电极方程式是“还原剂”与“氧化产物”之间的相互转化关系;正极(阴极)的电极方程式是“氧化剂”与“还原产物”之间的相互转化关系,只要找到相应物质,再结合有关信息配平就能得出电极方程式。

图1 电化学装置工作原理认知模型
对于可充电的二次电池,其充电与放电时电极反应之间存在的相互关系如图2 所示(二次电池电极反应关系模型,即模型2)。二次电池放电时负极反应与充电时的阴极反应虽然不是可逆反应,但两反应式互为“可逆”,由此可快速书写电极方程式和总方程式,强化学生对电极方程式的书写能力。
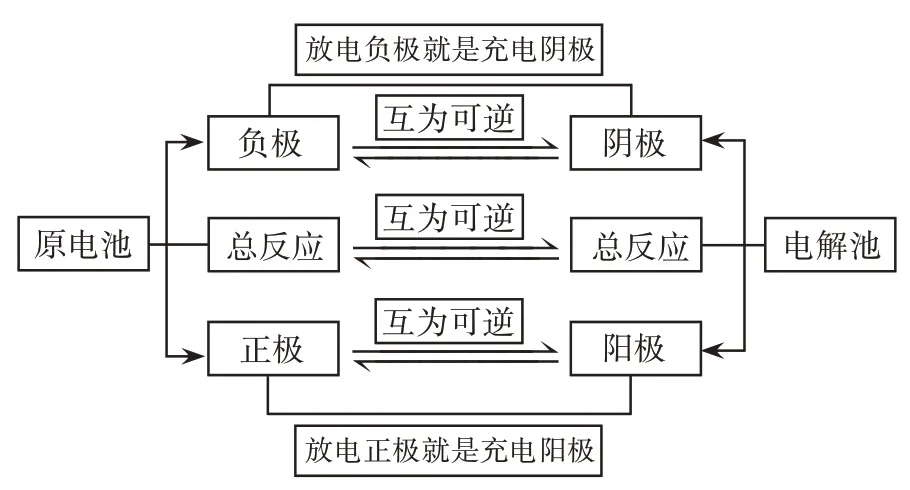
图2 二次电池电极反应关系模型
五、教学过程
[展示高考题]请看学案,电化学装置图及相关信息如下:
(1)(2020 年高考全国Ⅰ卷第12 题改编)图3为一种新型Zn−CO2水介质电池,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸。
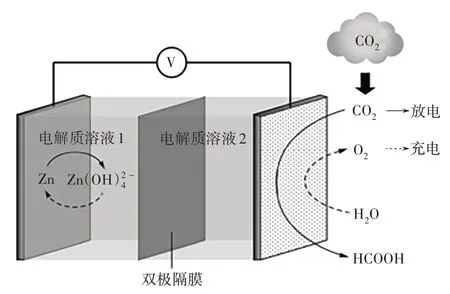
图3 Zn-CO2水介质电池
(2)(2021 年高考全国甲卷第13 题改编)图4为合成乙醛酸电化学装置,图中的双极膜中间层中的H2O解离为H+和OH−,并在直流电场的作用下分别向两极迁移。
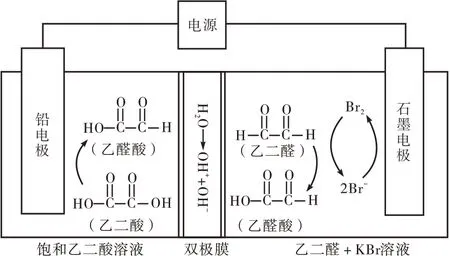
图4 合成乙醛酸的电化学装置
(3)(2018 年高考全国Ⅲ卷第11 题改编)图5为一种可充电锂−空气电池,当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2−x(x=0或1)。
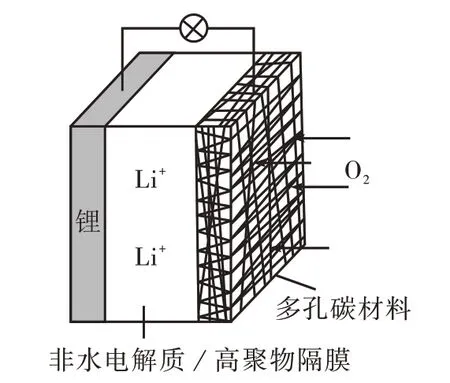
图5 可充电锂-空气电池
教师:这些是高考中常见的电化学考题的部分题干。题中提到的装置各属于电化学中的哪一类装置?各电极名称是什么?涉及哪些电化学原理?如何书写电极方程式和总方程式?
学生读题析图,相互分析、讨论和交流。
设计意图:开门见山,直奔复习主题;通过高考真题创设问题情境,激发学生的学习兴趣和欲望。
[复习任务1]电化学装置类型和电极的判断。
教师:上述考题中的各装置分别属于原电池和电解池中的哪一类?
学生:图3和图5属于原电池,图4属于电解池。
教师:图3和图5属于一次电池还是二次电池?图4为什么是电解池?
学生:图3和图5都属于二次电池;图4有外接电源,因此是电解池。
教师:如果图4 中没有外接电源,会构成原电池吗?
学生:不会,因为相关反应不能自发进行。
教师:判断电化学装置类型的依据还有什么?两类装置有什么共同点和不同点?类比图1 和图2,你能否以电池构成特点为基础建构判断电化学装置类型的认知模型,以便于理解和记忆呢?
学生小组讨论分析,建构判断电化学装置类型的认知模型(见图6)。
图6 判断电化学装置类型的认知模型
教师:根据图1 的认知模型,能得出电化学装置中各电极材料与电极名称有怎样的对应关系?
学生:由图1 的认知模型和图2 的关系模型可知发生氧化反应的电极为负极或阳极,由此得出图3 中的锌电极和图5 中的锂电极放电时为负极(充电时为阴极),图4 中的石墨电极为阳极;同时可知发生还原反应的电极为正极或阴极,由此得出图3中的选择性催化材料和图5 中的多孔碳材料放电时为正极(充电时为阳极),图4 中的铅电极为阴极。
教师:请大家根据讨论填写学案上的装置类型与电极材料表。
学生填写学案上的装置类型与电极材料表。
教师展示部分学生的填写结果,指出存在的问题并展示正确答案(见表2)。
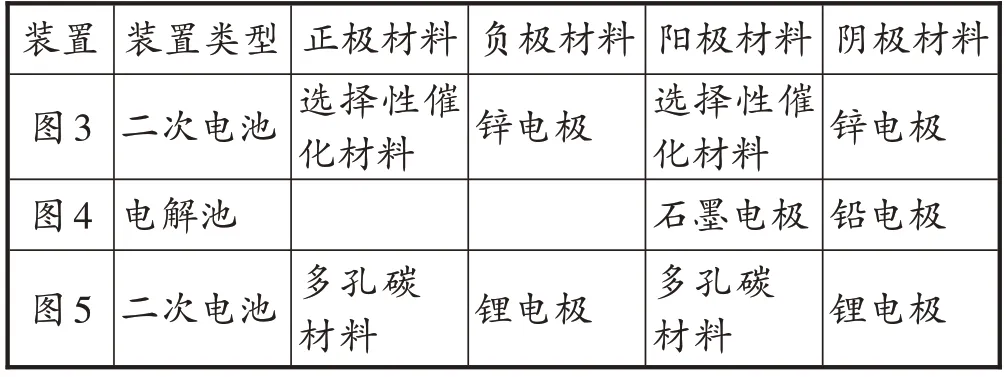
表2 装置类型与电极材料
设计意图:通过对高考真题中的电化学装置图的分析,让学生应用认知模型来快速判断电化学装置中的电极,体会认知模型的重要性,强化认知模型在解题中的应用;创设思维活动,让学生自己建构判断电化学装置类型的认知模型,培养学生的模型认知核心素养。
教师:你能判断图7 装置的类型和说出各电极的名称吗?
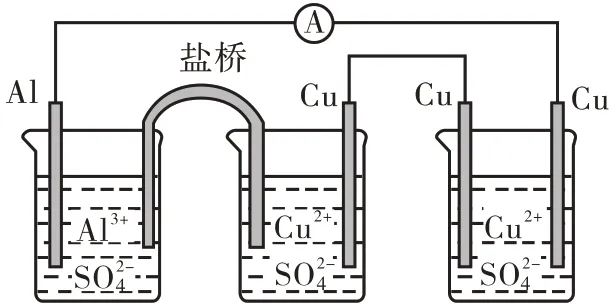
图7 电化学装置图
学生:根据图6 的认知模型中“有自发进行的氧化还原反应”可知,装置的前两个部分构成了带盐桥的原电池,最后的部分为电解池;Al 电极为负极,Cu电极从左到右分别为正极、阳极、阴极。
教师:如果把“双液”原电池中的“盐桥”换成“铝条”,又该如何判断?
学生:中间部分为原电池,另两个部分构成电解池;整套装置从左到右电极分别为阳极、阴极、负极、正极、阳极、阴极。
设计意图:对于没有明显外接电源的串联装置,必须综合分析找出电源,才能判断其装置类型并确定电极名称。让学生在应用中熟练掌握认知模型并进一步强化模型的应用。
[复习任务2]电化学装置的工作原理。
电化学装置的工作原理涉及电子的流向、电流的流向、阴阳离子的运动方向和各电极的反应类型等。对于如何快速做出正确判断,建构认知模型是解决这一问题的有效方法。
教师:电化学装置的工作原理如何?各微粒的运动方向怎样?各电极上的反应类型是什么?请根据图1 的认知模型填写学案上的电化学装置的工作原理表。
学生分组讨论,填写学案上的电化学装置的工作原理表并展示填写结果(见表3)。
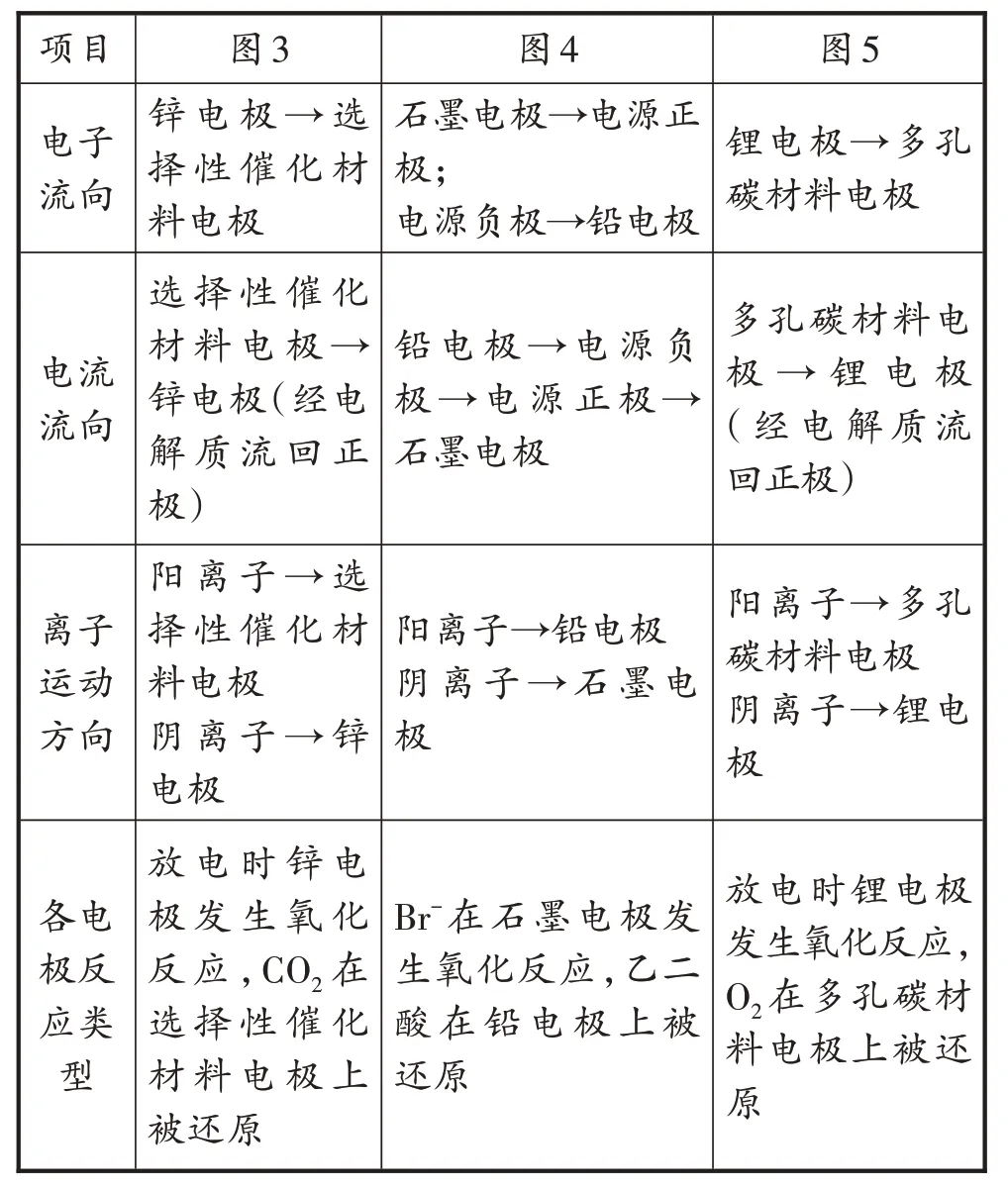
表3 电化学装置的工作原理
教师:请根据认知模型和所填表格,小结电化学装置的工作原理。
学生1:外电路中电子的流动方向与电流的方向相反。
学生2:电解质溶液中阳离子移向正极或阴极,阴离子移向负极或阳极。
学生3:电子只走外电路,离子只在内电路迁移。
学生4:氧化性强的微粒在正极或阴极获得电子,生成还原产物;还原性强的物质在负极或阳极失去电子,生成氧化产物。
设计意图:通过讨论交流和表格填写,使学生对电化学装置的工作原理有更深入的理解,厘清电化学原理中各概念之间的相互关系。
[复习任务3]电极方程式和电池总方程式的书写。
教师:知道了各电极上发生反应的物质,那电极方程式和电池总方程式该如何书写呢?
学生分组讨论,填写学案上的电极方程式和电池总方程式表并展示填写结果(见表4)。

表4 电极方程式和电池总方程式
教师:大家是如何快速书写电极方程式和电池总方程式的?
学生1:负极(阳极)的电极方程式是“还原剂”与“氧化产物”之间的相互转化关系;正极(阴极)的电极方程式是“氧化剂”与“还原产物”之间的相互转化关系,只要找到相应物质,再结合有关信息配平就可得出电极方程式。
学生2:根据电子得失守恒、电荷守恒、元素守恒和电解质环境等综合因素进行配平。
学生3:电池总方程式可根据负极(阳极)的电极方程式与正极(阴极)的电极方程式在电子得失数相等的情况下相加得到。
教师:根据“二次电池电极反应关系模型”可以更加快速地书写充放电时的电极方程式和电池总方程式,由例题中图5 在充放电时的电极方程式和总方程式可得出什么?
学生4:负极与阴极互为“可逆”,正极与阳极互为“可逆”,充电与放电的总反应也互为“可逆”,与模型描述的一致。
教师:再看看大家所写的例题中图3 在充放电时的电极方程式和总方程式,从中可发现什么?
学生5:负极与阴极互为“可逆”,正极与阳极、充放电时的总反应不再互为“可逆”。
学生6:例题图3 中选择性催化材料电极上放电时是CO2变为HCOOH,充电时是H2O 变为O2,这是实验事实,我们必须尊重实验事实。
教师:这说明我们建立的认知模型存在不完善的地方,它适用于大部分的二次电池电极方程式的快速书写,但特殊情况下必须尊重实验事实。
设计意图:通过电极方程式和电池总方程式的书写,使学生掌握书写电化学方程式的步骤、配平的方法和书写过程中的注意事项,特别要强化学生应用模型快速书写电极方程式和电池总方程式的思维认知,提高学生的解题能力。
[课堂小结]归纳小结所学内容(见图8)。
图8 课堂小结
六、教学反思
高三复习教学不同于新课教学,其目的在于让学生巩固知识、掌握方法和提升能力。本教学设计立足于高三化学复习教学,以高考真题为情境素材,聚焦高考真题的三大基础考点来创设学习任务,通过归纳、小结和提炼,在巩固学生基础知识的同时引导学生建构认知模型,使学生对知识的结构和问题的本质产生深刻认识,形成分析问题和解决问题的思维模型。
本教学设计中的三大复习任务是电化学中最为基础的内容,也是最常见的考点。教学中系列问题逐级递进,为模型的建构和应用搭建了较好的平台,而模型的建构和应用有力地促进了学生认知思维模式的形成,提升了学生的模型认知核心素养。整个教学过程充分尊重学生的主体地位,学生参与度高;不仅教会学生化学学习的方法,还培养了学生的关键能力。
当然,本教学设计还有需要进一步改进的地方。一是可以尝试完全由学生自己建构模型。如果在典型题的解题过程中完全由学生自己提炼和建构解题思维模型,也许教学效果会更好。二是试题设计的设问深度或真题变式广度有待进一步提高,以便强化优秀生的思维训练。如对高考真题情境素材进行改编,融入更多的新型电池、特殊电池和电解池,以提高试题的灵活性和深广度。三是模型的建构需要完善,题后小结与诊断还有待进一步加强。这些将在后续教学中不断地改进和完善。
