苯炔参与喹啉衍生物去芳构化反应及抑菌活性研究
2022-11-25骈继鑫李丽丹陈晴晴
骈继鑫,李丽丹,凌 伟,陈晴晴*
(1.新疆第二医学院,新疆 克拉玛依 834000;2.哈密市特种设备检验检测所,新疆 哈密 839000)
含氮杂环骨架广泛存在于天然化合物和药物分子中。其中,氢化喹啉(或异喹啉)衍生物(图1)具有抗氧化、抗病毒和抗菌等生物活性[1],其合成一直是有机化学研究的热点[2-7]。芳香化合物是一种重要的基础化工原料,具有种类多样、结构丰富等特点,芳香化合物的去芳构化反应是合成氢化喹啉(或异喹啉)衍生物的重要途径之一。由于该类反应是将稳定的二维平面分子转化为三维立体且官能团化的分子,需要克服去芳构化的能垒,具有一定的挑战性。
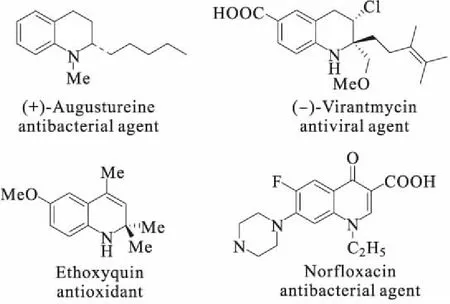
图1 氢化喹啉(或异喹啉)衍生物的结构式Fig.1 Structural formulas of hydrogenated quinoline(or isoquinoline) derivatives
苯炔是一种非常活泼的化合物,在常态下不易存在。直到1983年,Kobayashi苯炔前体[2-(三甲基甲硅烷基)苯基三氟甲磺酸酯][8]出现后,苯炔开始被广泛应用于有机合成中。近年来,苯炔被巧妙地应用于氢化喹啉(或异喹啉)衍生物的合成[9-19]。
基于此,作者以不同取代的Kobayashi苯炔前体参与2-乙酰亚甲基喹啉的去芳构化,保持氮杂环中碳原子的构型不变,仅使氮原子杂化类型由sp2转变为sp3;并对其抑菌活性进行评价,为喹啉类衍生物的去芳构化反应提供新途径及去芳构化喹啉衍生物在医药领域的应用提供一定依据。
1 实验
1.1 材料、试剂与仪器
大肠杆菌(ATCC 25922),金黄色葡萄球菌(ATCC 29213)。
200~300目柱层析硅胶、GF254型薄层色谱板,青岛海洋化工厂;LB肉汤培养基(A507002)、琼脂粉(A505255-0250),生工生物;所用试剂均为分析纯,Adamas。
Bruker DMX 400MHz型核磁共振波谱仪;Q Exactive型高分辨质谱仪,Thermo Scientific;HVE-50型高温高压蒸汽灭菌锅,Hirayama;SPARK 10M型多功能酶标仪,瑞士TECAN;SW-CJ-2FD型洁净工作台,苏净安泰;Crystal IS-RDV1型恒温振荡器,美国精骐;ZXDP-B2160型电热恒温培养箱,上海智城;FA2004型电子分析天平,常州幸运。
1.2 合成方法
以目标化合物Ⅲa的合成(图2)为例。将37.1 mg(0.2 mmol)2-乙酰亚甲基喹啉(Ⅱa)、91 mg(0.6 mmol)氟化铯(CsF) 和2 mL乙腈依次加入10 mL反应管中,磁力搅拌,逐滴加入72.8 μL(0.3 mmol)Kobayashi苯炔前体(Ⅰa),采用薄层色谱法(TLC)监测反应进程,反应完毕后,经柱层析分离纯化(洗脱剂V石油醚∶V乙酸乙酯= 10∶1),得到黄色油状目标化合物Ⅲa。

图2 目标化合物Ⅲa的合成路线Fig.2 Synthetic route of target compound Ⅲa
1.3 抑菌实验
将样品置于紫外灯下照射30 min灭菌,然后用二甲基亚砜(DMSO)配制成浓度为1 mg·mL-1的样品溶液,现配现用。
用PBS缓冲液将菌液稀释至浓度1×106CFU·mL-1,取100 μL稀释菌液均匀涂布于LB固体培养基上。用无菌打孔器在平板上均匀打3个孔,将无菌牛津杯放入打好的孔中,加入200 μL样品溶液;将平板水平转移至4 ℃冰箱,静置使样品预扩散2 h,然后将培养皿置于37 ℃恒温培养箱中培养24 h,取出拍照,并测量抑菌圈直径。
2 结果与讨论
2.1 合成条件优化
以Kobayashi苯炔前体(Ⅰa)和2-乙酰亚甲基喹啉(Ⅱa)为底物合成目标化合物Ⅲa作为模型反应,考察溶剂、氟离子源等对目标化合物Ⅲa产率的影响,结果见表1。
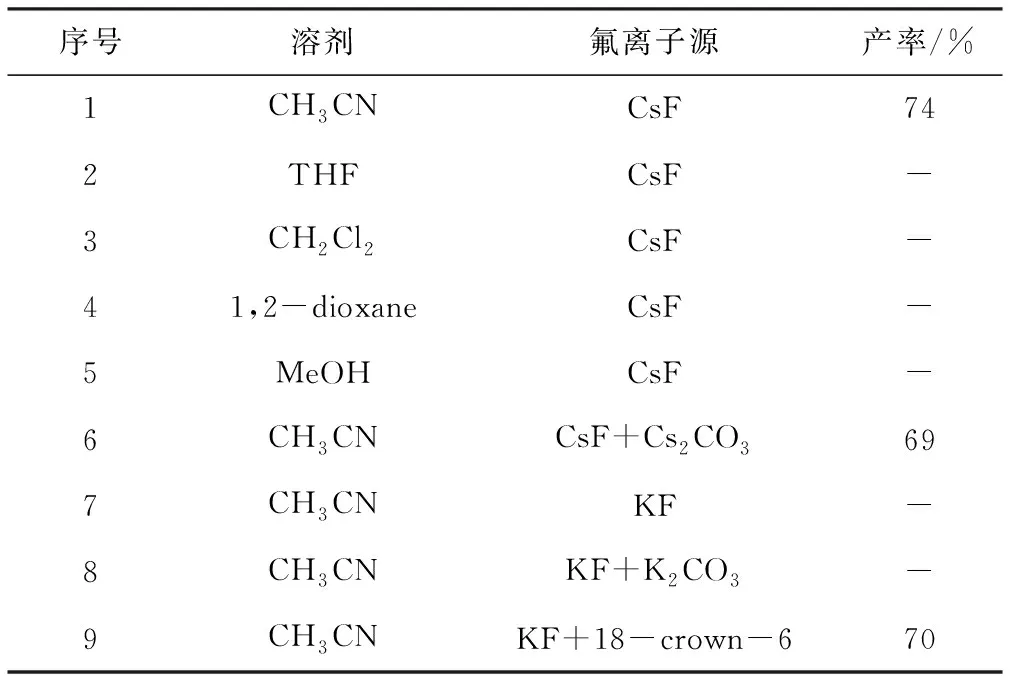
表1 合成条件优化Tab.1 Optimization in synthetic conditions
反应条件:化合物Ⅰa用量0.3 mmol,化合物Ⅱa用量0.2 mmol,氟离子源用量0.6 mmol,溶剂用量2 mL,室温反应;产率为分离产率;“-”表示未检测到目标化合物Ⅲa。
由表1可知:(1)以CsF为氟离子源,固定其它条件不变,考察溶剂对目标化合物Ⅲa产率的影响,发现以乙腈为溶剂时,产率达到74%,而分别以四氢呋喃、二氯甲烷、1,2-二氧六环为溶剂时,均未生成目标化合物Ⅲa。(2)以乙腈为溶剂,固定其它条件不变,考察氟离子源对目标化合物Ⅲa产率的影响,发现在CsF中添加Cs2CO3时,产率略微降低(69%);当以KF或KF+K2CO3为氟离子源时,均未生成目标化合物Ⅲa,可能是由于,溶剂中的氟离子不足以促使苯炔原位生成,进而影响去芳构化反应进行;当以KF+18-crown-6为氟离子源时,产率达到70%。
综上,确定目标化合物Ⅲa的最佳合成条件为:溶剂为乙腈、氟离子源为CsF、室温反应。
2.2 反应底物的拓展
以不同取代的Kobayashi苯炔前体与2-乙酰亚甲基喹啉为原料,按1.2方法进行去芳构化反应,结果见图3。

图3 不同取代的Kobayashi苯炔前体与2-乙酰亚甲基喹啉的去芳构化反应Fig.3 Dearomatization of Kobayashi benzyne precursors with different substitutions and 2-acetylmethylene quinoline
由图3可知,不同取代的Kobayashi苯炔前体(Ⅰa~Ⅰf)与2-乙酰亚甲基喹啉(Ⅱa)均能进行去芳构化反应得到目标化合物(Ⅲa~Ⅲf);当以氟取代的Kobayashi苯炔前体(Ⅰf)为底物时,目标化合物Ⅲf的产率相对较低,仅34%,可能是由于,氟原子的强拉电子效应导致苯炔活性降低,进而影响反应效率。
2.3 目标化合物的表征
1-(1-phenylquinolin-2(1H)-ylidene)propan-2-one(Ⅲa):黄色油状物,产率74%。1HNMR(400 MHz,CDCl3),δ:7.49~7.24(m,8H),7.20~7.14(m,3H),6.42~6.39(d,J=12 Hz,1H),1.91(s,3H);13CNMR(101 MHz,CDCl3),δ:187.8,151.7,137.9,137.0,134.7,131.3,129.9,128.0,126.4,125.9,122.5,121.9,119.1,117.6,105.4,26.1;HRMS(ESI),m/z:calcd for C18H16NO+262.122 64 [M+H]+,found 262.122 41。
1-(1-(2,5-dimethylphenyl)quinolin-2(1H)-ylidene)propan-2-one(Ⅲb):黄色油状物,产率69%。1HNMR(400 MHz,CDCl3),δ:7.55~7.47(m,4H),7.24~7.19(m,2H),7.10~7.07(m,1H),6.99(s,1H),6.31~6.28(d,J=12 Hz,1H),2.34(s,3H),2.11(s,3H),1.90(s,3H);13CNMR(101 MHz,CDCl3),δ:188.5,152.3,138.3,137.7,136.0,135.9,135.7,133.3,130.8,130.2,128.2,127.3,123.4,122.9,120.0,118.6,104.9,26.6,21.0,19.3;HRMS (ESI),m/z:calcd for C20H20NO+290.153 94 [M+H]+,found 290.154 14。

1-(1-(2,3-dihydro-1H-inden-5-yl)quinolin-2(1H)-ylidene)propan-2-one(Ⅲd):黄色油状物,产率60%。1HNMR(400 MHz,CDCl3),δ:7.51~7.46(m,4H),7.28~7.18(m,3H),7.09(s,1H),7.00~6.98(d,J=8 Hz,1H),6.54~6.51(d,J=12 Hz,1H),2.98~2.93(m,4H),2.17~2.09(m,2H),1.99(s,3H);13CNMR(101 MHz,CDCl3),δ:189.1,152.8,145.1,142.8,136.5,135.5,130.8,130.0,128.1,127.4,124.8,123.4,122.9,120.5,118.6,106.6,32.9,32.7,27.2,25.5;HRMS(ESI),m/z:calcd for C21H20NO+302.153 94 [M+H]+,found 302.154 14。
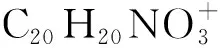
1-(1-(3-fluorophenyl)quinolin-2(1H)-ylidene)propan-2-one(Ⅲf):黄色油状物,产率34%。1HNMR(400 MHz,CDCl3),δ:7.56~7.31(m,6H),7.27~7.23(m,1H),7.08~7.04(m,2H),7.00~6.97(d,J=12 Hz,1H),6.49~6.46(d,J=12 Hz,1H),1.99(s,3H);13CNMR(101 MHz,CDCl3),δ:188.7,164.5,162.0,152.5,141.3,141.2,137.9,136.1,131.1,130.5,130.4,128.2,128.2,127.5,123.7,122.9,119.8,119.3,119.1,118.6,114.1,113.9,105.3,105.3,27.1;HRMS(ESI),m/z:calcd for C18H15FNO+280.113 22 [M+H]+,found 280.113 37。
2.4 可能的反应机理(图4)
由图4可知,氟离子进攻Kobayashi苯炔前体的三甲基硅基基团,进行1,2消除原位生成苯炔,然后进行氮原子插入得到中间体,再通过电子转移得到目标化合物。
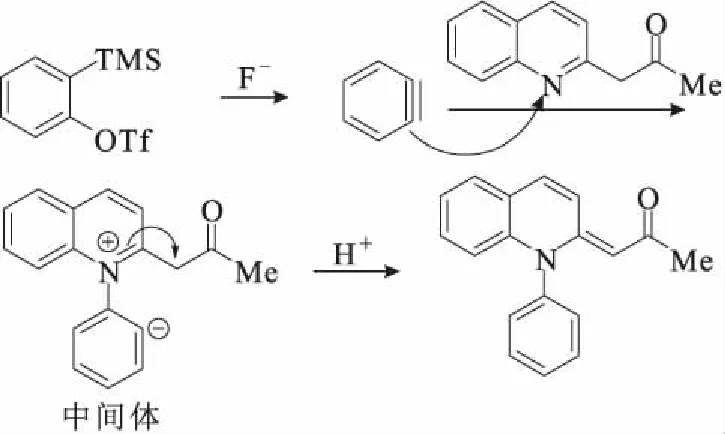
图4 可能的反应机理Fig.4 Possible reaction mechanism
2.5 抑菌活性
以DMSO和诺氟沙星(N-CK)为对照,对目标化合物Ⅲa~Ⅲf的抑菌活性进行评价,结果见表2。
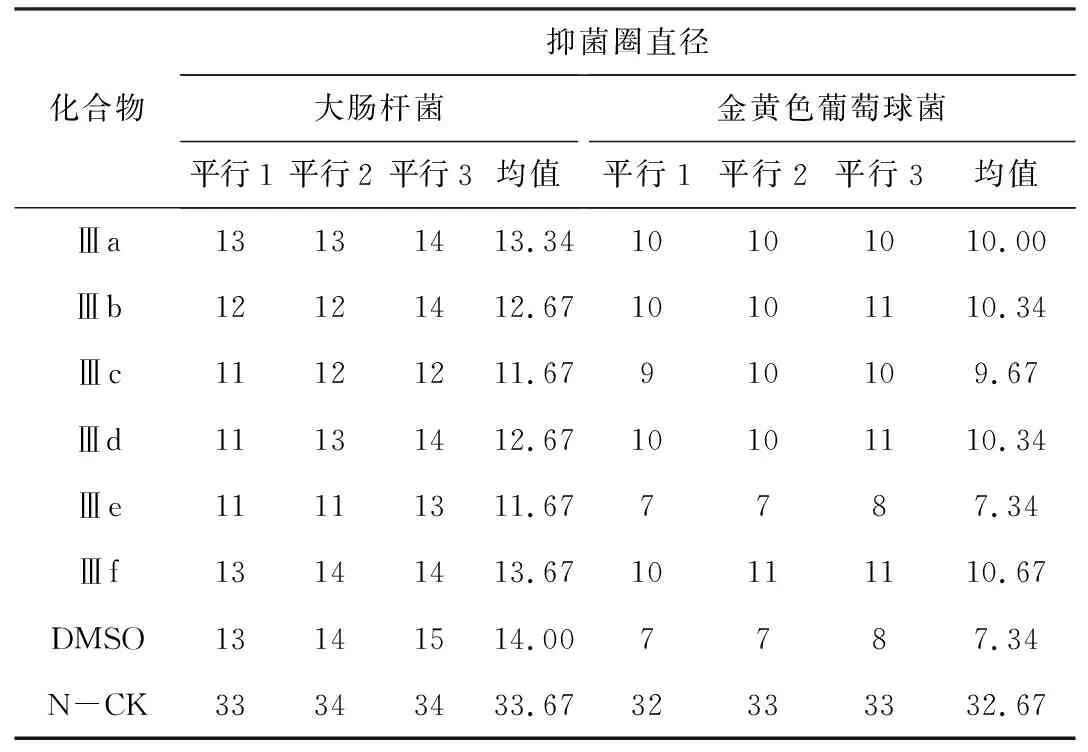
表2 抑菌圈直径/mmTab.2 Inhibitory zone diameter/mm
由表2可知:(1)目标化合物Ⅲa~Ⅲf对大肠杆菌的抑菌圈直径在11.67~13.67 mm之间,小于溶剂DMSO的抑菌圈直径。推测合成的6种目标化合物对大肠杆菌均无明显的抑菌活性。(2)目标化合物Ⅲe对金黄色葡萄球菌的抑菌圈直径与DMSO的相同,表明目标化合物Ⅲe对金黄色葡萄球菌无明显的抑菌活性;其它5种目标化合物对金黄色葡萄球菌的抑菌圈直径在9.67~10.67 mm之间,小于诺氟沙星的抑菌圈直径,但大于DMSO的,表明目标化合物Ⅲa、Ⅲb、Ⅲc、Ⅲd、Ⅲf对金黄色葡萄球菌有一定的抑菌活性,但弱于诺氟沙星。
3 结论
在溶剂为乙腈、氟离子源为CsF、室温反应的最佳条件下,不同取代的Kobayashi苯炔前体与2-乙酰亚甲基喹啉反应均能得到预期目标化合物Ⅲa~Ⅲf,产率为34%~75%;除目标化合物Ⅲe外,其它5种目标化合物均对金黄色葡萄球菌具有较好的抑菌活性。该合成方法具有条件温和、操作简单等优点,为去芳构化喹啉衍生物在医药领域的应用提供了一定的理论支撑。
