石榴籽粗提物的提取工艺优化及其对变异链球菌的抑菌作用研究
2022-11-25赵玮钦李珏丹
高 洁, 赵玮钦,李珏丹,程 政
(1.陕西省颅颌面精准医学研究重点实验室,陕西 西安 710004;2.西安交通大学 口腔医院综合科, 陕西 西安 710004;3.西安科技大学化学与化工学院,陕西 西安 710054; 4.国土资源部煤炭资源勘查与综合利用重点实验室,陕西 西安 710054)
龋病是由附着在牙齿上的特定细菌、唾液等多种因素共同作用下形成的慢性感染类疾病[1]。作为公认的致龋菌,变异链球菌与龋病的发生和发展有着密切的关联。多年来,学者们致力于寻找安全有效的抑制变异链球菌、同时又不破坏口腔正常菌群的防龋药物,如氟化物、氯己定和免疫制剂等,但上述药物因存在副作用、毒性、制作工艺复杂以及生产成本高等缺点,在实际推广应用中均受到一定的限制[2]。研究发现,天然植物提取物具有抑制微生物的作用[3],一些天然植物提取物可以减少细菌在牙齿表面的黏附,从而达到防龋的目的[4]。石榴是一种常见的天然植物,约50%的质量是由石榴皮和石榴籽组成的,其中,石榴皮提取物不仅对金黄色葡萄球菌和大肠杆菌具有抑制作用[5],还对变异链球菌等口腔病原菌具有抑制作用[6],但目前对石榴籽提取物的研究相对较少。鉴于此,作者采用超声辅助法提取石榴籽粗提物,对提取工艺条件进行优化,并研究石榴籽粗提物对变异链球菌的抑制作用,为天然植物提取物用于龋病防治研究提供理论依据。
1 实验
1.1 材料、试剂与仪器
石榴籽,陕西临潼;变异链球菌UA159,空军军医大学口腔医院;脑心浸液肉汤(BHI),青岛海博生物科技有限公司。
正己烷、无水乙醇,天津富宇精细化工有限公司;乙酸乙酯,广东光华科技股份有限公司;硫酸亚铁、氯化钠,郑州派尼化学试剂厂;水杨酸,天津天力化学试剂有限公司;30%过氧化氢,天津河东区红岩试剂厂;0.9%氯化钠注射液(生理盐水),山东齐都药业有限公司;琼脂粉、酵母浸粉、蛋白胨,北京奥博星生物技术有限责任公司;氨苄青霉素,北京博奥拓达科技有限公司。
高速多功能粉碎机,永康铂欧五金制品有限公司;全温振荡培养箱,太仓豪城实验仪器制造有限公司;循环水式多用真空泵,金坛金祥龙电子有限公司;紫外可见分光光度计,北京普析通用仪器有限责任公司;生化培养箱,上海一恒科学仪器有限公司;立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;单人单面净化工作台,苏州净化设备有限公司;超低温冷冻储存箱,中美美菱低温科技股份有限公司;数显恒温水浴锅,无锡远路贸易有限公司;电子天平,福州华志科学仪器有限公司。
1.2 石榴籽粗提物的提取
1.2.1 石榴籽的预处理
将石榴籽用蒸馏水洗净,置于70 ℃恒温鼓风干燥箱中干燥,用高速多功能粉碎机粉碎,过40目筛,置于干燥的锥形瓶中密封保存,备用。
1.2.2 提取方法的选择
超声波辅助提取法:称取5.0 g石榴籽粉末于250 mL锥形瓶中,按料液比1∶20(g∶mL,下同)加入100 mL无水乙醇,瓶口用棉塞塞紧,在30 ℃、超声波功率100 W下超声提取30 min;抽滤,用旋转蒸发器除去溶剂;置于70 ℃恒温鼓风干燥箱中干燥,得粉末状粗提物,称重,按下式计算石榴籽粗提物得率:
式中:m1为烧杯和石榴籽粗提物的质量,g;m2为烧杯的质量,g;m为石榴籽粉末的质量,g。
浸提法:称取5.0 g石榴籽粉末于250 mL锥形瓶中,按料液比1∶20加入100 mL无水乙醇,瓶口用棉塞塞紧,充分混匀后,在30 ℃全温振荡培养箱中振荡30 min,取出置于棕色瓶避光静置18 h;抽滤,用旋转蒸发器除去溶剂;置于70 ℃恒温鼓风干燥箱中干燥,得粉末状粗提物,称重,计算石榴籽粗提物得率。
1.2.3 提取工艺的优化
采用单因素实验优化石榴籽粗提物的提取工艺,考察提取溶剂(无水乙醇、正己烷、乙酸乙酯)、料液比(1∶10、1∶15、1∶20、1∶25,g∶mL)、提取时间(30 min、60 min、90 min、120 min)、提取温度(35 ℃、45 ℃、55 ℃、65 ℃)、超声波功率(10 W、40 W、70 W、100 W)对石榴籽粗提物得率的影响。
1.3 石榴籽粗提物的抑菌活性
1.3.1 菌悬液的制备
变异链球菌UA159冻干株在厌氧培养箱中37 ℃静置培养(10%CO2、10%H2、80%N2)复苏48 h,革兰氏染色镜检菌落生长形态,确认无污染后,将单个菌落接种到BHI培养基中,37 ℃厌氧培养24 h,采用紫外可见分光光度计将菌液浓度调至OD600=0.1,备用。将5 mL生理盐水注入灭菌的150 mL锥形瓶中,再用灭菌的接种环刮取少量健康单菌落置于锥形瓶中,打散、摇匀,制成菌悬液。
1.3.2 菌体培养基的制备
BHI培养基的制备:称取3.7 g BHI、1.8 g琼脂,加入150 mL蒸馏水加热溶解,高压、121 ℃灭菌15 min,冷却至约50 ℃,加入1 mL氯化血红素、维生素K1溶液。
将上述BHI培养基从灭菌锅中取出,往每个无菌培养皿中趁热倒入约20 mL,静置,冷却凝固。将约50 ℃、45 mL的BHI培养基倒入菌悬液中,充分混合均匀,用移液枪移取约6 mL(含200 μL 变异链球菌UA159菌液)于每个培养皿中(将表面覆盖均匀即可),制成菌体培养基。
1.3.3 石榴籽提取液的制备
将石榴籽粗提物用蒸馏水配制成120 mg·mL-1的母液,按二倍稀释法溶于菌体培养基中,然后稀释成5个浓度梯度(30 mg·mL-1、15 mg·mL-1、7.5 mg·mL-1、3.75 mg·mL-1、1.875 mg·mL-1)的石榴籽提取液,121 ℃灭菌20 min。用含1 μg·mL-1氨苄青霉素的BHI培养基作为阳性对照,不含石榴籽提取液的BHI培养基作为空白对照。
1.3.4 抑菌圈直径的测定
采用牛津杯法测定抑菌圈直径。在超净工作台上,各组试液各0.2 mL吸入牛津杯中,轻轻放入菌体培养基中,牛津杯放置一定要平稳到位,以确保牛津杯内物质均匀扩散,每个培养皿中均匀放置3~4个牛津杯。将培养皿置于37 ℃恒温培养箱中培养24 h,测定抑菌圈直径,每组测定3次,结果取平均值。
1.3.5 最低抑菌浓度(MIC)的测定
取200 μL变异链球菌UA159菌液接种于BHI培养基上,37 ℃下于厌氧盒中培养24 h,观察菌落生长。在深色背景下,肉眼观察无细菌生长,即试管内液体清亮无混浊或沉淀的最低药物浓度为最低抑菌浓度。平行测定3次,结果取平均值。
1.3.6 统计学分析

2 结果与讨论
2.1 石榴籽粗提物的工艺优化
与浸提法相比,超声波辅助提取法的石榴籽粗提物得率较高、所耗时间较短。因此,选用超声波辅助提取法进行后续实验。
2.1.1 提取溶剂对石榴籽粗提物得率的影响(表1)

表1 提取溶剂对石榴籽粗提物得率的影响Tab.1 Effect of extraction solvent on yield of crude extract from pomegranate seeds
由表1可知,以无水乙醇为提取溶剂时,石榴籽粗提物得率最高;以正己烷和乙酸乙酯为提取溶剂时,石榴籽粗提物得率相差不大。因此,选择无水乙醇为提取溶剂。
2.1.2 料液比对石榴籽粗提物得率的影响(图1)
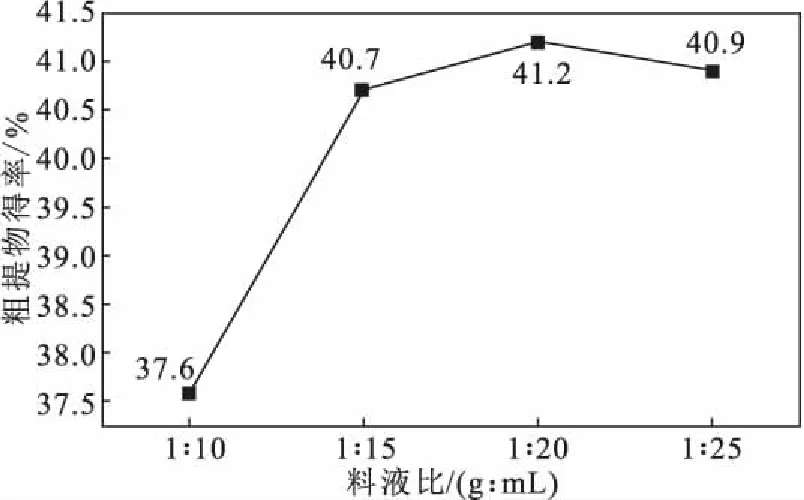
注:无水乙醇为提取溶剂,提取时间40 min,提取温度30 ℃,超声波功率100 W图1 料液比对石榴籽粗提物得率的影响Fig.1 Effect of solid-liquid ratio on yield of crude extract from pomegranate seeds
由图1可知,当料液比从1∶10减小到1∶20时,石榴籽粗提物得率上升较快,从37.6%提高到41.2%;但当料液比从1∶20减小到1∶25时,石榴籽粗提物得率下降到40.9%,呈缓慢下降趋势。因此,选择料液比为1∶20。
2.1.3 提取时间对石榴籽粗提物得率的影响(图2)
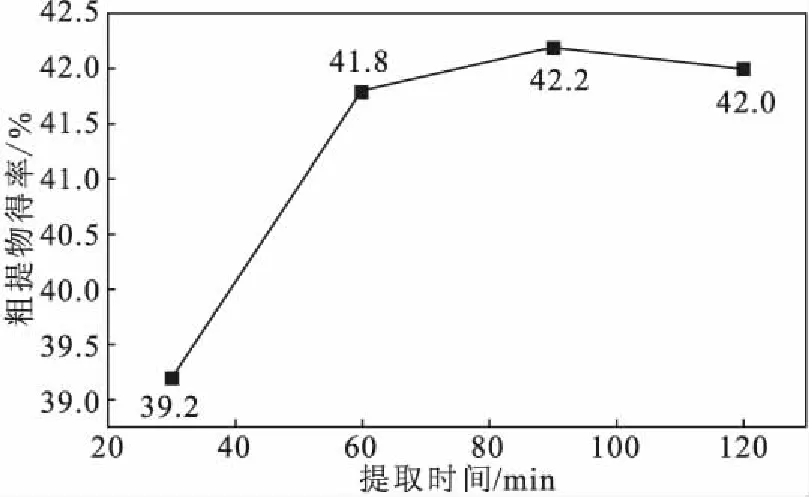
注:无水乙醇为提取溶剂,料液比1∶20,提取温度30 ℃,超声波功率100 W图2 提取时间对石榴籽粗提物得率的影响Fig.2 Effect of extraction time on yield of crude extract from pomegranate seeds
由图2可知,当提取时间从30 min延长到90 min时,石榴籽粗提物得率上升较快,从39.2%提高到42.2%;但当提取时间继续延长到120 min时,石榴籽粗提物得率下降到42.0%,呈缓慢下降趋势。因此,选择提取时间为90 min。
2.1.4 提取温度对石榴籽粗提物得率的影响(图3)
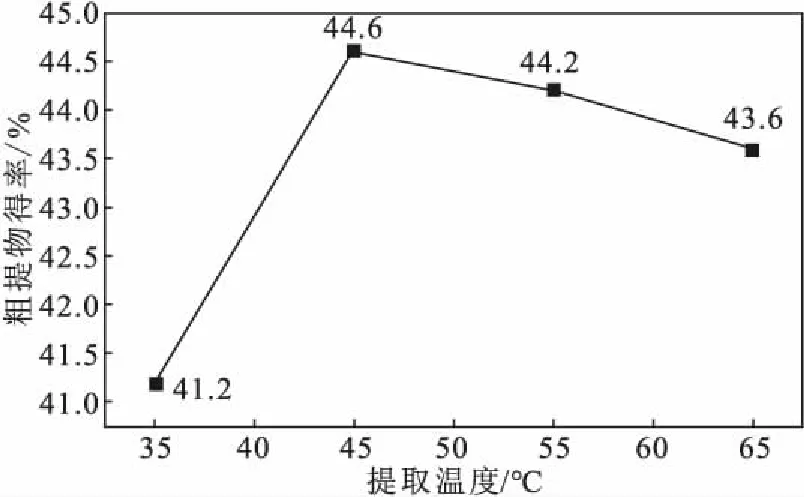
注:无水乙醇为提取溶剂,料液比1∶20,提取时间90 min,超声波功率100 W图3 提取温度对石榴籽粗提物得率的影响Fig.3 Effect of extraction temperature on yield of crude extract from pomegranate seeds
由图3可知,当提取温度从35 ℃升高到45 ℃时,石榴籽粗提物得率从41.2%提高到44.6%,呈明显上升趋势;但当提取温度继续升高到65 ℃时,石榴籽粗提物得率下降到43.6%,呈缓慢下降趋势。因此,选择提取温度为45 ℃。
2.1.5 超声波功率对石榴籽粗提物得率的影响(图4)

注:无水乙醇为提取溶剂,料液比1∶20,提取时间90 min,提取温度45 ℃图4 超声波功率对石榴籽粗提物得率的影响Fig.4 Effect of ultrasonic power on yield of crude extract from pomegranate seeds
由图4可知,当超声波功率从10 W提高到40 W时,石榴籽粗提物得率从35.0%缓慢提高到36.2%;当超声波功率继续提高到100 W时,石榴籽粗提物得率提高到44.6%,呈快速上升趋势。因此,选择超声波功率为100 W。
2.2 石榴籽粗提物的抑菌活性(图5)
由图5可知,30 mg·mL-1、15 mg·mL-1、7.5 mg·mL-1石榴籽粗提物组抑菌圈直径分别为(13.0±1.4) mm、(11.0±1.2) mm、(10.0±2.1) mm;加入1 μg·mL-1氨苄青霉素的阳性对照组抑菌圈直径为(21.0±2.1) mm;3.75 mg·mL-1、1.875 mg·mL-1石榴籽粗提物组、空白对照组均未见抑菌圈形成。与空白对照组相比,高浓度石榴籽粗提物组和各氨苄青霉素组均有极明显的抑菌圈(P<0.01),其中30 mg·L-1石榴籽粗提物组具有明显的抑菌作用。石榴籽粗提物对变异链球菌UA159的最低抑菌浓度为7.5 mg·mL-1。

1~5:石榴籽粗提物浓度(mg·mL-1)分别为30、15、7.5、3.75、1.8751a~5a:1~5中加入1 μg·mL-1氨苄青霉素图5 石榴籽粗提物的抑菌活性实验结果Fig.5 Experimental results of antibacterial activity of crude extract from pomegranate seeds
2.3 讨论
有效抑制致龋菌的生长一直是龋病防治研究的重点,天然植物因具有来源丰富、抑菌作用良好且毒副作用小等优势逐渐成为研究热点。石榴作为常见的天然植物,获取便利,富含鞣质类、黄酮类、生物碱及有机酸类化合物[7],其中,酚类和黄酮类化合物具有抗菌、抗炎和抗氧化特性[8-10],可降低氧化应激,抑制脂质过氧化和泡沫细胞生成,减少巨噬细胞的脂质摄取[11]。本课题组前期研究发现,石榴皮中原花青素可以抑制变异链球菌生物膜的形成,并对其相关毒力基因的表达也有抑制作用。

3 结论
以石榴籽为原料,采用超声辅助法提取石榴籽粗提物,确定最优提取工艺条件为:以无水乙醇为提取溶剂、料液比1∶20(g∶mL)、提取时间90 min、提取温度45 ℃、超声波功率100 W,在此条件下,石榴籽粗提物得率为44.6%。石榴籽粗提物对变异链球菌UA159具有抑制作用,推测可能与石榴籽粗提物中多酚等活性成分有关,但其具体的作用机制仍需要进一步研究和探讨。
