喹啉降解菌Rhodococcus sp.的降解特性与生物强化作用
2017-06-28张玉秀豆梦楠朱康兴柴团耀张怡鸣徐伟超中国矿业大学北京化学与环境工程学院北京0008山西省霍州市第二中学山西霍州0400中国科学院大学生命科学学院北京00049
张玉秀,豆梦楠,朱康兴,柴团耀,张怡鸣,徐伟超(.中国矿业大学(北京)化学与环境工程学院,北京0008;.山西省霍州市第二中学,山西 霍州 0400;.中国科学院大学生命科学学院,北京 00049)
喹啉降解菌Rhodococcus sp.的降解特性与生物强化作用
张玉秀1*,豆梦楠1,朱康兴2,柴团耀3,张怡鸣1,徐伟超1(1.中国矿业大学(北京)化学与环境工程学院,北京100083;2.山西省霍州市第二中学,山西 霍州 031400;3.中国科学院大学生命科学学院,北京 100049)
以喹啉为唯一碳氮源从某焦化废水处理厂活性污泥中筛选出一株喹啉降解菌菌株红球菌(Rhodococcus sp.) KDQ2,其在24h内能将400mg/L喹啉降解96%,降解的最适条件为37℃和pH6~9,降解动力学符合Haldane方程.KDQ2能利用吡啶,但不能利用苯酚;在喹啉、吡啶和苯酚共存条件下,150mg/L吡啶和400mg/L苯酚不影响150mg/L喹啉在1d时的降解效率.KDQ2能适应含有高浓度苯酚、吡啶和喹啉等污染物的焦化废水环境条件,可以与活性污泥中的微生物共存,提高实际焦化废水中喹啉和TOC的去除能力.
焦化废水;红球菌;喹啉;生物强化作用
焦化废水是一类典型的高有机负荷、高污染、有毒/难降解的工业废水[1-2].焦化废水中的有机物除主要的酚类化合物外,其他主要是多环芳烃(PAHs)和含有N、S和O元素的杂环化合物,其中含氮杂环化合物(NHCs)主要包括喹啉类、吡啶类、唑啉类和吲哚类.PAHs和NHCs均属于难降解有机物,吡啶和喹啉是两种典型的含氮杂环化合物,毒性研究表明喹啉及其衍生物对藻、蚤和细菌等生物具有遗传毒性和致突变活性[3],抑制废水生物处理过程中的微生物活性,致使生物处理的二级出水中COD和NH3N难以达到国家工业废水水质排放标准.为了提高生化出水水质,国内外学者一方面利用萃取置换-生物降解耦合技术去除焦化废水中的喹啉和吡啶等NHCs[4];另一方面,筛选高效的降解菌株[5],投加到生物反应器中,提高NHCs的去除效率.
目前,多种喹啉降解菌已在焦化废水处理厂的活性污泥中分离出来,如皮氏伯克霍尔德氏菌(Burkholderia picekttii)[6]、假单胞菌(Pseudomonas sp.)[7]、红球菌(Rhodococcus sp.)[8]、食酸菌(Acidovorax sp.)[9]和短波单胞菌(Brevundimonas sp.)[5]等,且多数研究主要集中在单一基质纯培养的条件下细菌的降解特征和代谢途径方面[8],而对多基质条件下,尤其是在高浓度喹啉、吡啶和苯酚存在时,喹啉降解菌的生长和去除能力未见报道.此外,在实验室模拟的生物反应器中探索焦化废水处理的生物强化作用的报道很少[5,9],且筛选的喹啉降解菌用于实际焦化废水生物处理系统中的强化作用研究非常缺乏.
研究表明:接种的降解菌在污泥系统中虽然不能持久生长,但可以促进污泥细菌群落的改变和多样性恢复[10],有利于反应器的快速启动.焦化废水中含有高浓度的酚类、喹啉和吡啶等多种难降解有机物,高效的喹啉降解菌必须能适应焦化废水的水质特征,具有广谱性的底物利用能力,且能在焦化废水处理系统中生存和生长.所以,高效的喹啉降解菌的分离鉴定和生物强化作用依然是当今焦化废水生物处理领域研究的热点.本研究以某焦化厂废水处理系统曝气池中的活性污泥为菌源,分离鉴定以喹啉为唯一碳源、氮源和能源生长的优势菌株,研究其在高浓度苯酚和吡啶存在时喹啉的降解效率,并分析其在实际焦化废水中的喹啉降解效果和TOC去除率,为生物强化处理焦化废水中含氮杂环化合物提供技术支持.
1 材料与方法
1.1 培养基
细菌富集和形态观察用牛肉膏蛋白胨培养基[11].喹啉降解菌筛选和降解的培养基为不含氮的无机盐培养基 1(MSM1)[8],苯酚降解和多种有机物共基质降解的培养基为含氮的无机盐培养基2(MSM2)[11].培养基在121℃高压灭菌20min,喹啉、吡啶和苯酚等浓度根据需要量配制.
1.2 喹啉降解菌的富集、分离和鉴定
将取自某焦化废水处理厂二沉池的5mL污泥接种到含有 100mL富集培养基中,37℃、180 r/min震荡培养1d,按照5%的接种量将富集的菌液接种到含有 200mg/L喹啉的不含氮的无机盐液体培养基 MSM1中,培养液至浑浊后,逐级提高喹啉浓度,直至500mg/L喹啉的培养基中变浑浊;将不同浓度的稀释液分别涂布在含有200mg/L喹啉的MSM1平板上,32℃培养3d,挑取单菌落划线分离培养多次后获单一菌株.挑取单菌落,接入到含有200mg/L喹啉的液体MSM1培养基中驯化培养,提高喹啉浓度至600mg/L时,鉴定菌株,研究其降解特性.
菌株鉴定采用形态观察和16S rRNA基因序列分析方法.将喹啉降解菌涂布在牛肉膏蛋白胨培养基上生长过夜,观察菌落形态.16S rRNA基因用通用引物 27F:5`-AGAGTTTGATCCTGGCTCAG-3`和1492R:5`-TACGGCTACCTTGTTACGACTT-3`进行PCR扩增,利用NCBI数据库中在线分析 BLAST程序,将克隆的序列与数据库中注册的细菌序列进行比对分析.
1.3 环境因素和初始喹啉浓度对菌株降解效率的影响
将菌株接至含有200mg/L喹啉的150mL牛肉膏培养基中,在37℃、150r/min摇床中震荡培养至对数期;4℃、12000r/min离心10min收集菌体,灭菌水清洗2次后,用MSM1液体培养基重悬,将菌体浓度调至 OD600≈1.5,即得到活化的菌悬液.将活化的菌悬液以 5%接种量接种至含有初始浓度约400mg/L喹啉的150mL MSM1培养基(pH7.0)的三角瓶中,分别在不同温度(20、25、30、37和42℃)下震荡(150r/min)培养24h,测定细菌生物量(OD600)和残留的喹啉浓度.在最适的温度下,测定菌株在不同pH(5、6、7、8、9和10)条件下24h的喹啉降解率;然后,在最适条件下,分析不同初始喹啉浓度(50、100、150、200、250、300、350、400、500和600mg/L)对菌株降解喹啉的影响.在某一特定的初始喹啉浓度(S)下,喹啉降解曲线的斜率除以菌体生物量即为特定起始喹啉浓度下的比降解速率(q)[6],根据比降解速率与初始喹啉浓度的关系作图,用Matlab软件应用Haldane方程拟合喹啉降解动力学方程[11].
1.4 菌株在苯酚和吡啶等共基质条件下的降解
将活化的菌悬液以5%的接种量分别接种至单一基质(150mg/L喹啉、150mg/L吡啶或400mg/L苯酚)或多种有机物(150mg/L喹啉、150mg/L吡啶和400mg/L苯酚)共存的含氮无机盐培养基(MSM2)中,在最适条件下培养,定时取样,测定残留的有机污染物浓度.
1.5 菌株对实际焦化废水处理的生物强化作用
某焦化废水处理厂好氧池进水(CW)的水质特征:COD浓度约 240mg/L,苯酚 40~100mg/L,喹啉40~100mg/L,吡啶10~30mg/L,pH 7~8.将活化的菌悬液以5%接种量接种到过滤后好氧池进水中,在最适温度下利用250mL三角瓶摇瓶实验,测定菌株在实际好氧池进水中喹啉和TOC的去除率.
菌株在好氧池中的生物强化作用分析.焦化废水处理厂好氧池的污泥浓度(MLSS)为4~6g/L,其他水质特征同好氧池进水.用二沉池污泥(S)将好氧池进水(CW)的 MLSS调至约4g/L,将活化的菌悬液以 5%接种量接种到含有污泥的好氧池废水中,摇瓶实验分析菌株在实际焦化废水中喹啉和TOC的去除率.
1.6 分析方法
细菌的生物量(OD600)用可见光分光光度计在600nm波长下测定[8],喹啉和吡啶浓度用紫外光分光光度计分别在313nm和256nm波长下测定[12],苯酚浓度用 4-氨基安替比林法测定[12], TOC用TOC分析仪(TOC-V/CPH)测定.
2 结果与讨论
2.1 喹啉降解菌株KDQ2的分离和鉴定
以喹啉为唯一碳源、氮源和能源从焦化废水处理厂二沉池污泥中分离得到一株喹啉降解菌株 KDQ2,其在 24h内能将 400mg/L喹啉降解96%.KDQ2在牛肉膏蛋白胨固体培养基上生长为黄色的圆形菌落,表面隆起且光滑,边缘整齐.BLAST比对分析表明 KDQ2菌株的 16S rRNA基因序列与NCBI数据库中用于生物强化降解甲基乙基酮的 Rhodococcus pyridinivorans SB3094[13]和降解高浓度硝基苯的 Rhodococcus sp. NB5(GenBank注册号: GU085235.1) 菌株序列的一致性分别高达 99%和 100%,表明该菌株属于红球菌属,命名为Rhodococcus sp. KDQ2.
2.2 环境条件对KDQ2菌株喹啉降解的影响
温度影响微生物的生长,从而影响有机物的降解利用.KDQ2在20 ~37℃ ℃以400mg/L喹啉为唯一碳氮源条件下培养24h(图1a),KDQ2的生物量(OD600)随着温度的升高而增大,喹啉降解率也随着温度的升高而增大;当温度高达 42℃时,其 OD600急剧下降,喹啉降解率也随之降低至20%以下;OD600和喹啉降解率的变化趋势一致,且在37℃下OD600和喹啉降解率均达到最大值,表明喹啉的降解是由于 KDQ2以其为碳、氮源生长消耗所致,37℃是KDQ2生长和喹啉降解的最佳温度,过低或过高的温度均降低细胞的喹啉代谢活性.从焦化废水处理厂分离的不同喹啉降解菌的最适温度不同,如Rhodococcus sp. QL2降解喹啉的最适温度是 37℃[8], Acidovorax sp. DQS-01是35℃[8],而Brevundimonas sp. K4[5]和Pseudomonas sp. BW003是30℃[14].所以,在实际焦化污水处理系统中,好氧池的温度通常保持在25~40℃之间,以维持微生物的降解活性.
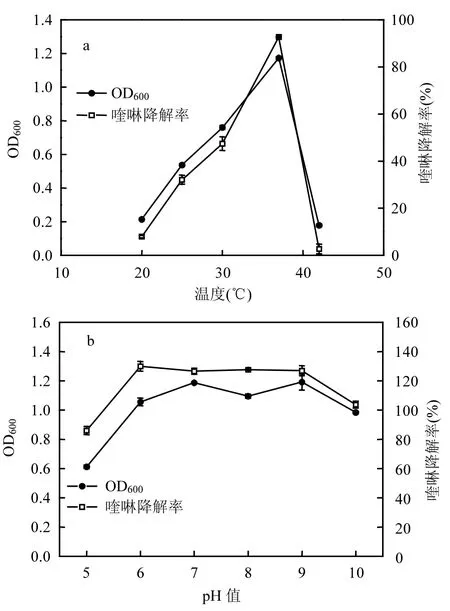
图1 温度和pH值对KDQ2在24h时生长和喹啉降解的影响Fig.1 Effects of temperature and pH on the growth of KDQ2 and quinoline degradation at 24h
pH值影响细菌的酶活性和生长.KDQ2在37℃不同 pH值条件下的喹啉培养基中培养24h(图1b),结果表明KDQ2在pH 5时喹啉降解率约50%,在pH 6~10时喹啉降解率均大于80%,在 pH 6~9时 OD600和喹啉降解率最高,表明KDQ2菌株生长和喹啉降解的最佳pH范围较宽.目前,在焦化废水中分离的多种喹啉降解菌生长和降解的最适初始 pH 值范围为 8~10,如Rhodococcus sp. QL2 为pH 8~9[8]:Acidovorax sp. DQS-01为pH 8~10[9], Brevundimonas sp. K4为pH 9[5],Pseudomonas sp. BW003为pH 8[14],表明喹啉降解菌生长和降解喹啉的pH值多数为中性偏碱性范围.喹啉降解过程中会产生酸性中间产物[15],碱性环境中的OH可与之中和,使pH值趋于中性;所以,焦化废水处理厂好氧池进水的 pH值通常均调至 7~8左右,有利于微生物的生长和有机物的降解.KDQ2具有较宽pH值适应性,在实际废水处理系统中可以耐受较大的pH值负荷冲击.
2.3 KDQ2的降解动力学分析
初始底物浓度影响酶促反应速度.在37℃和pH 8的最适条件下,以喹啉为唯一碳氮源分析初始喹啉浓度对KDQ2降解的影响(图2a).当初始喹啉浓度<100mg/L时,8h内喹啉的降解率高达约 96%(几乎完全降解);200mg/L喹啉降解需要13h, 500mg/L喹啉需要 24h,600mg/L喹啉需要32h,表明随着喹啉浓度的升高,喹啉完全降解所需的时间越长,高浓度喹啉对KDQ2的降解具有抑制作用.焦化废水中分离的喹啉降解菌Pseudomonas sp. BW003能在3~8h 内降解192~911mg/L喹啉,去除率96%~98%[14],Rhodococcus sp. QL2在10h内能完全降解240mg L喹啉[8,16], Brevundimonas sp. K4可在 28h内完全降解 200mg/L喹啉[5], Acidovorax sp. DQS-01降解300mg/L需要70h[9].与之相比,KDQ2的喹啉降解能力与Rhodococcus sp. QL2相似.焦化废水处理厂好氧池中的喹啉浓度约 40~100mg/L,KDQ2在此浓度范围内能快速降解喹啉,所以,KDQ2是一株高效的喹啉降解菌.
在 KDQ2降解喹啉的过程中,喹啉既是反应的基质,同时也是抑制剂.对于底物又是抑制剂的生物反应过程,通常采用Haldane方程来模拟底物降解动力学.根据实测的KDQ2比降解速率(q)与喹啉初始浓度(S)关系作图(图2b),通过Matlab 软件按照Haldane 方程对实验数值进行非线性最小二乘曲线拟合,可得 KDQ2喹啉降解的动力学参数:qmax=0.32/h、Ks=37.62mg/L和Ki=291.63mg/L (相关系数R2=0.9951),模拟曲线见图2b.
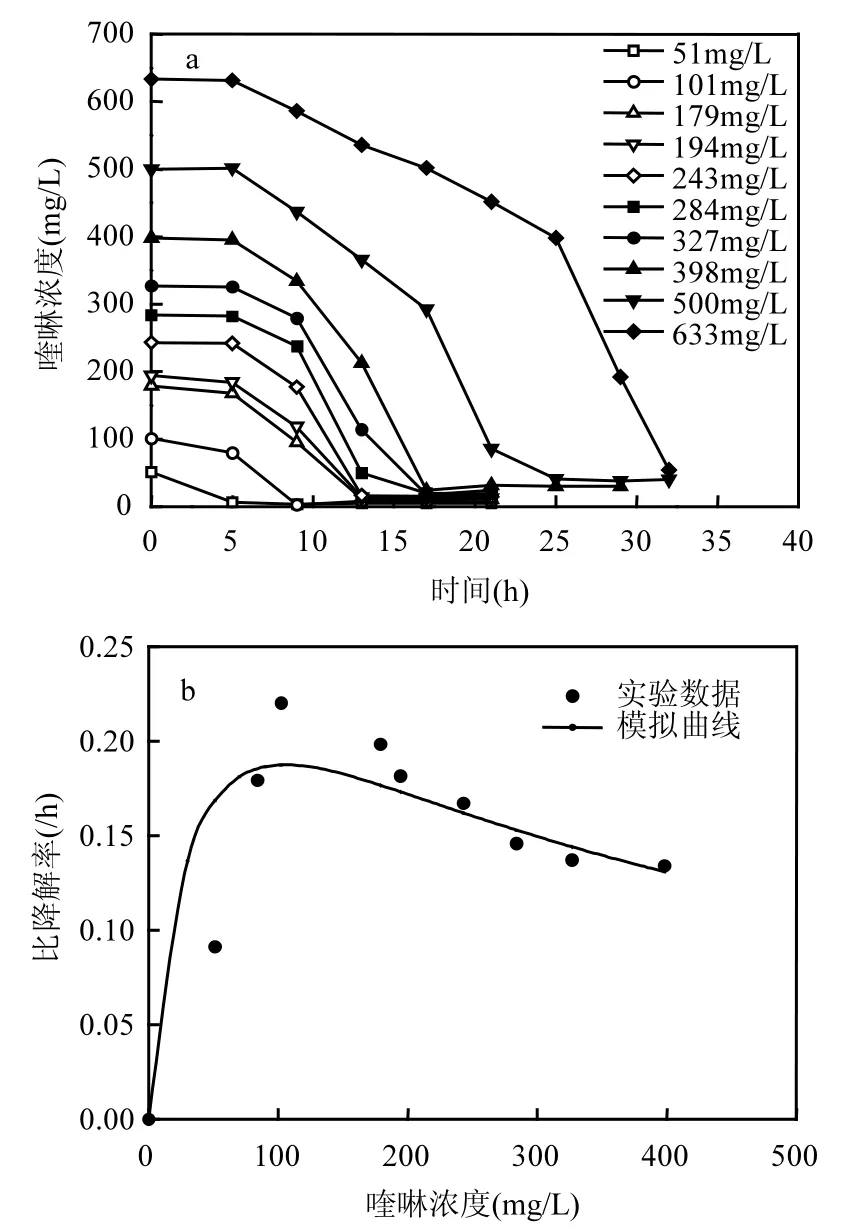
图2 不同起始喹啉浓度对KDQ2降解的影响和KDQ2的降解动力学Fig.2 Quinoline degradation at different initial quinoline concentrations and the kinetic of quinoline degradation by strain KDQ2
从图 2b看出:当初始喹啉浓度<50mg/L时,可能是由于碳氮源不足,限制了KDQ2菌株的生长,比降解速率较小;当喹啉浓度升高到104.74mg/L时,比降解速率达到最大值(qmax) 0.32/h;此时,若喹啉浓度继续升高,比降解速率则随之降低,这可能是由于高浓度喹啉(>150mg/L)抑制了菌株的生长,导致降解作用降低.
Ks为半饱和常数,是酶促反应达到最大速率一半时的底物浓度;Ki为抑制系数,反映底物对菌株降解抑制作用的大小,Ki值越大,则底物对降解菌的毒害作用越小,抑制作用也越小,菌株耐受的喹啉浓度则越高.喹啉降解菌 Rhodococcus sp. QL2的降解动力学参数为 qmax=0.499/h, Ks= 68.7mg/L和 Ki= 387.1mg/L[16],KDQ2的 Ki值(291.63mg/L)大 于 Acidovorax sp. DQS-01 (253mg/L)[9],而 小 于 Rhodococcus sp. QL2 (387.1mg/L),表明红球菌属对喹啉浓度具有较高的耐受能力和降解能力.同时,由于焦化废水处理厂好氧池的喹啉浓度(40~100mg/L)小于 KDQ2的Ki值,且达到qmax时的喹啉浓度为104.74mg/L,所以,实际焦化废水中的喹啉浓度不会抑制KDQ2的降解作用,且KDQ2可能具有生物强化作用的应用潜力.
2.4 KDQ2对单一和复合基质中喹啉、吡啶和苯酚的降解
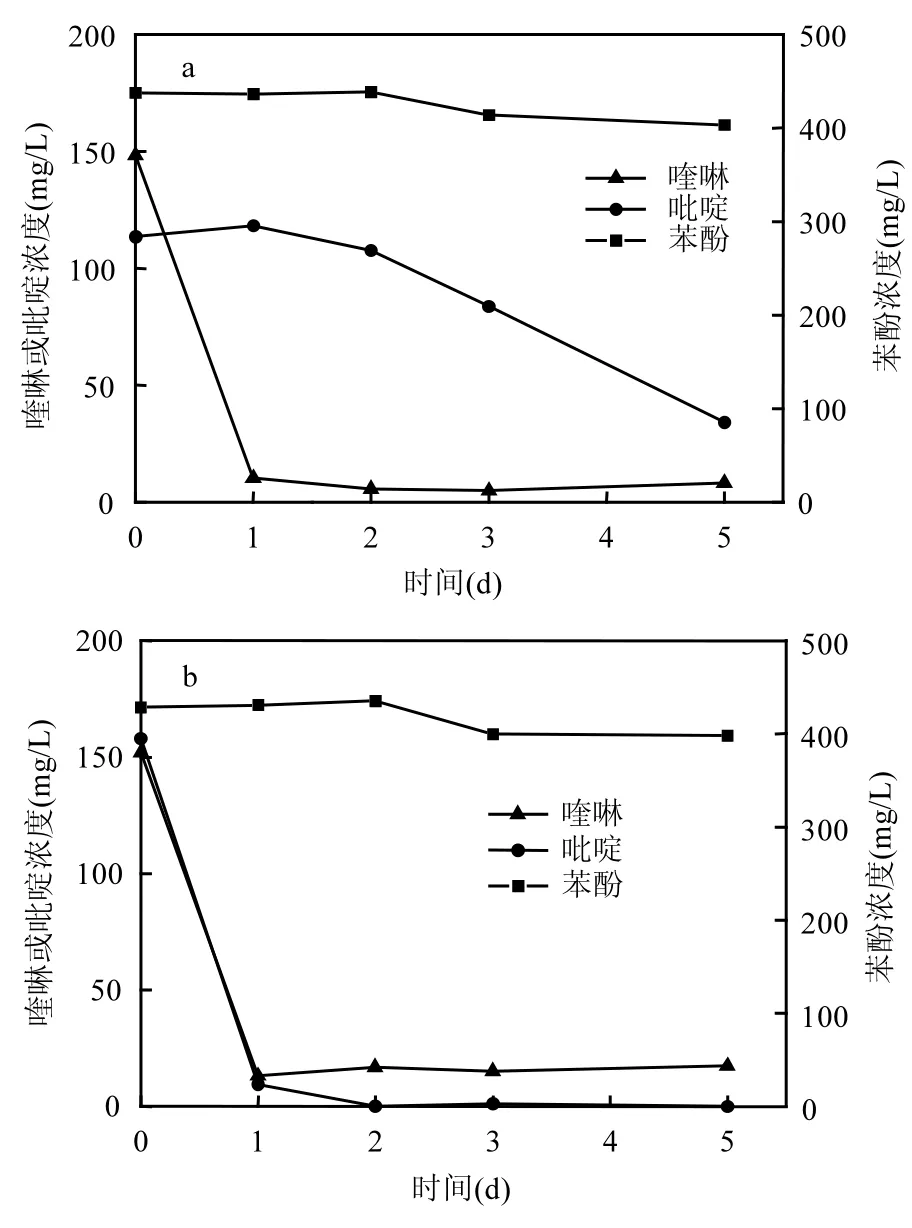
图3 KDQ2对喹啉、吡啶或苯酚等单一污染物及其复合污染物的降解Fig.3 The degradation of quinoline, pyridine or phenol in single substrate or in a mixture of aromatic organics by strain KDQ2
喹啉、吡啶和苯酚等多种有机污染物共存于实际焦化废水中,广谱性的底物利用特性更有利于微生物的生存和实际应用.图3a表明KDQ2在1d 内可将 150mg/L喹啉降解 91.34%,将150mg/L吡啶降解94.01%,然而,2d 内苯酚浓度几乎不变,表明KDQ2具有高效降解喹啉和吡啶的能力,但不能利用苯酚.喹啉降解菌 Acidovorax sp. DQS-01对不同底物降解的降解能力依次:喹啉>异喹啉>吡啶>苯酚,对苯酚的利用能力较小[9];而Rhodococcus sp. QL2可以利用吡啶、苯酚、苯甲酸、儿茶酚、萘、吲哚和 2-羟基喹啉等多种有机物,但是其对不同有机物的降解能力没有详细报道[8];本课题组从焦化废水处理厂活性污泥中分离喹啉降解菌 Pseudomonas aeruginosa KDQ4,能同时高效降解喹啉和苯酚[12];石油污染土壤中分离的喹啉降解菌Bacillus sp. Q2能缓慢利用吡啶、异喹啉和吲哚,但几乎不能利用苯酚[17].表明不同种属的细菌拥有不同的喹啉降解途径[18],所以对吡啶和苯酚等底物的利用能力不同.
细菌的快速降解作用是生物强化作用的关键.在喹啉、吡啶和苯酚等共基质条件下,图 3b表明150mg/L喹啉的降解效率不受苯酚和吡啶的影响,在1d 时的降解率达93.09%,与喹啉单一基质的降解率相近;吡啶的降解率显著降低(图3a),如吡啶浓度在 2d 内几乎不变,2d 后才迅速降低,在5d 时其降解率才达到69.92%;400mg/L苯酚在3d 时几乎没有降解.表明KDQ2在含有高浓度苯酚和吡啶的废水中具有高效的喹啉降解能力,且对吡啶也具有一定的降解作用.皮革厂废水处理厂活性污泥中分离的吡啶降解菌Rhodococcus Chr-9具有降解苯酚的能力,低浓度(100mg/L)苯酚促进 200mg/L吡啶的降解,而高浓度(200mg/L)苯酚浓度则抑制其降解;同时,苯酚降解途径中的苯酚羟化酶基因在吡啶和苯酚共基质时的表达水平高于单一底物,表明其可能在吡啶降解中具有重要作用;苯酚羟化酶对苯酚的亲和力高于吡啶,所以,推测高浓度苯酚对吡啶降解的抑制作用可能是由于吡啶被竞争出酶之外所致[19].KDQ2没有降解苯酚的能力,在共基质条件下,苯酚也不影响喹啉的降解,推测KDQ2可能缺少苯酚羟化酶基因的表达,苯酚可能也不与喹啉竞争喹啉羟化酶而影响其降解效率.另外,在共基质条件下,吡啶的降解率严重降低,推测 KDQ2优先作用于喹啉,喹啉降解完后才开始降解吡啶.
2.5 KDQ2在实际焦化废水中的生物强化作用
某焦化废水处理厂进出水主要水质指标已有报道[20],在含有高浓度有机物(250mg/L苯酚、120mg/L吡啶和120~150mg/L喹啉)的好氧池进水中接种KDQ2,喹啉浓度在12h内迅速下降,降解率达78.3%,22h达到84.9%,TOC在12h内从470mg/L下降到 300mg/L;而未接种的焦化废水(对照)中喹啉在24h内几乎不降解,TOC虽有下降,但高于接种组(图4a),表明KDQ2能适应含有高浓度酚类化合物和吡啶等难降解有机物焦化废水的水质特征,可在含有高浓度苯酚和吡啶的焦化废水中有效降解喹啉.由于好氧池进水中可能含有苯酚降解菌,苯酚的降解导致 TOC下降,所以,未接种的对照废水中TOC也呈现一定的下降趋势.
好氧池污泥中含有多种降解微生物,KDQ2能否在好氧池中快速去除喹啉对于焦化废水的生物强化作用至关重要.图4b表明,在MLSS约4g/L的焦化废水中,在接种KDQ2的焦化废水中喹啉和TOC浓度12h内迅速下降,其变化趋势与上述好氧池进水的结果一致;且KDQ2能与污泥中微生物协同作用,进一步降低 TOC.同时,相对于单一基质的喹啉降解实验,KDQ2在好氧池焦化废水中喹啉的去除没有出现明显的延迟现象,表明 KDQ2不受焦化废水中高浓度酚类物质和吡啶等难降解有机物的影响,能与好氧池污泥中的微生物协同作用有效地降解喹啉. Brevundimonas sp. K4在SBR系统中对喹啉的去除具有增强作用,但因受到焦化废水难降解有机物的抑制,其喹啉去除效率与单一基质摇瓶实验相比有一个较长的适应期[5].KDQ2能迅速适应实际焦化废水的水质,并且快速去除喹啉和TOC,表明其具有生物强化处理实际焦化废水的作用.利用 KDQ2生物强化焦化废水处理技术还需要进一步研究.
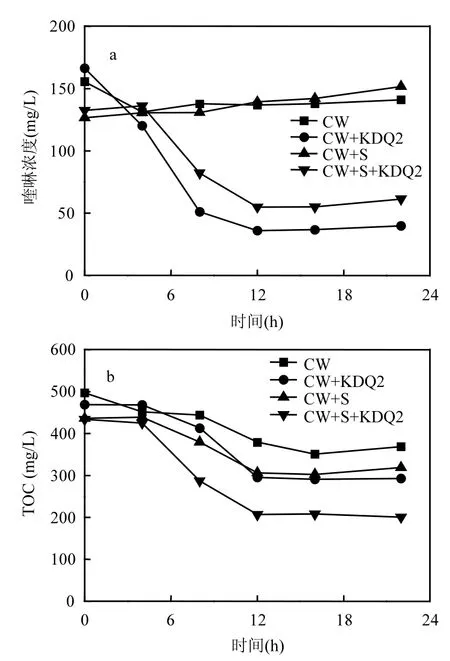
图4 KDQ2对焦化废水中喹啉和TOC的去除Fig.4 Removal of quinoline and TOC by strain KDQ2 from coking wastewater.
3 结论
3.1 从焦化废水处理厂二沉池中分离出一株能以喹啉为唯一碳源、氮源和能源生长的高效降解菌株KDQ2,经形态观察和16S rRNA基因序列比对分析初步鉴定为Rhodococcus sp..KDQ2降解喹啉的最适降解条件为37℃和pH 6~9;其喹啉降解动力学符合 Haldane方程,动力学参数分别为:qmax=0.32/h、Ks=37.62mg/L和Ki= 291.63mg/L.
3.2 KDQ2能降解吡啶,而不降解苯酚;在与吡啶和苯酚等共基质条件下,KDQ2具有高效的喹啉降解能力.
3.3 KDQ2可适应实际焦化废水处理厂好氧池中高浓度苯酚、喹啉和吡啶等多种有机物的水质环境,并能快速去除喹啉,降低TOC.因此, KDQ2可用于生物强化焦化废水中的含氮杂环化合物的去除.
[1]Yu X, Wei C, Wu H, et al. Improvement of biodegradability for coking wastewater by selective adsorption of hydrophobic organic pollutants [J]. Separation and Purification Technology, 2015,151(4):23-30.
[2]唐 海,徐建平,安 东,等.TiO2/ZSM-5m光催化耦合过硫酸盐降解焦化尾水的研究 [J]. 中国环境科学, 2015,35(11):3325-3332.
[3]Neuwoehner J, Reineke A K, Hollender J, et al. Ecotoxicity of quinoline and hydroxylated derivatives and their occurrence in groundwater of a tar-contaminated field site [J]. Ecotoxicology and Environmental Safety, 2009,72(3):819-827.
[4]Yuan X, Sun H, Guo D. The removal of COD from coking wastewater using extraction replacement—biodegradation coupling [J]. Desalination, 2012,289(15):45-50.
[5]Wang C, Zhang M, Cheng F, et al. Biodegradation characterization and immobilized strains' potential for quinoline degradation by Brevundimonas sp. K4isolated from activated sludge of coking wastewater [J]. Bioscience Biotechnology and Biochemistry, 2015,79(1):164-170.
[6]Wang J L, Wu W Z, Zhao X. Microbial degradation of quinoline:Kinetics study with Burkholderia pickttii [J]. Biomedical and Environmental Sciences, 2004,17(1):21-26.
[7]柏耀辉,孙庆华,温东辉,等.假单胞杆菌BC001对吡啶和喹啉的生物去除 [J]. 北京大学学报(自然科学版), 2008,44(2):237-242.
[8]朱顺妮,刘冬启,樊 丽,等.喹啉降解菌Rhodococcus sp.QL2的分离鉴定及降解特性 [J]. 环境科学, 2008,29(2):2488-2493.
[9]李 静,李文英.喹啉降解菌筛选及其对焦化废水强化处理 [J].环境科学, 2015,36(4):1385-1391.
[10]Bai Y, Sun Q, Sun R, et al. Bioaugmentation and adsorption treatment of coking wastewater containing pyridine and quinoline using zeolite-biological aerated filters [J]. Environmental science & technology, 2011,45(5):1940-1948.
[11]张玉秀,蒙小俊,柴团耀.苯酚降解菌红球菌(Rhodococcus sp.)P1的鉴定及其在焦化废水中的应用 [J]. 微生物学报, 2013, 53(10):1117-1124.
[12]Zhang P, Rong J, Zhang Y, et al. Quinoline-degrading strain Pseudomonas aeruginosa KDQ4 isolated from coking activated sludge is capable of the simultaneous removal of phenol in a dual substrate system [J]. Journal of Environmental Science & Health Part A Toxic/hazardous Substances & Environmental Engineering. 2016:51(13):1139-1148.
[13]Dueholm M S, Albertsen M, D'Imperio S, et al. Complete genome of Rhodococcus pyridinivorans sb3094, a methyl-ethylketone-degrading bacterium used for bioaugmentation. Genome Announc. 2014 May 29;2(3). pii: e00525-14..
[14]Sun Q, Bai Y, Zhao C, et al. Aerobic biodegradation characteristics and metabolic products of quinoline by a Pseudomonas strain [J]. Bioresource technology, 2009,100(21):5030-5036.
[15]Kaiser J P, Feng Y, Bollag J M. Microbial metabolism of pyridine, quinoline, acridine, and their derivatives under aerobic and anaerobic conditions. Microbiol Rev. 1996Sep;60(3):483-98.
[16]Zhu S N, Liu D Q, Fan L, et al. Degradation of quinoline by Rhodococcus sp. QL2isolated from activated sludge [J]. Journal of hazardous materials, 2008,160(2/3):289-294.
[17]Tuo B H, Yan J B, Fan B A, et al. Biodegradation characteristics and bioaugmentation potential of a novel quinoline-degrading strain of Bacillus sp. isolated from petroleum-contaminated soil [J]. Bioresource technology, 2012,107:55-60.
[18]Cui M, Chen F, Fu J, et al. Microbial Metabolism of Quinoline by Comamonas sp. [J]. World Journal of Microbiology & Biotechnology, 2004,20:539-543.
[19]Sun J Q, Xu L, Tang Y Q, et al. Degradation of pyridine by one Rhodococcus strain in the presence of chromium (VI) or phenol [J]. Journal of hazardous materials, 2011,191(1-3):62-68.
[20]张玉秀,尹 莉,李海波,等.焦化废水处理厂活性污泥对硫氰化物的降解机制 [J]. 环境化学, 2016,35(1):118-124.
Bioaugmentation and characteristics of a quinoline-degrading strain Rhodococcus sp
ZHANG Yu-xiu1*, DOU12311Meng-nan, ZHU Kang-xing, CHAI Tuan-yao, ZHANG Yi-ming, XU Wei-chao (1.School of Chemical & Environmental Engineering, China University of Mining & Technology (Beijing), Beijing 100083, China;2.Huozhou Secondary School of Shanxi, Huozhou 031400, China;3.College of Life Science, University of Chinese Academy of Sciences, Beijing 100049, China). China Environment Science, 2017,37(6):2340~2346
The bacterial strain Rhodococcus sp. KDQ2 capable of utilizing quinoline as sole carbon and nitrogen source, and energy was isolated from the activated sludge of a coking wastewater treatment plant. The optimum temperature and initial pH for quinoline degradation were determined to be 37℃ and 6~9, r espectively. KDQ2 degraded 96% of quinoline at a 200mg/L initial concentration within 24h, and its degradation kinetics could be described with Haldane’s model. KDQ2 was shown to be able to also utilize pyridine but not phenol. The removal of quinoline (150mg/L) was not inhibited by the presence of pyridine (150mg/L) and phenol (400mg/L) in 1d. KDQ2 was able to adapt to real coking wastewater containing high concentrations of quinoline, pyridine and phenol, KDQ2 coexisted with other microbes of activated sludge in aeration tank and notably improved the removal of quinoline and TOC.
coking wastewater;Rhodococcus sp.;quinoline;bioaugmentation
X172,TP028.8
A
1000-6923(2017)06-2340-07
张玉秀(1962-),女,陕西合阳人,教授,博士,主要从事废水生物处理研究.
2016-11-02
国家自然科学基金资助项目(31370281,U1632111);中央高校基本科研费基金资助项目(2010YH05)
* 责任作者, 教授, zhangyuxiu@cumtb.edu.cn
