Mce转运体ATP酶过表达对分枝杆菌转化植物甾醇的影响
2022-11-25姚莹莹徐倩倩周秀玲
姚莹莹,王 靖,徐倩倩,周秀玲,张 扬
(聊城大学生命科学学院,山东 聊城 252059)
甾体药物具有显著的抗过敏、抗感染、抗休克等生理和药理功能,特别是激素类甾体药物在消炎及内分泌调控等方面属刚需用药,其临床用药已超300余种,是仅次于抗生素的第二大类药物,市场前景十分广阔[1-3]。甾体药物的分子结构精巧且复杂,很难通过全合成法来生产。雄烯二酮(雄甾-4-烯-3,17-二酮,AD)作为甾体药物核心中间体可合成绝大部分激素类甾体药物。植物甾醇是广泛存在于植物中的甾体化合物,工业上主要是从植物油油脚中提取获得。植物甾醇具有廉价易得、环境友好以及无需深度纯化即可用于AD生产的特性[4]。以植物甾醇为底物,微生物合成AD技术体系的建立,为甾体药物工业化生产步入绿色化工时代奠定了坚实基础,为全球甾体医药行业的可持续发展开辟了新的途径[5]。
虽然有多个种属的微生物被证实具有AD生产能力,例如分枝杆菌属、节杆菌属、短杆菌属、假单胞菌属和红球菌属等,但仅有分枝杆菌属菌株被成功用于工业化生产[6-7]。分枝杆菌能耐受高浓度有机环境、转化植物甾醇生产AD,是理想的工业生产菌[8]。但植物甾醇较低的水溶性(<0.1 mmol·L-1)及菌株摄入能力导致菌株转化周期长、转化效率低[9]。因此,提高菌株对植物甾醇的转运能力有利于AD的生产。在结核分枝杆菌和耻垢分枝杆菌中,脂肪酸和甾醇的摄入是由庞杂的Mce转运系统完成的,基因转录水平分析和敲除研究表明,在4种组成Mce转运系统的体系中,Mce4体系是胆固醇摄取所必需的[10-12]。Mce4体系由6种细胞壁相关Mce蛋白、2种Mce相关膜蛋白、2种渗透酶、2种孤立的Mce相关膜蛋白以及1种ABC转运体ATP酶(MceG)组成[13]。其中,MceG作为Mce4体系的能量提供者是必需的。在绝大部分含有Mce转运体基因簇的放线菌中都有MceG同源物[14]。在缺失MceG的情况下,耻垢分枝杆菌不能利用胆固醇或植物甾醇作为碳源[15]。同样,结核分枝杆菌中mceG的缺失显示出胆固醇摄入缺陷,并导致其对小白鼠侵染能力的降低[16]。He等[17]将Mycobacteriumtuberculosis的MceG和Mce4转运体系2个膜蛋白基因yrbE4A和yrbE4B经密码子优化后在菌株Mycobacteriumsp.MS136中进行表达,重组菌9α-羟基-4-雄甾烯-3,17-二酮的产量提高了20%。因此,MceG作为Mce4转运体系唯一的能量供应ATP酶,对Mce4转运体系摄取植物甾醇具有重要意义。基于此,作者以分枝杆菌Mycobacteriumsp.LZ2(M.sp.LZ2)的Mce转运体ATP酶(LzMceG)为研究对象,在同源序列比对的基础上获得lzmceG基因全长序列信息,并进行生物信息学分析,构建LzMceG过表达菌株,并对重组菌株的生长和植物甾醇转化能力进行检测,以研究LzMceG过表达对分枝杆菌转化植物甾醇的影响。
1 实验
1.1 菌株、质粒与引物
原始菌株:分枝杆菌Mycobacteriumsp.LZ2(M.sp.LZ2),保藏于聊城大学生命科学学院。克隆宿主:EscherichiacoliDH5α,用于重组质粒的构建和保存。表达型质粒pMV261:分枝杆菌和E.coli的穿梭质粒,卡那霉素抗性,用于MceG的过表达。本研究所使用的引物信息见表1。
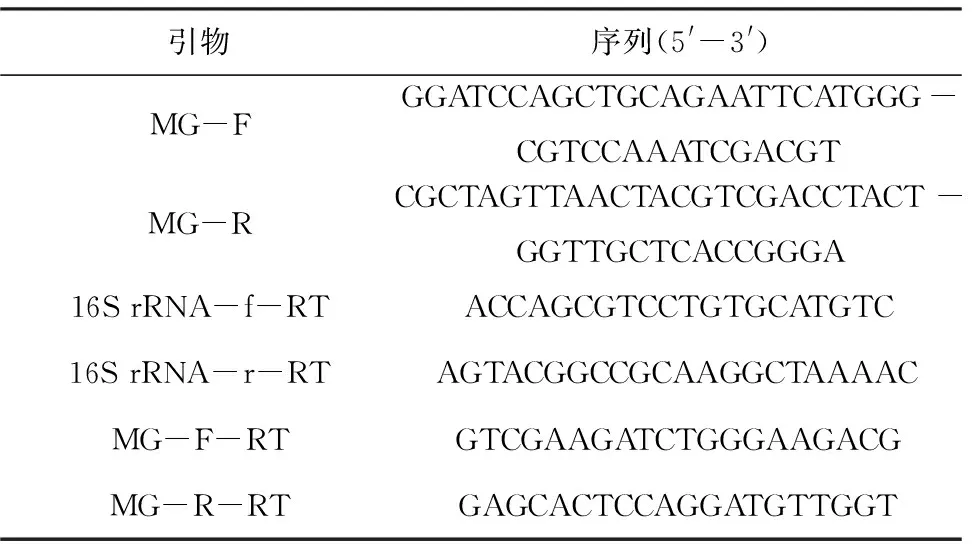
表1 引物信息Tab.1 Information of primers
1.2 试剂、培养基与仪器
植物甾醇,陕西林洲生物科技有限公司;环糊精,山东滨州智源生物科技有限公司;酵母提取物、胰蛋白胨、胶回收试剂盒、质粒提取试剂盒、过氧化氢酶活性检测试剂盒、溶菌酶,北京索莱宝科技有限公司;限制性内切酶、DNA Marker、卡那霉素、即用型无缝克隆试剂盒,生工生物工程(上海)股份有限公司;Taq DNA聚合酶、实时荧光定量PCR(RT-qPCR)试剂盒,北京全式金生物技术有限公司;RNA提取试剂盒,天根生化科技有限公司;细菌活性检测试剂盒,碧云天。
LB(Luria-Bertani)培养基:氯化钠10 g·L-1,胰蛋白胨10 g·L-1,酵母粉 5 g·L-1;pH值 7.0,121 ℃、高压灭菌20 min。
LB固体培养基:LB培养基中加入20 g·L-1琼脂粉。
M.sp.LZ2斜面培养基:K2HPO40.5 g·L-1,MgSO4·7H2O 0.5 g·L-1,柠檬酸 2 g·L-1,丙三醇 2 g·L-1,葡萄糖0.5 g·L-1,碳酸钙 10 g·L-1;pH值 7.0,115 ℃、高压灭菌20 min。
M.sp.LZ2种子培养基:K2HPO40.5 g·L-1,MgSO4·7H2O 0.5 g·L-1,柠檬酸 2 g·L-1,丙三醇 2 g·L-1,葡萄糖0.5 g·L-1;pH值 7.0,115 ℃、高压灭菌20 min。
M.sp.LZ2发酵培养基:葡萄糖10 g·L-1,柠檬酸 2 g·L-1,MgSO4·7H2O 0.5 g·L-1,K2HPO40.5 g·L-1,(NH4)2HPO43.5 g·L-1,环糊精 38 g·L-1,植物甾醇 5 g·L-1;pH值 7.2;葡萄糖115 ℃、高压灭菌20 min,其它成分121 ℃、高压灭菌20 min。
UV752N型紫外可见分光光度计,上海佑科仪器仪表有限公司;T100型梯度基因扩增仪,美国Bio-Rad公司;ZF-288型全自动凝胶成像分析系统,上海嘉鹏科技有限公司;Infinite M200型多功能酶标仪,奥地利TECAN公司;UltiMate 3000型高效液相色谱仪,美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1lzmceG基因全长序列信息获取
目前,M.tuberculosisH37Rv的MceG研究较为深入,利用BLAST的blastn程序以其MceG的mkl基因(Gene ID:888081)序列为查询序列,与M.neoaurumVKM Ac-1815D全基因组进行比对分析,获得相似度最高的基因序列。根据其基因序列信息设计引物(MG-F/MG-R),以M.sp.LZ2基因组为模板,PCR获得目的基因片段,切胶回收纯化后,送上海生工生物测序以获得lzmceG基因全长序列信息。
1.3.2 LzMceG生物信息学分析
LzMceG的理化性质、信号肽、跨膜结构域、亚细胞定位及结构域,分别使用ProtParam、SignalP Server、TMHMM Server、PSORTb及Conserved Domains(CDD)数据库进行分析和预测。LzMceG的三级结构同源性建模使用SWISS-MODEL完成。利用ClustalX进行同源序列比对,比对结果导入到MEGA 7中,使用邻接法(Neighbor-Joining)及自长支持率(bootstrap)1 000次重复构建LzMceG系统进化树。
1.3.3 LzMceG表达质粒构建
使用引物MG-F/MG-R,以M.sp.LZ2全基因组为模板,PCR扩增获得含有lzmceG基因的核苷酸片段。将所获得的PCR产物进行切胶回收,-80 ℃保存备用。从质粒pMV261的保存菌株E.coliDH5α/pMV261中提取质粒pMV261,利用限制性内切酶SalⅠ和EcoRⅠ进行双酶切,酶切产物经切胶回收后与含有lzmceG基因的核苷酸片段连接。连接体系及操作按照即用型无缝克隆试剂盒说明书进行。取10 μL连接产物,42 ℃热激化转至E.coliDH5α中,经孵育、抗性筛选获得阳性克隆。挑选3~5个阳性克隆抗性培养后提取质粒,进行PCR及测序验证。将验证正确的重组质粒命名为pMV261-lzmG,质粒保存菌株命名为E.coliDH5α/pMV261-lzmG。
1.3.4 重组质粒电转化及阳性克隆筛选
扩培E.coliDH5α/pMV261-lzmG,利用质粒提取试剂盒获得浓度为100~150 ng·μL-1的重组质粒。取10 μL重组质粒加入到100 μLM.sp.LZ2感受态细胞中,轻轻混匀,冰浴预冷25 min后,加入到同样预冷的1 mm电转杯中,在1.5~2.0 kV电压下电击4~5 ms;电击结束后迅速冰浴静置5 min,同样条件下再次电击,然后冰浴静置10 min。向电转杯中加入700 μL LB培养基,充分混匀后转入无菌离心管中,在30 ℃、200 r·min-1条件下活化4~5 h。活化后的菌液在室温下5 000 r·min-1离心4 min,弃500 μL上清液;将剩余的菌液混匀后涂布至含卡那霉素(50 μg·mL-1)LB平板上,于30 ℃培养箱静置培养4~6 d。挑取阳性克隆于装有抗性LB培养基的试管中,在30 ℃、200 r·min-1条件下,摇床振荡培养3~4 d,提取质粒,进行双酶切及测序验证。将验证正确的重组菌株命名为M.sp.LZ2/pMV261-lzmG。
1.3.5 RNA提取和RT-qPCR分析
分别将M.sp.LZ2和M.sp.LZ2/pMV261-lzmG在发酵48 h和72 h时取样收集菌体。按照RNA提取试剂盒说明书提取样本总RNA。按照RT-qPCR试剂盒说明书推荐的反应体系及条件,进行逆转录和定量PCR。以16S rRNA作为内参基因,使用2-ΔΔCt方法分析lzmceG基因的转录水平。
1.3.6 产物分析
在摇瓶中进行M.sp.LZ2和M.sp.LZ2/pMV261-lzmG生产能力评估,在30 ℃、200 r·min-1条件下培养168 h,每间隔24 h取样一次。向发酵样品中加入等体积乙酸乙酯,超声30 min,12 000 r·min-1离心10 min;吸取100 μL上清液,室温挥干后,用80%甲醇重悬样品,超声30 min,12 000 r·min-1离心20 min,经0.22 μm滤头处理后进行HPLC分析。色谱条件:C18色谱柱(250 mm×4.6 mm),柱温30 ℃,流动相甲醇-水(8∶2,体积比),流速1 mL·min-1,检测波长254 nm,进样量10 μL。M.sp.LZ2能将小部分产物AD进一步转化为雄甾-1,4-二烯-3,17-二酮(ADD)。因此,M.sp.LZ2转化植物甾醇的产物包括AD和ADD,其转化得率(%)按下式计算:
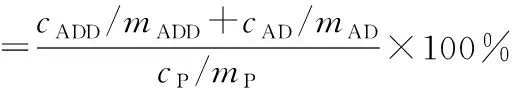
式中:cADD、cAD和cP分别为ADD、AD和植物甾醇的浓度,g·L-1;mADD、mAD和mP分别为ADD、AD和植物甾醇的摩尔质量,g·mol-1。
2 结果与讨论
2.1 lzmceG基因克隆
将M.tuberculosisH37Rv的MceG的mkl基因序列与M.neoaurumVKM Ac-1815D全基因组进行比对分析,发现与定位标签(locus tag)编号为D174_06445的基因序列相似度最高,为81.7%,其被注释为ABC transporter ATP-binding protein,位于基因组(GenBank ID:NC_023036)1 335 918~1 336 994位。根据D174_06445信息设计引物MG-F/MG-R,以M.sp.LZ2全基因组为模板,PCR扩增获得全长为1 077 bp的lzmceG基因核苷酸片段。
2.2 LzMceG生物信息学分析(表2)
由表2可知,LzMceG氨基酸数量为358,分子量为39 394.29 Da,等电点为5.68,不稳定指数为47.98,属于不稳定蛋白;不具有信号肽和跨膜结构域;主要分布在细胞质中,属于胞内酶;CDD数据库比对分析发现,LzMceG在第5~255位具有1个主结构域,该结构域属于ABC转运体MlaF超家族,是一类重要的ATP酶。

表2 LzMceG生物信息学分析预测结果Tab.2 Prediction results of bioinformatics analysis of LzMceG
为了研究LzMceG的进化关系,将其氨基酸序列在NCBI数据库中进行BLAST比对,根据比对结果选取21条不同物种的氨基酸序列构建系统进化树(图1)。结果表明,MceG广泛存在于细菌中;M.sp.LZ2中的LzMceG与非致病分枝杆菌MycolicibacteriumfortuitumATCC 6841汇集成一支,然后与MycolicibacteriumsmegmatisMC 2155汇集,再与致病分枝杆菌M.lepraeTN和M.tuberculosisH37Rv形成的分支汇集成一支。因此,MceG在分枝杆菌中有较高的保守性,与其它物种具有一定的差异。
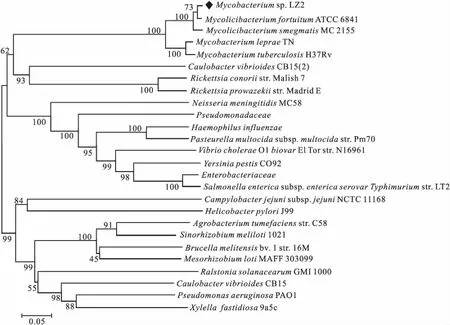
图1 基于氨基酸序列的LzMceG系统进化树Fig.1 Phylogenetic tree of LzMceG based on amino acid sequences
综上,可确定LzMceG属于Mce转运体ATP酶。在M.tuberculosisH37Rv中Mce转运体ATP酶对胆固醇的摄取有显著的影响[10,16]。因此,推测在M.sp.LZ2中LzMceG对Mce转运体功能的发挥,特别是甾醇类物质的摄入具有重要作用。
2.3 重组菌株M.sp.LZ2/pMV261-lzmG的验证(图2)
由图2可知,PCR目的条带大小与mceG目的基因大小(约1 040 bp)一致,重组质粒pMV261-lzmG双酶切条带大小约为4 800 bp和1 040 bp,符合预期。对验证正确的质粒进行测序,结果表明pMV261-lzmG成功转入M.sp.LZ2中,重组菌株M.sp.LZ2/pMV261-lzmG构建成功。

M.DNA marker 1.重组质粒pMV261-lzmG双酶切验证 2.重组质粒pMV261-lzmG的PCR验证图2 重组菌株M.sp.LZ2/pMV261-lzmG的验证 Fig.2 Validation of recombinant strain M.sp.LZ2/pMV261-lzmG
2.4 lzmceG基因转录水平分析
为进一步研究M.sp.LZ2中LzMceG与AD生产能力的关系,对M.sp.LZ2和M.sp.LZ2/pMV261-lzmG中lzmceG基因的转录水平进行检测,结果如图3所示。
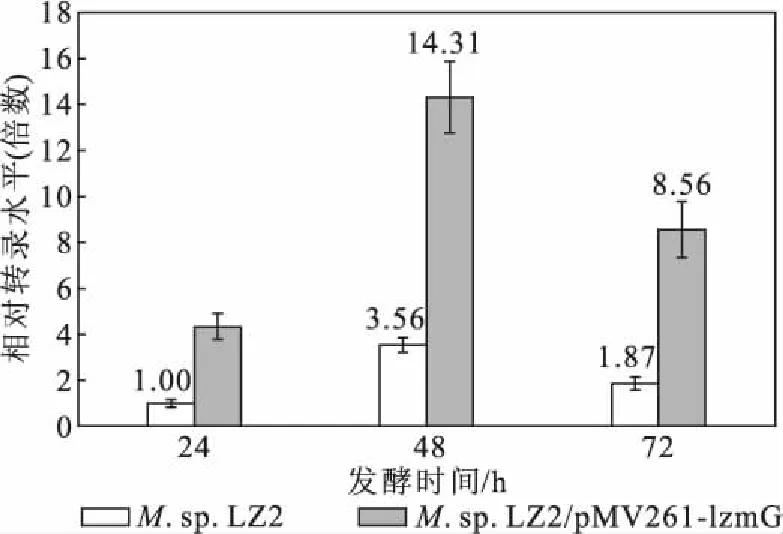
图3 M. sp. LZ2和M. sp. LZ2/pMV261-lzmG发酵不同时间时的lzmceG基因转录水平Fig.3 Transcription levels of gene lzmceG in M. sp. LZ2 and M. sp. LZ2/pMV261-lzmG at different fermentation time
由图3可知,以M.sp.LZ2中lzmceG基因在24 h的转录水平为基准进行比较,发现M.sp.LZ2在48 h的lzmceG基因转录水平明显升高,是24 h的3.56倍;虽然在72 h 的lzmceG基因转录水平有所降低,但依然维持在较高水平,是24 h的1.87倍。M.sp.LZ2/pMV261-lzmG中lzmceG基因转录水平的变化趋势与M.sp.LZ2的相似。在相同时间点,M.sp.LZ2/pMV261-lzmG中lzmceG基因的转录水平均比M.sp.LZ2有较大幅度升高,在48 h和72 h分别是M.sp.LZ2对应转录水平的4.02倍和4.58倍。表明,当植物甾醇开始转化为AD时(48 h),lzmceG基因的转录水平有所升高,MceG对植物甾醇转化具有重要作用。M.sp.LZ2/pMV261-lzmG中lzmceG基因转录水平的升高也说明MceG过表达菌株构建成功。
2.5 MceG过表达对菌株生长的影响(图4)
由图4可知,M.sp.LZ2/pMV261-lzmG和M.sp.LZ2具有相似的菌体生长趋势,但在24 h内,M.sp.LZ2/pMV261-lzmG所获得的生物量略低于M.sp.LZ2。这可能是由于,MceG过表达导致菌株代谢负荷增加。在48 h后,M.sp.LZ2/pMV261-lzmG的生物量始终高于M.sp.LZ2;在168 h时,M.sp.LZ2/pMV261-lzmG所获得的生物量最高,为4.71 g·L-1,高于M.sp.LZ2的(4.44 g·L-1)。此外,M.sp.LZ2/pMV261-lzmG的最高比生长速率为0.045 h-1,高于M.sp.LZ2的(0.035 h-1)。这可能是由于,MceG的过表达增强了Mce4转运体系的能量供给,从而提高了植物甾醇的转运能力。植物甾醇被转运到胞内后,经甾醇侧链降解途径代谢,除会生成3分子NADH和2分子FADH2外,还会生成3分子丙酰辅酶A和1分子乙酰辅酶A;这些含有高能硫酯键的辅酶A类物质经代谢后会生成18分子NADH和7分子FADH2。如果所产生的还原型辅酶全部经呼吸链用以ATP的生成,则1分子β-谷甾醇代谢为1分子AD,最多可生成80分子ATP[17-18]。因此,菌株摄取植物甾醇能力的增强会增加ATP的生成量,为菌株的生长提供更多的能量,有利于菌株的生长。
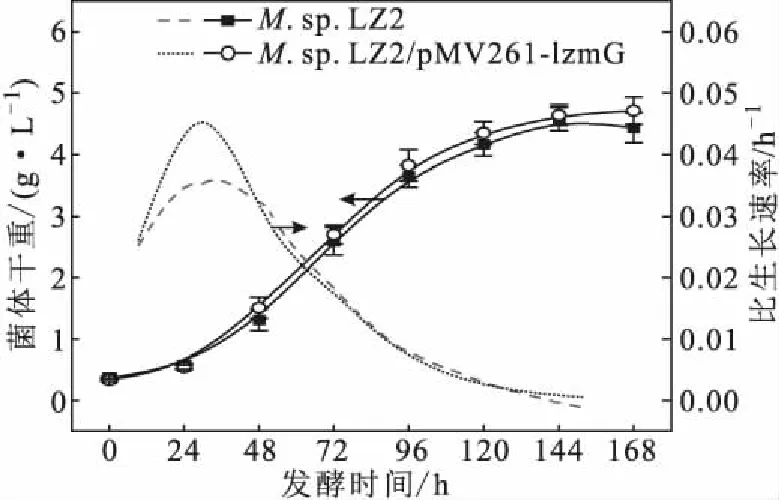
图4 MceG过表达对菌株生长的影响Fig.4 Effect of MceG over-expression on growth of strain
2.6 LzMceG过表达对菌株葡萄糖消耗和AD生产能力的影响
在AD生产中,如果以植物甾醇为单一碳源将会大大延长菌株生长的延滞期,生产效率极低。现普遍采用葡萄糖和植物甾醇的双底物发酵模式来解决这一问题。LzMceG过表达有利于植物甾醇的转运,可能会对菌株葡萄糖消耗和AD生产能力产生影响。对M.sp.LZ2和M.sp.LZ2/pMV261-lzmG转化过程中的葡萄糖消耗和AD生产能力进行连续监测,结果如图5所示。
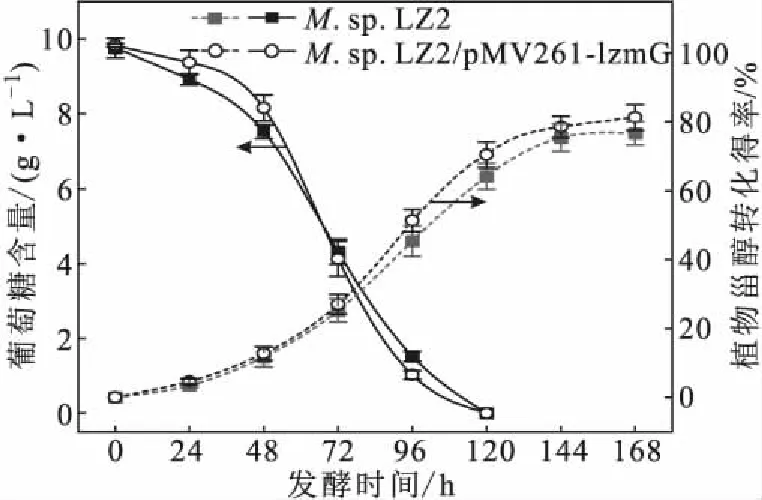
图5 LzMceG过表达对菌株葡萄糖消耗和AD生产能力的影响Fig.5 Effect of LzMceG over-expression on glucose consumption and AD production capacity of strain
由图5可知,在72 h前,M.sp.LZ2/pMV261-lzmG的葡萄糖消耗量低于M.sp.LZ2的;72 h后,M.sp.LZ2/pMV261-lzmG的葡萄糖消耗量高于M.sp.LZ2的。在植物甾醇转化能力方面,M.sp.LZ2/pMV261-lzmG的植物甾醇转化得率始终高于M.sp.LZ2的;特别是在72 h后,M.sp.LZ2/pMV261-lzmG的植物甾醇转化得率明显高于M.sp.LZ2的;M.sp.LZ2/pMV261-lzmG的最高植物甾醇转化得率为81.32%,比M.sp.LZ2(76.69%)高4.63%。这可能是由于,48 h前,植物甾醇摄入的增加降低了葡萄糖的消耗;48 h后,植物甾醇的代谢增强,需要转录表达大量甾醇侧链降解酶,菌株对物质和能量的需求加速了葡萄糖的消耗。LzMceG过表达最有益的效果就是提升植物甾醇的转运能力,从而提高M.sp.LZ2的AD生产能力。
3 结论
以M.sp.LZ2基因组为模板,获取lzmceG基因全长序列,生物信息学分析结果表明,LzMceG分子量为39 394.29 Da,不具有信号肽和跨膜结构域;胞内酶结构域分析表明,MceG是一种ATP酶,属于ABC转运体MlaF超家族;系统发育分析表明,MceG在分枝杆菌中有较高的保守性。转录水平分析表明,MceG能够响应植物甾醇的代谢,对植物甾醇转化具有重要作用。利用表达型质粒pMV261构建LzMceG过表达菌株M.sp.LZ2/pMV261-lzmG,与原始菌株M.sp.LZ2相比,重组菌株具有较高的生物量(4.71 g·L-1)和比生长速率(0.045 h-1)。表明,LzMceG的过表达增强了Mce4转运体系的能量供给,提高了植物甾醇的转化能力。菌株摄取植物甾醇能力的增强会增加ATP的生成量,为菌株的生长提供更多的能量,有利于菌株的生长。植物甾醇转化得率分析结果表明,M.sp.LZ2/pMV261-lzmG的最高转化得率(81.32%)比M.sp.LZ2高。因此,LzMceG在M.sp.LZ2转化甾醇的过程中具有重要作用,过表达LzMceG对植物甾醇的转化具有积极作用。
