抗结团剂对CHO细胞悬浮培养的影响
2022-11-24张燕娜章郭真李刚
张燕娜,章郭真,李刚
(1.复旦大学 生命科学学院,上海200438;2.上海济煜医药科技有限公司,上海201203)
近年来,随着生物医药行业的迅速发展,动物细胞生产的重组蛋白需求量急剧增加,中国仓鼠卵巢细胞(CHO)细胞已成为细胞表达单克隆抗体培养系统的重点和热点。然而,人源化重组蛋白的加工只能通过哺乳动物细胞培养来实现,因此一个优质成功的细胞培养工艺对整个药物开发过程显得尤为重要[1]。为能满足日益壮大的市场需求,大分子添加剂减少剪切损伤的使用,使悬浮培养得到广泛应用[2]。在悬浮培养中,为了满足营养成分的需求,20世纪90年代后,流加培养开始受到更多学者的青睐[3]。细胞培养工艺的改进和优化为细胞的大规模培养提供了助力。一个完整的工艺过程可以分为准备阶段(设备的准备、清洗消毒、培养基的配制和过滤以及细胞种子的准备、扩增与检测)、细胞培养阶段(细胞接种、培养工艺参数设定、添加补料及其他添加物等)和产物收获阶段(培养上清液的预处理、蛋白测定及质量分析等),根据不同细胞株的特点,实际开发中培养工艺各有不同。
在悬浮培养中,细胞在次优的生长条件下会形成聚集,发生结团现象,导致细胞代谢出现异常,乳酸堆积,细胞存活率降低,影响蛋白表达产量及质量。对于细胞结团的问题,有研究认为结团可能是由于脱氧核糖核酸(DNA)从死亡的细胞间释放后,在细胞与细胞之间架桥引起的,若在培养基中添加脱氧核糖核酸酶I(DNase I)可以避免结团现象的发生[4]。但是DEE等[5]则认为通过添加肝素、硫酸葡聚糖及硫酸戊糖等高度磺化硫酸聚阴离子物质,可成功解决BTITN5BI-4昆虫细胞的结团问题,使蛋白表达量显著提高。同时也有研究表明,添加浓度为25 mg/L的硫酸葡聚糖(分子量为5 000 Da)能避免细胞的结团现象,同时能提高最大细胞密度和蛋白表达量[6]。
细胞培养工艺的稳健是细胞培养放大和生产的关键。本文添加的抗结团剂为商业化产品,其主要成分是硫酸葡聚糖。在动物细胞培养过程中常会发生细胞结团现象,当发生黏附结团时,聚集团内的细胞微环境会发生恶化,出现供氧不足、代谢废物积累、营养物质不足等问题,从而导致细胞的死亡。在实验中添加主要成分为带负电荷的硫酸葡聚糖的抗结团剂可以改变细胞表面的电荷,使细胞维持单细胞形态,从而改善其生存环境。然而,抗结团剂在细胞培养产物纯化过程中需要去除并测定残留量,加上抗结团剂价格昂贵,应用抗结团剂时除了要考虑工艺优化,还要注意降低成本。因此,本文对在细胞培养不同阶段添加抗结团剂对细胞生长代谢、蛋白表达量及质量的影响进行了研究。
1 材料与方法
1.1 细胞株和培养基
本实验所用的CHO-S和CHO-K1细胞由上海济煜生物科技有限公司提供。
Dynamis无血清基础培养基,美国Gibco公司;Cellboost7a/7b补料培养基,美国Hyclone公司;抗结团剂ACA,美国Gibco公司。
1.2 细胞培养
(1)种子链阶段:分别复苏CHO-S和CHO-K1细胞各2支,一支添加ACA,一支不添加,置于125 mL摇瓶,并在120 r/min、36.5 ℃、5%CO2以及70%湿度的摇床中进行培养,当细胞生长至2~4 d,进行一次传代扩增,培养基及添加物与复苏时保持一致。传代扩增四代,进行流加培养阶段接种。
(2)流加培养阶段:将种子链传代扩增至第四代的细胞接种至3 L生物反应器,初始培养体积1.2 L,pH控制在6.95±0.25,溶氧控制为40%,搅拌转速为165 r/min。流加培养过程中通过补料补糖维持葡萄糖在0.5~7.0 g/L,每天取样计数监测细胞生长状态及生化指标。细胞培养至14 d,进行蛋白浓度分析,并对收获液进行亲和层析后,分析关键质量。
1.3 仪器与设备
Vi-cell XR型细胞存活率分析仪,美国Beckman Coulter公司;Multitron型二氧化碳摇床,瑞士Infors公司;Bioprofile Flex2型生化分析仪,德国Nova Biomedical公司;TSGP10型恒温水浴锅,美国ThermoFisher公司;ABL90 Flex型血气分析仪,丹麦Radiometer公司;my-control型生物反应器,荷兰Applikon公司。
1.4 分析方法
活细胞密度和细胞活率采用台盼蓝染色法。采用细胞计数仪自动计数,血气分析仪检测pH,生化分析仪检测葡萄糖、乳酸和渗透压。
抗体浓度采用HPLC-Protein A法检测;抗体纯度采用SEC-HPLC和CE-SDS分析;PI及电荷异构体采用iCIEF法分析。
细胞倍增时间(DT)代表细胞翻一倍所需的时间,是衡量细胞生长快慢的指标。DT按公式(1)计算。

式中:DT为倍增时间,h;t为培养时间,h;N0为接种后起始细胞数,个/mL;Nt为培养t时间后的细胞数,个/mL。
产物表达量Titer主要由单个细胞的产物比生产速率(Qp)和累计活细胞密度(IVCD)共同决定。其中单个细胞的产物比生产速率(Qp)代表细胞异源表达重组蛋白的能力。Qp和IVCD按公式(2)和公式(3)计算。
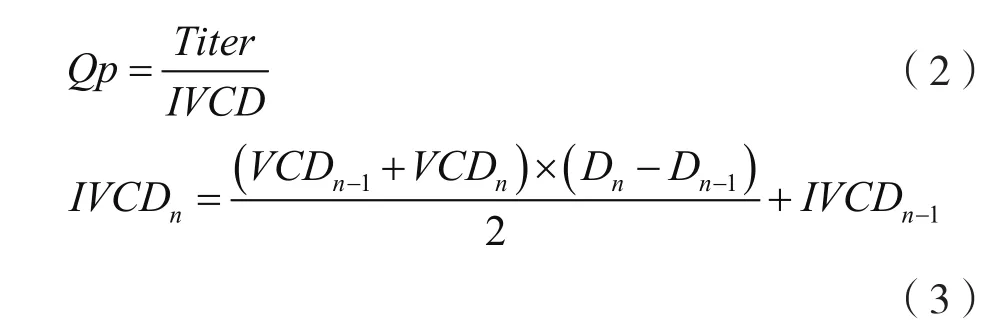
式中:Titer为产物表达量,g/L;Qp为单个细胞的产物比生产速率,pg/(个·d);Dn和Dn-1分别为,;VCDn和VCDn-1分别为第n天和第n-1天活细胞密度,个/mL;IVCDn和IVCDn-1分别为第n天和第n-1天累计活细胞密度,个/mL;当n=0时,IVCD=VCD。
1.5 数据分析
采用GraphPad Prism7软件的t检验分析添加和不添加ACA组细胞倍增时间之间是否存在显著差异,P<0.05表明有显著性差异,反之差异不显著。
2 结果与分析
2.1 种子链阶段
种子链细胞培养是将细胞液从冻存管中复苏,随着细胞密度的增长和活率的恢复,每隔2~3天换液扩增,直至达到接种生物反应器的需求量。种子链过程中细胞的密度一定程度上影响细胞扩增的代次,细胞的活率反映细胞的存活状况。
图1(a)为CHO-K1细胞在种子链阶段的生长状况。添加ACA的实验组细胞密度明显高于不添加ACA对照组。如表1所示,添加ACA实验组细胞倍增时间变化较小,随着细胞恢复和传代次数的增加,细胞倍增时间也在缩短,从复苏代P1的24.80 h缩短至P5的21.90 h。在没有添加ACA的对照组中,细胞倍增时间变化较为明显,随着细胞恢复和传代次数的增加,细胞倍增时间大体上也在缩短,从复苏代P1的33.64 h缩短至P5的22.47 h。随培养时间和传代次数的增加,两个组别差距在缩小,但添加ACA组的生长仍然优于不添加组。
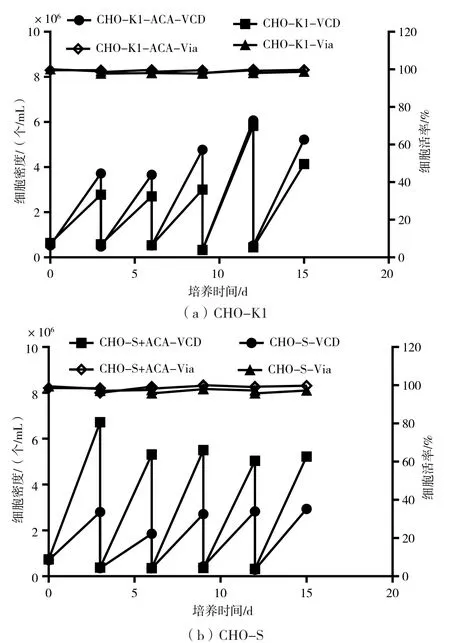
图1 种子链细胞密度及活率
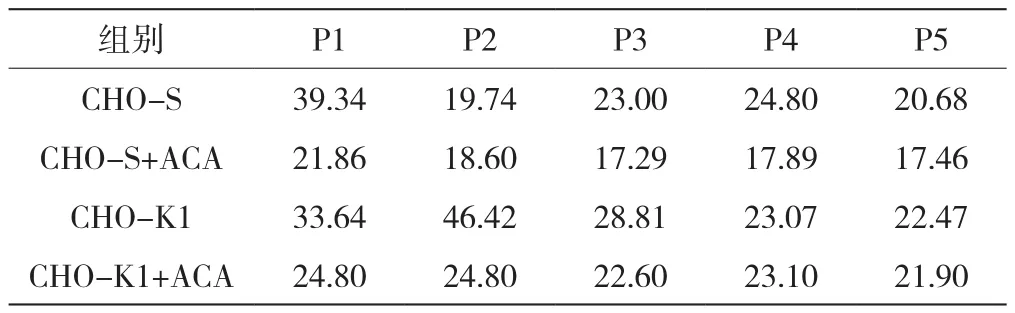
表1 种子链细胞倍增时间(单位:h)
图1(b)为CHO-S细胞在种子链阶段的生长状况。在不添加ACA培养的摇瓶中,通气搅拌以及pH等无法精确控制,加之CHO-S细胞本身的结团特性,培养中不添加ACA的对照组细胞有肉眼可见的细胞碎片,且细胞生长密度明显较低,细胞活率略低。由表1可知,不添加ACA组的倍增时间相对于添加ACA的实验组明显较长。对于添加ACA细胞,从复苏开始,倍增时间变化较小,随着细胞恢复和传代次数的增加,细胞倍增时间也在缩短,从复苏代P1的21.86 h缩短至P5的17.46 h。在没有添加ACA的培养组中,细胞倍增时间变化较为明显,随着细胞恢复和传代次数的增加,细胞倍增时间明显缩短,从复苏代P1的39.34 h缩短至P5的20.68 h。种子链阶段添加ACA能明显改善CHO-S细胞的生长状态,使其处于较优的培养环境中。
对CHO-S和CHO-K1细胞的倍增时间做t检验分析,发现CHO-S细胞种子链两个组细胞有显著差异(P<0.05);CHO-K1细胞种子链两个组细胞在t检验分析中虽有差异,但不显著。在工艺开发过程中,种子链阶段细胞的生长状况直接影响细胞种子链扩增的代数和培养周期,也会间接影响流加阶段细胞的稳定代谢,而ACA的添加对种子链细胞培养有积极作用。
2.2 流加阶段
2.2.1 流加阶段细胞生长及代谢
流加培养能够调节培养环境中的营养物质浓度,避免有些营养成分在初始阶段浓度过高而影响细胞的生长代谢以及产物的形成,也能防止某些限制性营养成分在细胞培养的过程中被耗尽而影响细胞的生长代谢以及产物的形成。本实验采用种子链添加ACA的实验组细胞进行流加培养阶段接种。流加培养在细胞进入对数期开始对细胞进行流加补料培养,控制葡萄糖浓度在0.5~7.0 g/L。
图2为CHO-K1细胞在流加培养阶段细胞生长和代谢状况。两个组别细胞均在第2天进入对数生长期,细胞快速生长。在第5~7天处于平台期,细胞密度及活率处于一个稳定的状态。第8天开始,由于培养环境中营养成分、细胞代谢废物以及培养时间的影响,细胞活率和活细胞密度开始下降。整个培养过程中,pH维持在无控制作用区(6.95±0.25),乳酸呈现先上升后下降的趋势。生长代谢方面,两个组别细胞表现出高度的一致性。
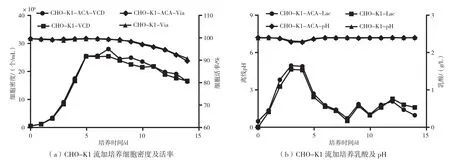
图2 CHO-K1细胞流加培养生长代谢
如图3所示,CHO-S细胞在流加培养阶段添加ACA,代谢出现异常,在培养至第6天时,细胞活率明显下降,乳酸代谢从消耗转为再次生产,并不断累积,导致细胞培养液pH下降,渗透压上升。流加阶段未添加ACA组细胞生长正常,培养至第14天时收获。整个培养过程中渗透压随培养时间和补料的添加逐渐增加,乳酸呈现先生成再下降最后有再次生成的趋势,收获时乳酸为1.05 g/L,在可接受范围内;pH在无控制作用区(6.95±0.25)。

图3 CHO-S细胞流加培养生长代谢
2.2.2 流加阶段细胞产物生成
生物反应器中进行细胞流加培养,控制溶氧在40%、搅拌速度为265 r/min、pH无控制作用区为6.95±0.25以及0.1 m3/(m3·min)的恒定通气速率。培养过程中,监测细胞的生长代谢状况,定量流加补料,以满足细胞生长的营养需求[7]。
表2为流加培养结束时蛋白的表达量、单个细胞的蛋白比生产速率和累计活细胞密度。在CHO-K1细胞中,两个组别的蛋白表达量均大于7 g/L,且相差不大。单个细胞产蛋白的能力接近,Qp均在29 pg/(个·d)。两个组别细胞活细胞密度生长趋势具有一致性,累计活细胞密度差异不大。由于表达系统的区别,添加ACA的CHO-S细胞代谢异常,终止培养;没有添加ACA组的细胞最终蛋白产量为3.20 g/L,Qp为12.76 pg/(个·d),能够满足工艺要求。

表2 流加培养蛋白表达和累计活细胞密度
2.2.3 细胞培养产物质量
抗体类药物属于结构复杂的生物大分子,在细胞培养、分离纯化以及保存运输等过程中容易发生不均一性变化,如C末端氨基酸发生突变,形成二聚体和多聚体等结构变异,而这些变异会严重影响药物的临床效果和安全性能。而在流加培养中,有毒物质和代谢废物的积累对目的蛋白的质量有不利影响[8]。本实验中主要通过SEC-HPLC、iCIEF、CE-SDS分析检测蛋白的质量,其中SEC-HPLC和CE-SDS都是分析产品纯度和杂质的重要方法,SEC-HPLC侧重聚体分析,CE-SDS侧重片段分析。iCIEF主要用于分析产品的等电点和电荷异质性。而细胞培养工艺条件对抗体异质性的影响非常显著[9]。
由表3可知,在CHO-K1细胞中,两个组别SEC单体纯度均大于97%、iCIEF主峰均大于73%、CE-SDS主峰大于92%,添加ACA对蛋白的关键质量没有明显的影响,两个组别蛋白质量高度一致。在CHO-S细胞中,iCIEF主峰较低,碱性峰较大,这是由于CHO-S表达系统,C端赖氨酸变体的存在。
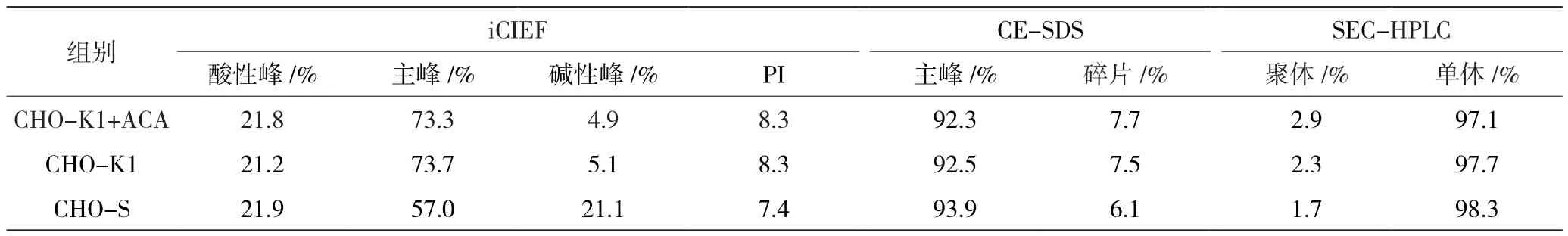
表3 细胞流加培养蛋白质量
3 结论
抗结团剂的添加可以改变细胞表面的电荷,使细胞呈现单细胞状态,从而改善细胞的生存微环境。CHO-K1和CHO-S细胞在种子链阶段添加ACA均能改善种子细胞状态,促进种子生长速度,缩短其倍增时间。对于CHO-K1细胞,添加和不添加ACA组在细胞生长、细胞代谢、蛋白表达量以及质量方面均没有明显差异。CHO-S细胞流加培养阶段添加ACA会出现代谢异常,如乳酸异常堆积、pH下降、细胞活率迅速下降,因此提前终止培养;CHO-S细胞流加培养阶段不添加ACA时,细胞生长、细胞代谢、蛋白表达量及蛋白质量均正常,符合预期。结合细胞培养代谢的稳定性、工艺的复杂度以及后续放大成本考虑[10-11],CHO-K1和CHO-S细胞培养中,只需在其种子链扩种期间添加ACA以改善种子生长状态。
