油茶果壳多糖的提取工艺及免疫活性研究
2022-11-24林欣颖谢传奇
林欣颖,谢传奇
(1.江西省科学院应用化学研究所,江西南昌,330096;2.厦门大学 医学院,福建厦门 361104)
油茶(Camellia oleiferaAbel),属于山茶科、山茶属小乔木,被当作我国重点发展的第一大木本油料作物,拥有相当悠久的种植历史,与油棕、油橄榄和椰子共称世界四大木本食用油料植物[1]。油茶在榨油的过程中会产生大量废弃物,其中油茶果壳是主要的榨油剩余物之一,其质量超过了油茶果全部质量的60%[2],因此其储量非常丰富。但是目前油茶果壳主要还是被人们当作没有用的垃圾直接丢掉或者焚烧,没有得到高值化利用[3]。对油茶果壳这种非木质化资源进行研究开发,不仅能节约资源,还能在一定程度上保护生态环境,产生一定的经济效益。
多糖是一类天然高分子化合物,在生物界中广泛存在,具有抗肿瘤、抗氧化、抗衰老、降血糖和降血脂等多种药理活性。研究表明,油茶果壳含有丰富的多糖[4-5],基于此,本研究采用响应面法对油茶果壳多糖的提取工艺进行优化,并通过细胞实验对其免疫活性进行初步评价,以期为油茶果壳资源的开发利用提供新的思路。
1 材料与方法
1.1 材料与试剂
油茶果壳,江西省恩泉油脂有限公司。
葡萄糖、苯酚,分析纯,国药集团化学试剂有限公司;浓硫酸,分析纯,天津致远化学试剂有限公司;DMEM高糖培养基(货号SH30604.01),美国HyClone公司;胎牛血清(批号NTC-HK026),阿根廷Natocor工业;青链霉素(货号B540732)、PBS(货号E607008)、胰蛋白酶(货号A003702)、台盼蓝(货号A601140)、MTT(货号A100793),上海生工生物工程股份有限公司;亚硝酸钠,分析纯,上海凛恩科技发展有限公司;LPS(货号L8880)、DMSO(货号D8371),北京索莱宝科技有限公司;对氨基苯磺酸、醋酸、α-萘胺,均为分析纯,阿拉丁试剂(上海)有限公司。
1.2 仪器与设备
运邦2500A多功能粉碎机,永康市速锋工贸有限公司;B-260恒温水浴锅,上海亚荣生化仪器厂;Infinite 200 PRO酶标仪,瑞士TECAN公司;ME204E电子天平,梅特勒-托利多仪器有限公司;Cell Mate二氧化碳培养箱,新加坡Esco公司;ECLIPSE Ts2倒置显微镜,日本NIKON公司;TD50002A电子天平,上海衡际科学仪器有限公司。
1.3 实验方法
1.3.1 油茶果壳多糖的提取
将油茶果壳粉碎,过60目筛,置于锥形瓶中,按照一定的提取温度、提取时间和料液比进行浸提,提取温度选择60 ℃、70 ℃、80 ℃、90 ℃和100 ℃5个水平;提取时间选择20 min、40 min、60 min、80 min和100 min5个水平;料液比选择1∶10(g∶mL)、1∶20(g∶mL)、1∶30(g∶mL)、1∶40(g∶mL)和1∶50(g∶mL)5个水平。采用控制变量法分别进行单因素实验,考察温度变量时,提取时间为60 min、料液比为1∶30(g∶mL);考察提取时间变量时,温度为80 ℃、料液比为1∶30(g∶mL);考察料液比变量时,温度为80 ℃、提取时间为60 min。随后抽滤,取上清液,再经过80%乙醇醇沉,25%活性炭脱色初步纯化,即得到油茶果壳粗多糖。
1.3.2 葡萄糖标准曲线的绘制
精准称取0.01 g干燥至恒重的无水葡萄糖,将其配制成浓度为1 mg/mL的标准溶液,继而依次将其稀释为 400.00 μg/mL、200.00 μg/mL、100.00 μg/mL、50.00 μg/mL、25.00 μg/mL、12.50 μg/mL 以 及6.25 μg/mL的标准溶液。经过适当调整,取标准溶液0.2 mL于离心管中,加入0.1 mL 5%的苯酚溶液,充分混匀,再加入0.5 mL硫酸混匀后将其放置于40 ℃水浴30 min,以流动水冷却至室温,使用酶标仪于490 nm波长处测定其吸光度。以葡萄糖浓度为横坐标,吸光度为纵坐标,建立葡萄糖标准曲线。得到葡萄糖标准品浓度(xmg/mL)与吸光度y的回归方程:y=10.534x+0.202 8,R2=0.994 2。
1.3.3 多糖含量的测定
精密移取0.2 mL上清液于离心管中,加入0.1 mL 5%的苯酚溶液,混合均匀,加入0.5 mL硫酸再次混匀后置于40 ℃水浴30 min,流水冷却直至室温,于490 nm波长处测定其吸光度。根据葡萄糖标准曲线计算出总多糖浓度,再按公式(1)计算出总多糖含量。

式中:P为待测样品中的总多糖含量,mg/g;C为代入葡萄糖标准曲线后所得的提取物样液的总多糖浓度,mg/mL;V为提取物样液的体积,mL;N为稀释倍数;M为待测样品质量,g。
1.3.4 响应面优化实验设计
使用Design-Expert 8.0软件,在得到了单因素实验结果的基础上,通过Box-Behnken对提取温度(A)、提取时间(B)、料液比(C)3个因素进行试验,通过数据分析优化油茶果壳多糖提取工艺。因素与水平见表1。

表1 Box-Behnken实验设计的因素与水平
1.3.5 Griess实验
用PBS将亚硝酸钠稀释成系列浓度1.563 μmol/L、3.125 μmol/L、6.250 μmol/L、12.500 μmol/L、25.000 μmol/L、50.000 μmol/L 和 100.000 μmol/L,每个浓度设置2个平行,每个孔加100 μL对应浓度的亚硝酸钠。然后每个孔再加100 μL配制好的Griess试剂,室温振荡10 min,使用酶标仪于540 nm处测吸光度,得到线性方程y=0.005 3x-0.003 4,R2=0.999 7,其中x为NO浓度(μmol/L),y为吸光度。
分别设置空白组、对照组、LPS阳性对照组以及药物组。取处于对数生长期的RAW264.7细胞进行细胞计数,将密度调整为5×105个/mL并于96孔板中接种,100 μL/孔,空白组加无血清培养液100 μL/孔,边缘均填充 PBS,200 μL/孔,37 ℃培养箱中培养过夜。用无血清培养液配制多糖样品浓 度 分 别 为 25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL、800 μg/mL 和 1 600 μg/mL备用;LPS配制为2 μg/mL。空白组、对照组加无血清培养液100 μL/孔,LPS组加100 μL 2 μg/mL的LPS溶液,药物组分别加100 μL不同浓度的多糖样品,37 ℃孵育24 h。小心转移100 μL上清液至一个新的96孔板中,并加入100 μL配制好的Griess试剂,在室温下振荡10 min,于540 nm处测定吸光度,将其代入上述线性方程式中即可获得NO的浓度。
1.3.6 MTT实验
如1.3.5处理细胞,吸走上清后,每孔加入10 μL MTT溶液,避光,37 ℃孵育4 h。小心吸走上清液,加入DMSO 150 μL/孔,室温振荡10 min,于492 nm处测定其吸光度,并按公式(2)计算细胞存活率。

1.4 数据分析
所有实验均重复3次,实验结果以平均值±标准差(±s)表示,响应面实验选用Design expert 8.0软件进行数据分析。细胞实验结果采用GraphPad Prism 8进行数据统计和显著性分析。
2 结果与分析
2.1 提取温度对总多糖含量的影响
如图1所示,提取温度在60~90 ℃时,总多糖含量随着提取温度的升高而增大,90 ℃时总多糖含量达到最大值。此后继续升高温度,总多糖含量有所下降,因此最佳提取温度选择为90 ℃。这可能是因为提取温度低于90 ℃时,随着温度的不断升高,分子热运动速度加快,多糖溶出的速率也随之增快;而超过90 ℃时温度过高,导致多糖发生降解[6],所以总多糖含量降低。此外,高温也会导致其他杂质溶于溶剂的速度增快,不利于实验的进行。

图1 温度对总多糖含量的影响
2.2 提取时间对总多糖含量的影响
如图2所示,提取时间的长短对总多糖含量有明显的影响。提取时间在20~60 min时,随着提取时间的增加,总多糖含量呈现出上升趋势,并且在60 min达最大值,随后逐渐降低,因此最佳提取时间选择为60 min。当提取时间过短时,油茶果壳粉末与水未充分接触,因此不能将多糖充分提取出来,总多糖含量相对较低;但是当提取时间过长时,会对多糖的结构造成一定程度上的破坏[7],导致总多糖含量下降。

图2 提取时间对总多糖含量的影响
2.3 料液比对总多糖含量的影响
如图3所示,总多糖含量随着用水量的增加先是不断增加,在料液比为1∶30时达到最大,之后有所降低,故最佳料液比选择为1∶30(g∶mL)。料液比过高或过低都会对总多糖含量造成影响,过高会使油茶果壳粉末无法充分吸水[8],导致总多糖的提取率较低;比值过低则会导致提取出来的总多糖浓度过低。
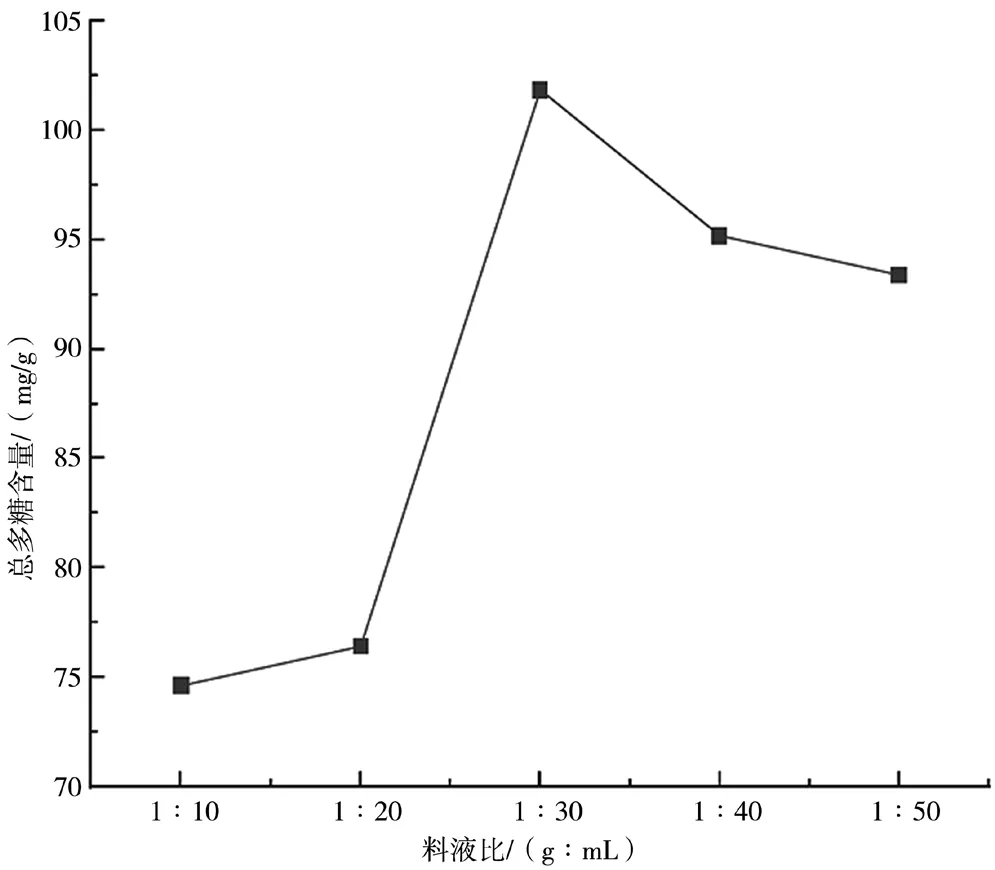
图3 料液比对总多糖含量的影响
2.4 响应面法对油茶果壳多糖提取工艺的优化
响应面法的实验结果见表2。运用Design expert 8.0数据分析软件对实验数据进行多元回归拟合,设提取温度、提取时间、料液比分别为A、B、C,以总多糖含量为响应值进行多元回归拟合,得到二次多项回归模型为Y=101.19+17.83A-2.31B-2.89C-0.14AB-2.99AC-4.69BC+1.32A2+1.45B2-0.53C2。

表2 响应面优化总多糖含量的实验设计与结果
进一步对模型及回归系数进行回归分析,总多糖含量模型及回归分析结果如表3所示。回归模型P<0.000 1(极显著),其失拟项P=0.272 8>0.050 0(不显著),说明模型拟合程度良好,可以对回归方程相应回归值进行预测,同时模型回归系数R2=0.975 4(>0.800 0),调节后的回归系数R2=0.943 7,表明94.73%的数据可用该模型解释,方程可靠性较高。
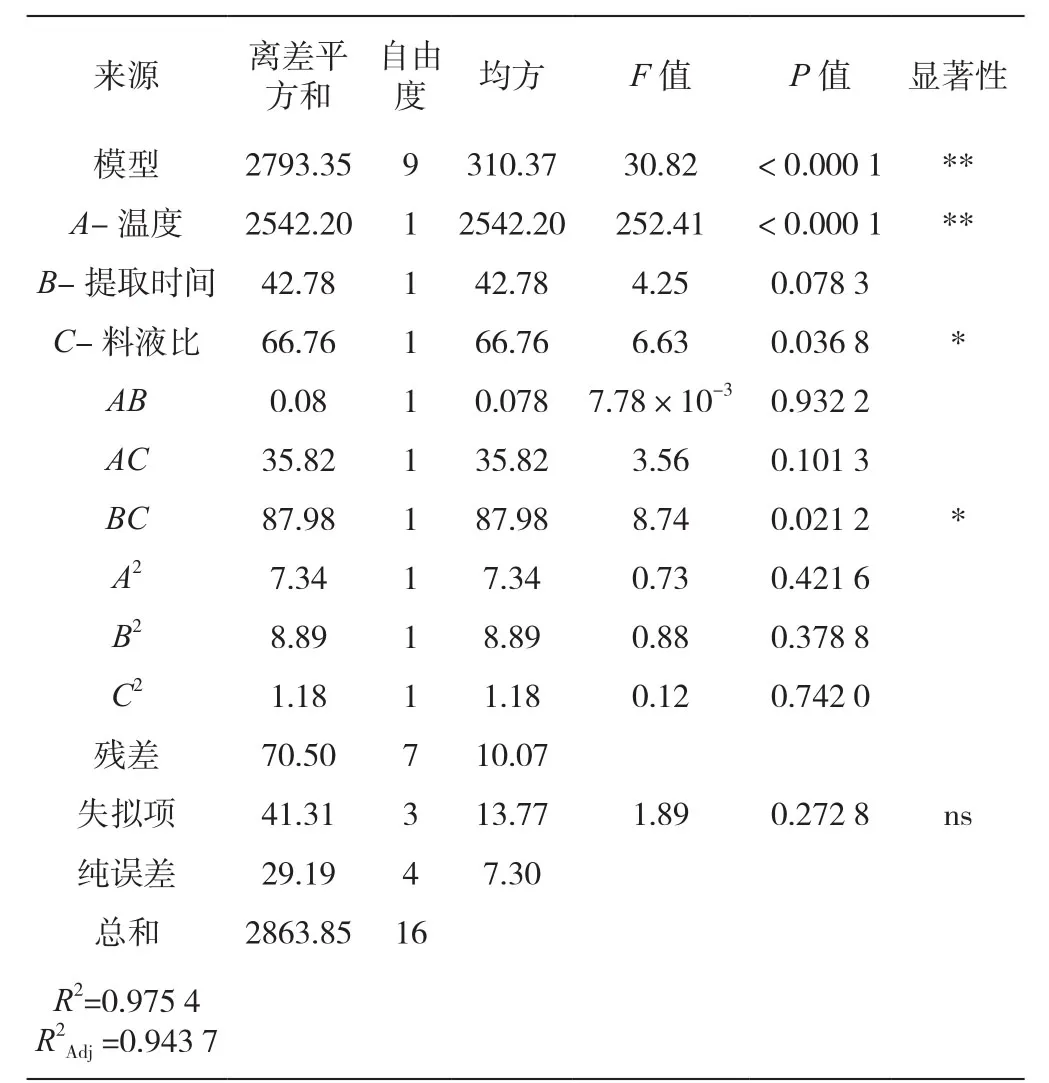
表3 总多糖含量模型及回归系数的回归分析结果
分析相关数据可知,一次项温度对总多糖含量的影响极显著(P<0.000 1),料液比对总多糖含量的影响显著(P<0.05),提取时间对总多糖含量的影响不显著(P>0.05)。分析各因素的主效应关系为A>C>B,即温度>料液比>提取时间。其二次项交互作用BC对总多糖含量的影响显著(P<0.05),AB、AC对总多糖含量的影响不显著(P>0.05)。
验证试验结果:根据回归方程模型,得到预测的最优条件为提取温度99.948 ℃、提取时间74.546 min、料液比1∶20.922(g∶mL),根据实际情况将该条件修正为提取温度100 ℃、提取时间74.5 min、料液比1∶21(g∶mL)(根据实验可调整的参数进行设置)。在此最优条件下经3次平行实验验证,得到实际的总多糖含量为126.0 mg/g(按照最优参数做实验得到结果),与预测值总多糖含量(127.2 mg/g)相差不大,证实了预测值和实验值之间的良好相关性。
2.5 油茶果壳多糖对RAW264.7细胞NO释放的影响
采用Griess法测定NO的释放量,用于指示油茶果壳多糖对巨噬细胞免疫活性的影响[9]。如图4所示,对照组中RAW264.7细胞所释放出的NO量比较少,为(1.84±0.45)μmol/L。阳性对照LPS组中RAW264.7细胞所释放出的NO量显著增加,为(32.34±0.64)μmol/L。当给药浓度逐渐增大时,RAW264.7细胞所释放出的NO量也随之增加,表现出一定的剂量依赖性,并且在给药800 μg/mL时达到最大[(34.71±1.93)μmol/L]。此外,油茶果壳多糖相较LPS而言,作用更为温和,浓度为12.5~400.0 μg/mL时,药物组中RAW264.7细胞所释放出的NO量[(9.87±1.76)~(31.37±2.37)μmol/L]要低于阳性对照LPS组[(32.34±0.64)μmol/L]。以上结果说明油茶果壳多糖具有一定的免疫调节活性。
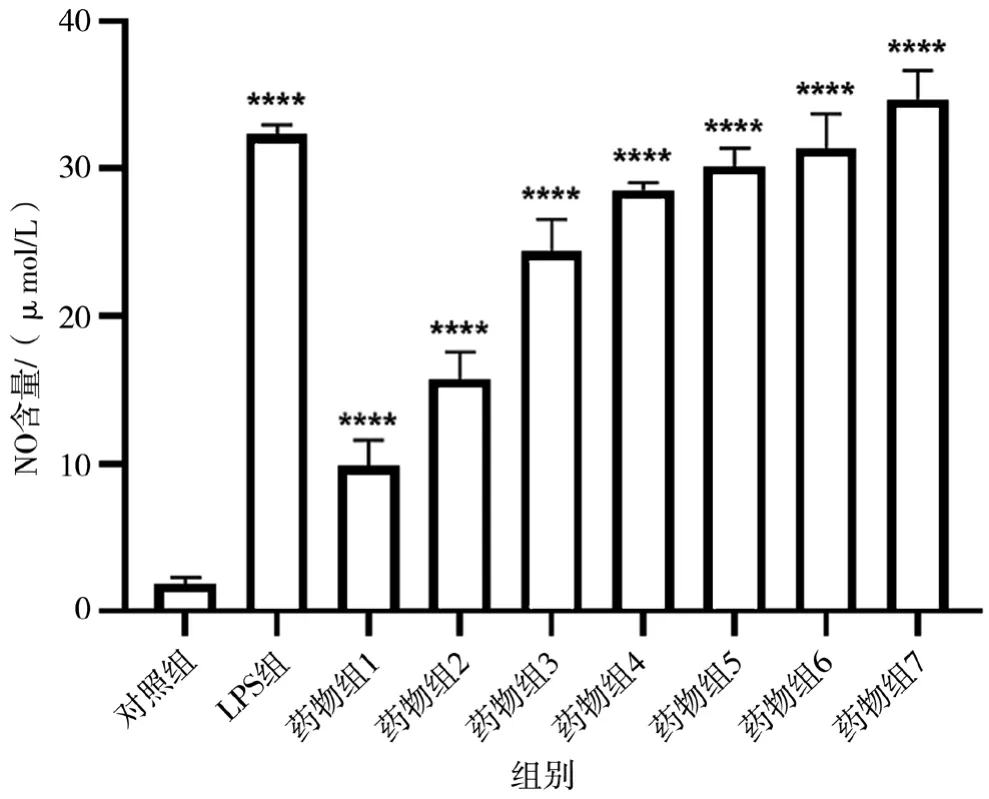
图4 油茶果壳多糖对NO释放的影响
2.6 油茶果壳多糖对RAW264.7细胞存活率的影响
采用MTT法测定细胞的存活率,用于指示油茶果壳多糖对RAW264.7细胞活性的影响程度。如图5所示,在浓度为12.5~50.0 μg/mL时,RAW264.7细胞的存活率高于对照组,说明在该浓度范围内油茶果壳多糖起到促进RAW264.7细胞增殖的效果,对其并无毒性。而当浓度在100.0~800.0 μg/mL时,RAW264.7细胞的存活率呈下降趋势,具有一定的抑制作用,但是其抑制率并未超过阳性对照LPS组,表明油茶果壳多糖对RAW264.7细胞存活率的抑制作用较弱。

图5 油茶果壳多糖对细胞存活率的影响
3 结论
本研究利用响应面法优化热水提取油茶果壳中的总多糖,能够较好地将多糖原有的结构保留下来,且方法成本低,操作较为简便。实验结果表明,油茶果壳总多糖的最佳提取工艺条件为温度100 ℃、提取时间74.5 min、料液比为1∶21(g∶mL),预测可得总多糖含量127.2 mg/g,经3次平行试验实际得到总多糖含量为126.0 mg/g,与预测值较为接近,表明该提取条件可行。此外,细胞实验显示油茶果壳多糖具有较强的免疫调节活性,值得进一步深入研究。
