乳酸菌对米香型白酒发酵过程中乳酸和乳酸乙酯产生的影响研究
2022-11-24梁振荣郝俊光李官连叶静萱万瑞杰吴金燕周碧宇
张 龙,梁振荣,郝俊光,李官连,叶静萱,万瑞杰,吴金燕,周碧宇,罗 丹
(1.劲牌广西天龙泉酒业有限公司,广西河池 546400;2.钦州市食品风味分析与调控重点实验室,北部湾大学食品工程学院,广西钦州 535011)
酯类化合物是白酒中最重要的一类香气成分,主要由它们区分各类不同香型的白酒[1-3]。酯类化合物形成的途径有两个,一是酵母菌合成产生的酯类,这是主要的途径;二是白酒在蒸馏和存储过程中发生酯化反应,从而产生酯类化合物,这一途径在常温下反应比较缓慢,需要很长时间的平衡,酯类含量会不断增加[4]。米香型白酒香气组成主要为乳酸乙酯[5]。乳酸乙酯由乳酸和酯类发生反应形成[6]。白酒中的有机酸种类很多[7],含量较大的是乳酸和乙酸。酸类化合物具有维持酯的香气和调整酒的风味的作用[8]。这些酸类主要来源于微生物的发酵,另一部分来源于原料本身[9]。因此想要提高酒的风味品质[10],可以适当添加乳酸菌微生物进行发酵实验,对提高原酒酒体品质有重要的作用[11-12]。
米香型白酒是白酒四大香型之一,在两广地区非常流行,以大米作基础原料,小曲作辅助材料,经清洗、蒸煮、摊晾、半固态糖化发酵、蒸馏等多道工艺酿造出白酒,酒体协调饱满、浓郁且米香持久,因米香风格著称[13]。半固态法发酵[14]是米香型白酒工艺的特征,采取传统固态糖化和近代液态发酵联合法[15]。
白酒在发酵过程中以根霉菌[16]和酵母菌[17]为主要发酵微生物。为了使原酒得到更好的口感和风味,在白酒的酿制过程中会添加乳酸菌[18]。过量乳酸菌的存在会对白酒发酵产生负面影响,所以在生产中可通过控制乳酸菌的数量来控制乳酸乙酯的含量,以保证白酒的品质[19]。目前,米香型白酒在市场上呈现风味多样化,不同工厂的风味物质分布差异非常大[20]。关于米香型白酒接入乳酸菌对发酵过程乳酸和乳酸乙酯变化的影响少有报道,有待进一步细化研究[21]。针对乳酸菌在中国白酒发酵中的地位及作用并未有相关深入研究报道[22]。本研究从米香型白酒发酵液中分离的8 株乳酸菌和2 株实验室乳酸菌中筛选出高产乳酸菌,以不添加乳酸菌实验作空白对比[23],跟踪优化菌株发酵过程的乳酸变化,以期阐明乳酸菌对米香型白酒中乳酸和乳酸乙酯的重要影响。
1 材料与方法
1.1 材料、试剂及仪器
材料:米香型白酒发酵醪,广西天龙泉酒业有限公司;米根霉曲,糖化力34 g/100 g,广西天龙泉酒业有限公司。
菌种及耗材:酵母菌,发酵力37 %vol,广西天龙泉酒业有限公司;晚稻大米,淀粉含量75 %,南宁市欣和福粮油有限公司;乳酸菌,广西天龙泉酒业有限公司。
仪器设备:Alliance 高效液相色谱仪,配备2695HPLC 分离单元、2996 PDA 检测器、Empower工作站,美国Waters 仪器公司;DK-98-II 电热恒温水浴锅,天津市泰斯特仪器有限公司;INNOVA 43R落地式低温摇床,上海巴玖实业有限公司;H1850高速离心机,湖南湘仪实验室仪器开发有限公司;ME204E 电子天平,梅特勒-托利多仪器(上海)有限公司;Cascada I 实验室超纯水系统,美国Pall 公司;0.22 µm SLGP 033RB 针头滤膜,美国Millipore公司;PHS-3E 雷磁pH 计,上海仪电科学仪器股份有限公司等。
1.2 实验方法
1.2.1 乳酸菌种子的培养
乳酸菌来源:从醪液中筛选和实验室乳酸菌。从醪液中筛选:取发酵天数靠前和靠后的醪液分离乳酸菌,表现在MRS 培养基平板上有溶解碳酸钙的透明圈的大乳白、小灰白,且微凸的为乳酸菌菌落,经过分离[24],得到8 株乳酸菌。对从白酒醪中分离出的8 株乳酸菌和实验室现有的2 株乳酸菌进行分离和筛选[25],然后把筛选出的较优菌株进行产酸[26]、耐酸[27]、耐酒精实验[28],得到优选菌株2 株,分别进行发酵实验。
1.2.2 米香型白酒发酵工艺流程
洗米→蒸煮→搅拌摊晾→入罐→下曲搅拌→固态糖化→加水发酵→蒸馏
1.2.3 米香型白酒发酵工艺要点
(1)洗米:取1 kg米,淘洗2~3次即可。
(2)蒸饭:按1∶1 的比例加入1 L 自来水,摇匀,使大米摊平于电饭锅中煮20 min,保温5 min 后可进行下一步骤。把勺子或筷子一起放入灭菌锅,121 ℃灭菌30 min,备用。
(3)搅拌摊晾:趁热取出米饭搅拌,使米饭降温到30 ℃左右。
(4)入罐:尽量在安全无菌条件下,把米饭转移到灭过菌的固定罐中。
(5)下曲搅拌:称量成品混合酒曲(根酶∶酵母=1∶10)1%,即10 g 曲倒撒在饭面上,用灭菌过的勺子或者筷子搅拌均匀。乳酸菌的接入则是在搅拌与糖化之间进行的。
(6)固态糖化:放入恒温烘箱30 ℃下糖化24 h,即可加水转入发酵。
(7)加水发酵:按照130%的比例加水1.3 L,放入30 ℃恒温培养箱,发酵从加水时开始算起,发酵13 d。
(8)蒸馏:发酵到15 %vol~18 %vol 即可停止发酵,开始蒸馏。
1.2.4 优选乳酸菌的筛选实验
(1)产酸实验。比较实验室乳酸菌菌株和从醪液中分离的乳酸菌菌株的产酸能力。从MRS 固态培养基斜面上选取的菌株和实验室乳酸菌菌株,在米曲汁培养基中活化2~3 次;通过加热使MRS 液态培养基内微生物和活细胞全部消灭后取10 mL,把经挑选取得的一到两环乳酸菌菌群接入其中,摇床37 ℃下恒温培养1 d,取培养液0.1%接到50 mL灭过菌的MRS液态培养基内,在30 ℃下培养48 h,酸碱滴定法(GB/T 12456—1990)测定其总酸度,用吉尔涅尔度°T 表示,用精密度高的pH 计检测其游离酸度。每样品重复2次。
(2)耐酒精实验。经过一级筛选后的乳酸菌菌株,再进行耐酒精性检测,将耐受酒精力较好的菌株保管好。将筛选出的菌株按1 %比例分别接种于溶液体积为20 mL 且乙醇含量分别为0%、4%、8%、12%、16%的米曲汁培养基,37 ℃下培养24 h后再分别培养48 h,测定其在检测波长605 nm 下的OD值和对应pH值。每株菌做2次重复测定。
(3)不同pH 值对优选菌株生长和产酸能力的影响。取含乳酸菌的液态MRS 培养基富集培养24~36 h,取旺盛生长期的富集液,按1 %接种量接入20 mL 的MRS 液态培养基内,培养基的pH 值分别为2、3、4、5、6、7,30 ℃培养36 h,在检测波长为605 nm 处测OD 值和培养后含乳酸菌的MRS 肉汤培养液的pH值。
(4)筛选的乳酸菌生长曲线测定。把乳酸菌经过活化后接入到MRS 肉汤内,在30 ℃、60 r/min 摇晃震荡箱中培养,每隔2 h,采用紫外分光光度计测波长605 nm 处OD 值,记数,以未添加菌株的MRS肉汤当作空白对照。绘出筛选后菌株的生长曲线。可以通过OD值进行乳酸菌活菌计数。
1.3 发酵米酒理化指标检测方法
1.3.1 取样与检测
因需检测发酵过程的理化变化,连续检测各个理化检验指标,在发酵第1 天、第4 天、第7 天、第10天和第13 天的同一个时间段分别取样检测分析。根据各指标数据随时间变化趋势进行讨论分析。每个样品测2~3次,取平均值。
1.3.2 酒精度测定
参考GB/T 15038—2006 的方法用酒精计法测蒸馏后的发酵液。
1.3.3 总酸的测定
参考GB/T 15038—2006 的方法用指示剂法测蒸馏后的酒的总酸。用0.1 mol/L 浓度的NaOH,用指示剂滴定法测过滤离心发酵醪液的总酸。
1.3.4 pH值测定
将样品过滤离心,磁力搅拌器作辅助,pH 计直接法测发酵液。
1.3.5 乳酸的测定
利用液相色谱法检测乳酸的含量,色谱条件参考《超高效液相色谱法对白酒乳酸含量的检测》[29]。
1.3.6 乳酸乙酯的测定
利用气相色谱法检测乳酸乙酯的含量,色谱条件参考《米香型白酒中甲醇、乳酸乙酯和β-苯乙醇的气相色谱法测定》[5]。
2 结果与分析
2.1 优选菌株筛选
2.1.1 乳酸菌的分离
经过检测分离、纯化富集从白酒醪液不同发酵时间不同罐中分离出有较明显溶钙圈的8 株乳酸菌,其中3 罐有4 株命名为TLQ-L1—4,5 罐有两株为TLQ-L5 和6,14 罐有两株为TLQ-L14 和TLQ-L15,2 株实验室乳酸菌为TLQ-gtpp1和TLQgtpp2。
2.1.2 乳酸菌产酸能力的筛选
菌株产酸能力较强的有从白酒醪液不同发酵时间不同罐中分离出的有较明显溶钙圈的3 株乳酸菌,分别为3 罐的TLQ-L4,5 罐的TLQ-L5,14 罐的TLQ-L14,以及2 株实验室乳酸菌TLQ-gtpp1 和TLQ-gtpp2。随着总酸的升高,pH 值越低。其中TLQ-gtpp2 的酸度最高为63°T,pH2.99。分离乳酸菌总酸度与pH值见表1。
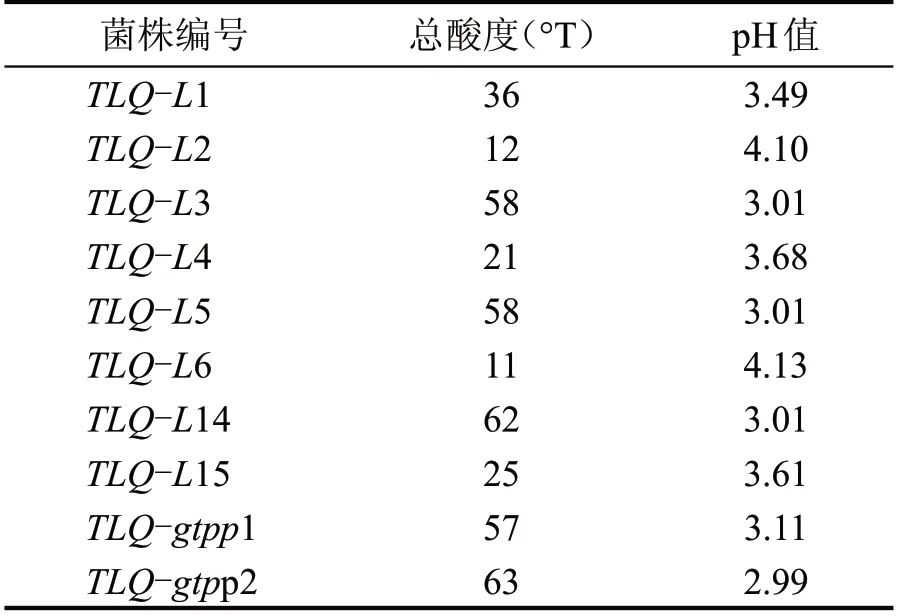
表1 分离乳酸菌的总酸度和pH值
2.1.3 乳酸菌的耐酒精试验筛选
经过乳酸菌产酸实验筛选了5 株菌株,分别为TLQ-L3、TLQ-L5、TLQ-L14、TLQ-gtpp1 和TLQgtpp2,在此基础上进行耐酒精能力筛选。培养48 h 后,在波长为605 nm 下测定其pH 和OD 值,见图1和图2。

图1 培养48 h培养基中pH值变化

图2 培养48 h培养基中OD值变化
在培养48 h 条件下菌株TLQ-gtpp1 和TLQgtpp2 生长情况受到抑制,pH 值偏高,最高为酒精度16 %vol 时TLQ-gtpp1 的pH4.6。菌株TLQ-L3、TLQ-L5 和TLQ-L14 生长情况较良好,受抑制状况不明显,最低pH 值为酒精度0 %vol 时的TLQ-L5,达到3.72。
在培养24 h 后分别培养48 h 条件下菌株TLQgtpp1 和TLQ-gtpp2 从酒精度0 %vol 到16 %vol 过程生长情况变化比较大,OD 值偏低,最高为TLQgtpp1OD 的0.892。菌株TLQ-L3、TLQ-L5 和TLQL14 从0 %vol 到16 %vol 过程生长趋势变化不大,受抑制状况不明显,最高OD 值为TLQ-L5 达到2.775。
据5 株乳酸菌菌株耐酒精实验,比较生长对数期内OD 值上升,且pH 值下降较快的菌株,可知,菌株TLQ-L3、TLQ-L5 和TLQ-L14 的耐酒精能力较好,故选TLQ-L3、TLQ-L5 和TLQ-L14 作为发酵菌株进行米酒发酵。
2.1.4 不同pH 值对所筛选乳酸菌菌株生长和产酸能力的影响
TLQ-L14、TLQ-L3 和TLQ-L5 在初始pH 值小于5 的MRS 液态培养基中均能较好的生长,TLQL14 在pH 值小于3.4 的MRS 液态培养基中不能生长,相比之下菌株TLQ-L3 和TLQ-L5 的耐酸能力要强于TLQ-L14;当pH 值高于6 时,3 株菌株生长开始部分受到抑制,繁殖量和产酸能力开始有所下降。不同pH 值对所筛选乳酸菌生长和产酸能力的影响见图3。

图3 不同初始pH值对所筛选菌株生长能力的影响
综合以上实验结果可知,TLQ-L14、TLQ-L3 和TLQ-L5 菌株的最适生长初始pH 为4.5~6,TLQL3 和TLQ-L5 菌株生长繁殖量和产酸能力较好,耐酸能力较强。
2.1.5 筛选乳酸菌的生长曲线测定
在4~8 h 后菌株TLQ-L3 和TLQ-L5 进入对数生长期,稳定期是在18~20 h 后。培养4 h 后TLQL3 的活菌数为2.6×106CFU/mL,TLQ-L5 的活菌数为3.8×106CFU/mL,进入稳定期后TLQ-L3 的最大活菌数可达到1.5×108CFU/mL,TLQ-L5 的最大活菌数可达到2.8×108CFU/mL。筛选过后的乳酸菌菌株的生长曲线测定见图4。

图4 筛选乳酸菌的生长曲线
由图4 可知,菌株TLQ-L3 和TLQ-L5 生长需要的pH值范围大致相同,相比之下TLQ-L5的耐酸性要强于菌株TLQ-L3,在米酒生产过程中,米酒的pH 值一般不会低于3,所以菌株TLQ-L3 在发酵过程中的生长不会受到太多限制,故可分别采用菌株TLQ-L3和TLQ-L5进行发酵实验制作米酒。
2.2 优选菌株进行接种发酵对应理化检测
2.2.1 优选乳酸菌进行接种发酵
用菌株TLQ-L3 和TLQ-L5 进行发酵实验制作米酒,发酵期每隔3 d 取样进行检测分析。大量实验摸索发现在其他条件不变的情况下,5%乳酸菌添加量较为合适。根霉与酵母菌比例为10∶2,30 h糖化时间,根霉0 h 加入,乳酸菌8 h 加入,酵母22 h加入,30 h 后加水发酵产生的乳酸和乳酸乙酯含量比较高。测定接入优选菌株对原酒的发酵过程中乳酸、酒精产量、总酸、pH 值、乳酸乙酯产量的影响。
2.2.2 原酒中乳酸的含量变化
乳酸菌产生的乳酸是发酵过程中重要的代谢产物,乳酸在发酵中呈上升趋势,前期上升比较快,中期缓慢过渡,后期又上升较快。可以推测出前期乳酸菌生长繁殖较快,产酸能力较强,产酸量较高;中期乳酸产生速度缓慢,发酵过程产生的乙醇发生转化而被消耗;后期乳酸含量较多,是因为乳酸乙酯在后期开始水解成乳酸。相较于空白实验,直接添加乳酸菌的发酵实验的原酒中产生乳酸较高,相对于对照组,菌株TLQ-L3 提高了629.32 mg/L,菌株TLQ-L5 提高了717.22 mg/L。原酒中乳酸变化趋势见图5。
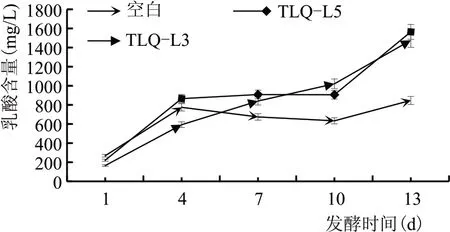
图5 原酒中乳酸的含量变化
2.2.3 原酒中酒精的含量变化
在发酵前到后期,接入乳酸菌的样品乙醇含量均低于空白,说明接入的菌株对于乙醇的产生起到一定的抑制作用,也可说明发酵过程中的酵母菌被接入的菌株抑制代谢活动。适量添加乳酸菌可对发酵微生物起促进作用,过量或者产酸能力极强的菌株会对发酵微生物起抑制作用。原酒中酒精的含量变化见图6。

图6 原酒中酒精的含量变化
2.2.4 原酒中总酸的含量变化
接入菌株TLQ-L3 和TLQ-L5 的样品总酸均高于空白,空白样品的总酸范围在0~1 g/L,接入TLQ-L5 菌株的样品总酸含量波动较大,呈先升再降再升趋势,菌株TLQ-L3 和空白则处于缓慢上升或者保持同一水平,可见直接添加乳酸菌能提高样品总酸含量。原酒中总酸的含量变化见图7。

图7 原酒中总酸的含量变化
2.2.5 原酒中pH值变化
由图8可知,pH值均在降低,样品为pH3~4之间,空白降低得比较缓慢,可见空白发酵液的pH 值变化不大,添入菌株TLQ-L3 和TLQ-L5 的样品变化幅度比空白大,pH 值波动幅度最大的TLQ-L5 在1.0上下。

图8 原酒中pH值变化
2.2.6 原酒中乳酸乙酯的含量变化
乳酸乙酯是由酸类和酯类发生简单反应而生成的,一定量乳酸乙酯的产生可使酒体感官更好。乳酸菌产生的乳酸乙酯在发酵中均呈上升状态,前期上升比较慢,推测乳酸菌前期主要进行生长繁殖;中后期较快,乳酸菌开始大量产酸,与乙醇结合反应生成乳酸乙酯,使乳酸乙酯含量增加。相较于空白发酵实验,添加了乳酸菌的发酵实验产生的乳酸乙酯较高。相对于对照组,菌株TLQ-L3 提高了489.7 mg/L,菌株TLQ-L5 提高了276.3 mg/L。原酒中乳酸乙酯的变化趋势见图9。

图9 原酒中乳酸乙酯的含量变化
3 结论
实验表明,不同乳酸菌的耐酒精度、耐酸和产酸能力不同,选取高耐酒精度的乳酸菌可以有效提高原酒中乳酸和乳酸乙酯的含量,说明优选产酸能力突出的乳酸菌对提高原酒中乳酸和乳酸乙酯的含量有重要作用,具体添加时机、添加量对原酒品质的影响有待细化,以明确乳酸菌对发酵出酒率、风味的整体影响。为进一步研究接入优选乳酸菌后米香型白酒发酵过程乳酸和乳酸乙酯含量变化差异提供理论基础,使优选乳酸菌对白酒发酵过程中风味物质的影响得到扩充和广泛的应用。
