安琪生香活性干酵母对浓香型强化大曲微生物群落结构及其挥发性风味组分的影响
2022-11-24潘天全关玉权陈兴杰杨金玉巩子路薛锡佳
潘天全,关玉权,陈兴杰,杨金玉,巩子路,薛锡佳,李 娜,代 森,程 伟
(安徽金种子酒业股份有限公司,安徽阜阳 236023)
中国白酒以大曲作为酿造的糖化、发酵、酒化与生香剂,大曲的微生物结构及其风味特征是大曲质量评价的重要依据,大曲品质对白酒的产率和品质具有重要影响[1]。大曲微生物结构对大曲风味及其原酒的风格和品质具有重要影响[2],研究大曲微生物结构及风味组分,对明确白酒风格特点具有重要意义。强化曲是采用微生物分离技术,筛选出能够充分提高酒曲性能的有益菌种,进行人工纯种培养,接种到酒曲中以强化其各项性能,从而进一步提高出酒质量[3]。纯种工艺技术的发展使得小曲的糖化发酵力普遍强于大曲,强化曲是将自然接种和人工接种相结合[4],提高酒曲的发酵性能。由于大曲的培养受自然界环境影响较大,导致大曲质量不稳定,因此,强化曲的研究主要集中在大曲强化方面。姚继承等[5]在大曲培养中加入酯化红曲霉,制备酯化率较高的强化大曲;冯雅芳等[6]将酵母菌、黑曲霉和红曲霉混合加入大曲培养过程中,大曲的综合指标得到了改善;陈雪玲等[7]在大曲中添加复合菌剂,大曲的糖化力、液化力、发酵力和酯化力等得到了显著提高;颜林春[8]将筛选到的10 株功能芽孢杆菌经纯种培养后加入到制曲原料中,制成的强化高温大曲符合一级高温大曲的质量控制指标。大曲的香气是大曲感官质量的重要指标,由于大曲中含有较多的色素与油脂,不宜采用液液萃取的前处理方法进行香气检测。顶空固相微萃取(HSSPME)作为大曲风味分析的前处理方法,可以有效减少底物及液态基质中干扰物质的影响。
当前,关于安琪生香活性干酵母作为强化菌剂培养强化大曲的应用研究还鲜有报道。本实验以传统的浓香型大曲工艺为基础,应用安琪生香活性干酵母培养强化大曲,采用MiSeq 高通量测序技术进行大曲微生物群落结构分析,采用HS-SPMEGC-MS 联用技术进行大曲挥发性风味组分分析,并进行成品曲的质量与感官对比。该研究有助于明确酵母强化大曲的微生物群落结构及其风味特征,为安琪生香活性干酵母等微生物制品的生产应用提供依据,并有利于强化大曲的培养工艺调整及质量调控。
1 材料与方法
1.1 材料、试剂及仪器
实验曲样:浓香型普通大曲与强化大曲(培曲时间均为28 d,培曲月份为春季的4—5 月);强化大曲应用安琪生香活性干酵母作为强化菌剂,在制曲压坯的拌料阶段添加。实验曲样由安徽金种子酒业股份有限公司生态酿酒基地制曲车间提供。
试剂耗材:2%浓度的琼脂糖凝胶,胶回收试剂盒,qiagen公司。
仪器设备:气相色谱-质谱联用仪(GC-MS,7890A+5975C,EI 源),安捷伦科技有限公司;57330-U 手动SPME 进样器,50/30 µm DVB/CAR/PDMS 固相微萃取头,美国Supelco 公司;恒温磁力搅拌器85-2,常州普天仪器制造有限公司;TGL-20M 高速冷冻离心机,上海卢湘仪离心机仪器有限公司;GeneAmp@9700 型聚合酶链式反应(polymerase chain reaction,PCPO 仪),美国ABI 公司;MX.S 型可调式混匀仪,美国SCILOGEX 公司;QuantiFluor 型-ST 蓝色荧光定量系统,美国Promega公司。
1.2 实验方法
1.2.1 大曲培养及其取样方法
大曲培养:(1)配制2.5 %的糖液,用量为安琪生香干酵母质量的20~30倍,调温至35 ℃,将干酵母溶解于活化液中活化1 h 左右[9];(2)强化大曲培养的工艺流程,原料选择(小麦)→润料破碎→加入活化后的生香活性干酵母(添加量为总投料量的0.5%)→加水搅拌→机械压曲→入房卧曲→培菌挂衣→翻曲、通风排潮→拢堆、合房→品曲(感观评价、理化分析)→出曲→入库贮存;(3)普通大曲的培养及工艺流程均与强化大曲相同,普通大曲的曲料中不添加安琪生香活性干酵母等微生物制剂。
取样方法:分别取成品曲的曲皮(区块表面的1~2 cm)和曲心(曲块中心的2~3 cm3)作为实验样品,在无菌环境下分别粉碎后保存于无菌袋中,置于-80 ℃冰箱备微生物分析;强化大曲的曲皮和曲心样品分别表示为FDS 和FDI,普通大曲曲皮和曲心样品分别表示为NDS 和NDI。在成品曲横断面的上表层、中层、内层等部位分别等量取样,粉碎混合后置于-4 ℃冰箱备GC-MS 检测及常规理化分析。
1.2.2 大曲样品的微生物群落分析
采用CTAB 或SDS 方法提取实验样品的总DNA,利用琼脂糖凝胶电泳检测DNA 的纯度和浓度,取适量的样本DNA 于离心管中,使用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA 为模板,根据测序区域的选择,使用带Barcode 的特异引物(Phusion® High-Fidelity PCR Master Mix with GC Buffer: New England Biolabs)和高效高保真酶进行PCR扩增定量,确保扩增效率和准确性。
16S V4 区引物(515F 和806R):鉴定细菌多样性;18S V4区引物(528F和706R):鉴定真核微生物多样性;ITS1 区引物(ITS5-1737F 和ITS2-2043R):鉴定真菌多样性。PCR 产物使用2 %浓度的琼脂糖凝胶进行电泳检测;对检测合格的PCR产物进行磁珠纯化,采用酶标定量,根据PCR 产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR 产物,对目的条带使用qiagen 公司提供的胶回收试剂盒回收产物。
文库构建和上机测试:使用TruSeq® DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,构建好的文库经过Qubit 和Q-PCR 定量,文库合格后,使用NovaSeq6000 进行上机测序。建库与测序等工作在苏州帕诺米克生物科技有限公司完成。
1.2.3 大曲样品的HS-SPME-GC-MS分析
参考Ding 等[10]的方法,准确称取1.00 g 大曲样品放入顶空瓶中,加入20 μL 2-辛醇溶液(内标终浓度为55.04 μg/g),盖上瓶盖。取50/30 μm DVB/CAR/PDMS 萃取头,在磁力搅拌器上插入加有20 μL 2-辛醇甲醇溶液和1.00 g 大曲的顶空瓶,萃取温度60 ℃,平衡10 min后顶空吸附35 min,插入温度为250 ℃的气质联用仪上解吸5 min 后进行检测。
气相色谱条件:氦气作为载气,流速控制为1 mL/min;升温程序:起始温度40 ℃,维持3 min,以5 ℃/min 升至80 ℃,再以10 ℃/min 升至230 ℃,维持8 min;气化室温度为250 ℃;不分流。质谱条件:选择电子轰击电离离子源(EI),电子能为70 eV,离子源温度为230 ℃,质量范围控制在40~400 u。
采用质谱计算机自带的NIST 数据库定性,各香气物质组分的质谱经计算机谱库检索,结合相关报道文献解析谱图,选择匹配度>50的鉴定结果以确定香气物质种类,进行定性分析;以2-辛醇内标,通过将各香气物质组分峰面积含量除以所有测得香气物质峰面积含量综合,与2-辛醇质量浓度作比进行计算,进行半定量分析。
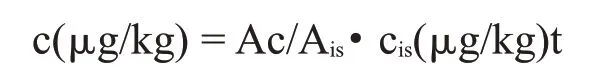
式中,c:大曲中的挥发性风味物质的浓度;cis:大曲中内标的终浓度;Ac:大曲挥发性风味物质的峰面积;Ais:内标物质的峰面积。
1.2.4 大曲样品的理化指标检测与感官评价
水分含量:采用质量恒定法;酸度:采用酸碱中和法;糖化力:采用斐林试剂滴定法;酯化力:采用酸碱滴定法[11]。依据参考文献对普通大曲和强化大曲进行感官评价[12],并依据评分结果绘制雷达图。
2 结果与分析
2.1 浓香型强化大曲的培养工艺分析
浓香型强化大曲以纯小麦为主要原料,并添加一定比例的大麦、豌豆等,原料破碎后添加活化后的安琪生香活性干酵母(添加量为总投料量的0.5 %),拌和均匀后进行机械压块制曲、入房培菌及排潮管理。培曲过程中,每天两次检查房内温度(室温以房内自然温度为准)并做好记录,翻曲操作要求“上翻下,下翻上,里拿外,外拿里”等,并调整曲块的行间距离。通过开关门窗等方式调整不同培曲阶段的温度和湿度,以利于制曲有益微生物的生长繁殖。前期排潮时,对流通风增氧,每天开门窗2~3 次;进入中挺阶段后遵循“潮大多排、潮小少排、无潮不排”等原则[13]。排潮期间的排潮量一般要求为60 %~70 %,培曲前期房内相对湿度达到93 %~96 %,培曲中挺阶段曲房内的相对湿度达到96 %~98 %,培曲后期曲房内相对湿度<80 %。培曲前期温度25~45 ℃,培曲中挺阶段品温达到50~60 ℃,培曲后期温度45~50 ℃,最后进行出房入库。
强化大曲应用安琪生香活性干酵母作为强化菌剂,在制曲压坯的拌料阶段添加。由图1 可知,强化大曲和普通大曲的温度变化规律基本都遵循“前缓、中挺、后缓落”的变化规律,但仍存在一定的差异。在大曲培养的0~4 d,曲房内氧浓度较大,酵母菌和霉菌等微生物快速繁殖,曲坯温度升温较快;在大曲培养的5~8 d 时曲坯达到顶温,强化大曲的曲温始终略高于普通大曲,可能是强化大曲在配料时添加了一定比例的安琪生香活性干酵母使得制曲微生物的种类和数量均有所增加,加快了大曲微生物的繁殖代谢。随着培养的进行,强化大曲的品温明显高于普通大曲,而且顶温的“中挺”时间较长,这可能与培曲前期强化大曲中制曲微生物的代谢旺盛导致淀粉和还原糖消耗的同时产生了大量水分等因素有关。
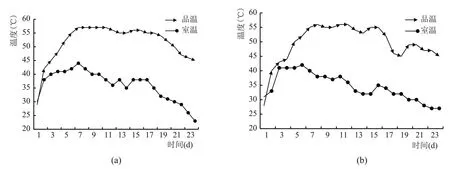
图1 大曲培养过程中的室温与品温变化情况
2.2 强化大曲微生物群落结构的对比分析
分别对强化大曲和普通大曲的曲皮与曲心样品提取总DNA 并进行测序,测序长度与设计引物扩增长度接近,表明本实验的测序结果较合理。基于Illumina Nova 平台测序构建PCR-free 文库,通过对Reads 的拼接,再对各样品测序序列进行质控过滤后得到有效序列,并进行聚类分析。对测序结果在97%相似度的OTU 水平进行Chao 指数计算,各样品Coverage ≥0.999,表明本实验的测序结果可以较为真实地反映各样品中的细菌和真菌等微生物的多样性,测序结果的有效性较高。Ace 指数是用于计算群落丰度的指数,其值越大说明样品中微生物的丰度越高[14]。由表1可知,FDS和FDI的Ace指数在对应样品组中均最高,表明FDS 和FDI 的微生物丰度可能高于其他曲样。Chao1 指数能估算样品中含有的物种数目,常用来估计物种总数[15],由表1 可知,FDS 和FDI 的Chao1 指数在对应样品组中均最高,表明FDS 和FDI 的物种总数可能高于其他曲样。综上表明,强化大曲(FDS、FDI)的微生物丰度和物种总数均高于普通大曲(PDS、PDI)。

表1 不同大曲样品微生物的Illumian Mi Seq高通量测序结果及Alpha多样性指数
由图2(a)可知,不同样品中丰度占比较高的真菌门主要包括子囊菌门(Ascomycota)和毛霉菌门(Mucoromycota);FDS 中的子囊菌门(Ascomycota)占比为34.05 %,明显低于NDS (91.85 %);FDS 中的毛霉菌门(Mucoromycota)占比为64.00 %,明显高于NDS(8.23 %)。在不同的曲心样品中,NDI 中的子囊菌门(Ascomycota)占比为54.31 %,明显低于FDI(95.54%);NDI 中的毛霉菌门(Mucoromycota)占比为46.55%,明显高于FDI(2.72%)。由图2(c)可知,FDS 的优势菌属为根霉属(Rhizopus,62.77 %),FDI 的优势均属为嗜热子囊属(Thermoascus,44.89 %);扣囊复膜孢酵母菌属(Saccharomycopsis)在NDI 中的占比为2.86 %,在FDS 中的占比达到17.10%,明显高于NDI,这可能是由于添加酵母制品用于强化制曲所造成的。
由图2(b)可知,不同样品中丰度占比较高的细菌门主要包括厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria);NDS中厚壁菌门(Firmicutes)的占比为59.87 %,明显低于FDS(60.81 %),NDI 中厚壁菌门(Firmicutes)的占比为91.90 %,明显高于FDI(23.69 %)。值得注意的是,FDI 中的变形菌门(Proteobacteria)占比为23.69%,明显高于NDI(2.05%)。如图2(d)所示,FDS中的魏斯氏菌属(Weissella)占比为31.84%,明显高于NDS(19.06 %);FDI 中泛菌属(Pantoea)的占比为40.19 %,显著高于NDI(0.91 %);FDI 中糖多孢菌属(Saccharopolyspora)的占比为7.56 %,显著高于NDI(1.23%)。
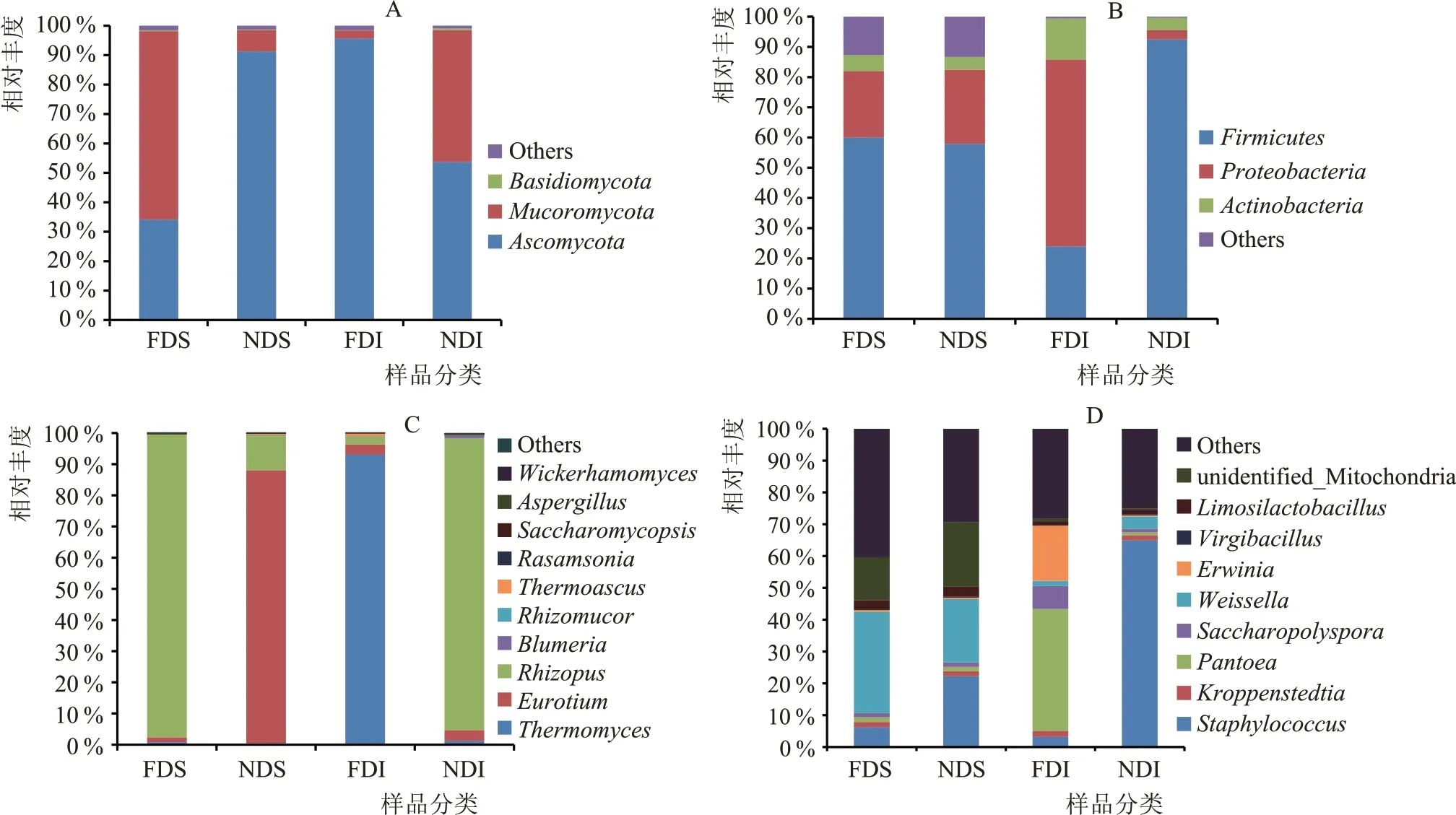
图2 基于不同水平的浓香型大曲微生物相对丰度柱状图
综上表明,强化大曲的微生物菌群结构明显区别于普通大曲,添加酵母制品用于强化制曲对大曲的微生物多样性具有显著影响。强化大曲主要优势真核微生物菌属有根霉属(Rhizopus)、嗜热子囊菌属(Thermoascus)和扣囊复膜孢酵母菌属(Saccharomycopsis),主要优势原核微生物菌属包括魏斯氏菌属(Weissella)、泛菌属(Pantoea)和糖多孢菌属(Saccharopolyspora)。
2.3 强化大曲风味特征的对比分析
大曲在白酒发酵过程中不仅发挥着糖化发酵剂的作用,大曲自身的香气对白酒发酵也有辅助增香的功能[16]。利用顶空固相微萃取(HS-SPME)结合气相色谱质谱联用仪(GC-MS)从强化大曲和普通大曲中分别检测到42 种和29 种挥发性风味组分,主要包括酯类、醇类、酸类、醛酮类、含氮类、呋喃类和芳香族化合物。
由表2 可知,强化大曲挥发性风味组分数量最多的为酯类化合物,共有12 种,其次为含氮类和醛酮类化合物,均有7 种,强化大曲中还含有芳香族化合物6种,呋喃类化合物4种,含醇类化合物和酸类化合物均为3 种。普通大曲挥发性风味组分数量最多的为酯类化合物,共有12 种,其次为芳香族化合物6 种,含氮类化合物4 种,呋喃类、酸类和醛酮类化合物均为2 种,含醇类化合物1 种。强化大曲挥发性风味组分的数量高于普通大曲,醛酮类和含氮类化合物的数量差别明显。为进一步对比强化大曲和普通大曲挥发性风味组分的含量差异,以2-辛醇内标,采用半定量的方法计算挥发性风味组分的含量。

表2 强化大曲和普通大曲挥发性风味组分的HS-SPME-GC-MS分析及其对比
由表3、表4 可知,强化大曲和普通大曲挥发性酯类化合物的种类数相同,但含量差异明显,强化大曲中挥发性酯类化合物的总含量为171.5814 μg/g,普通大曲中挥发性酯类化合物的总含量为109.8328 μg/g,强化大曲中挥发性酯类化合物的总含量明显高于普通大曲。酯类化合物通常呈现花香和水果香味,酯类化合物能通过醇类和脂肪酸的酯化反应生成,也可以由微生物发酵过程中的乙酰辅酶A 途径生成。一般来说大曲中酯类的合成前期可能与乙酰辅酶A 途径有关,而后期与酯化反应有关[17]。强化大曲中添加的生香活性干酵母可能会促进醇类和脂肪酸之间的酯化反应,或者是有利于促进大曲发酵过程中乙酰辅酶A 途径的进行。强化大曲中挥发性醛酮类化合物的种类数明显高于普通大曲,且强化大曲中挥发性醛酮类化合物的总含量为7.5096 μg/g,明显高于普通大曲中挥发性醛酮类化合物总含量的4.8843 μg/g。醛类化合物可能是大曲微生物降解原料中的淀粉类物质在糖酵解过程中产生,醛类化合物常有杏仁、青草味,酮类化合物可能是由微生物参与的脂肪酸β-氧化途径生成[16,18]。综上表明,大曲培养过程中添加生香活性干酵母有助于大曲中酯类、醇类、酸类、醛酮类、含氮类、呋喃类和芳香族化合物等挥发性风味化合物的生成,对大曲的香气起到积极的促进作用。
由表3、表4 可知,强化大曲中挥发性含氮类化合物的数量明显高于普通大曲,强化大曲中挥发性含氮类化合物的总含量为3.8618 μg/g,普通大曲中挥发性含氮类化合物总含量为2.7338 μg/g。大曲中含氮化合物主要包括吡嗪、吡啶和噻唑等化合物,含氮化合物可以通过非酶促反应比如美拉德反应生成。在培养温度超过50 ℃后大曲中耐高温的芽孢杆菌逐渐变成优势微生物,对含氮类化合物的生成具有积极的促进作用[19]。吡嗪类化合物通常呈现烘焙和坚果香味,该类化合物在大曲的焦香味等风味中起到积极作用。白酒中发现的含氮类化合物很可能是由大曲带入白酒固态发酵体系中所造成的[20]。与普通大曲相比,培曲过程中强化大曲升温快、升温高且“中挺”保温时间较长,有利于促进强化大曲中挥发性含氮化合物种类及含量的增加。

表3 采用HS-SPME-GC-MS对强化大曲进行挥发性风味组分检测的分析鉴定结果
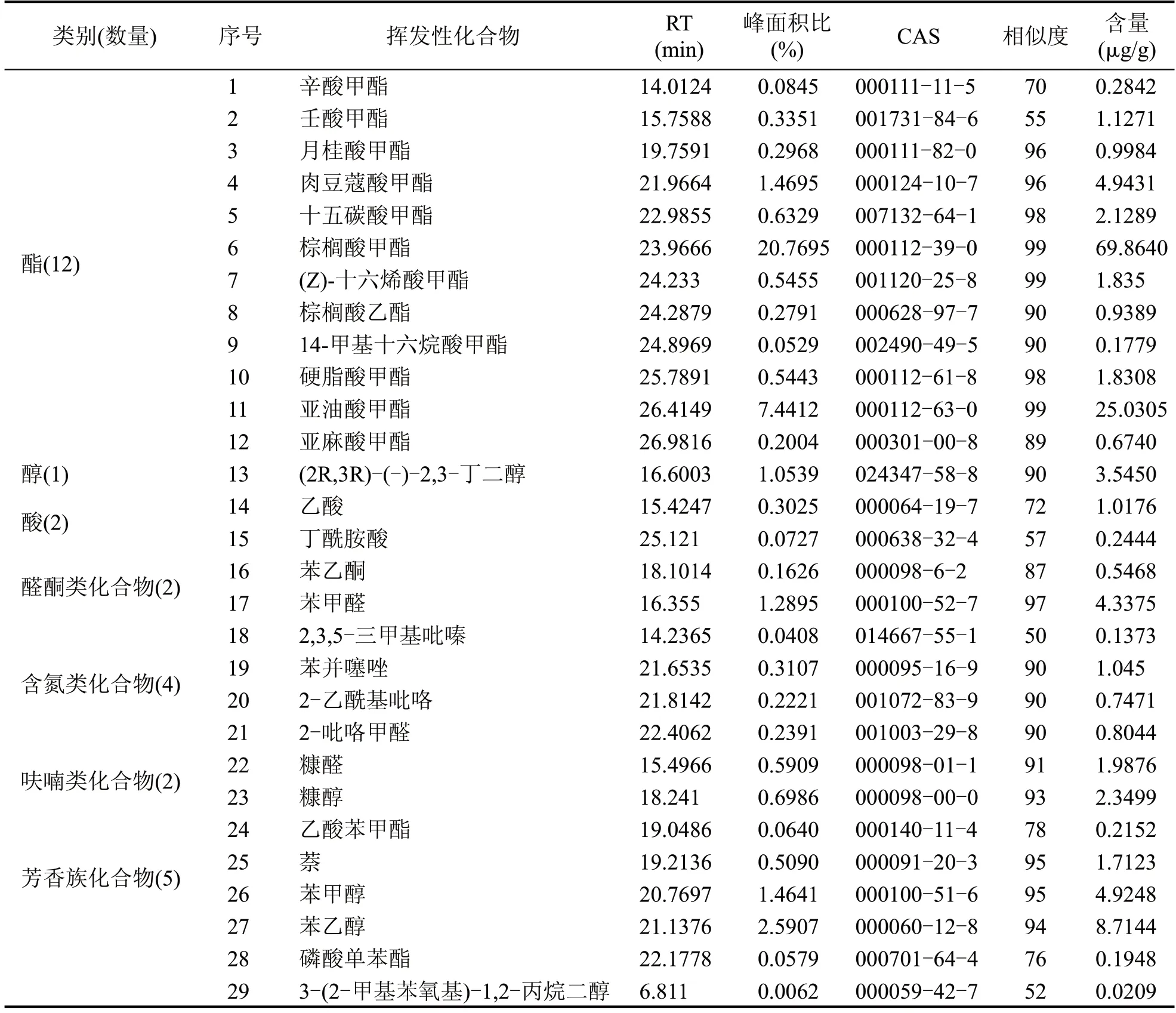
表4 采用HS-SPME-GC-MS对普通大曲进行挥发性风味组分检测的分析鉴定结果
2.4 强化大曲感官评分及其质量特征的对比分析
2.4.1 强化大曲和普通大曲的理化指标分析
大曲的水分、酸度等理化指标在一定程度上能够反映大曲的质量;大曲的糖化力、酯化力等指标反映了大曲酶系的功能组成及微生物的生长代谢情况,也可作为大曲质量评价的重要依据。由表5可知,强化大曲的水分含量、酸度、糖化力和普通大曲差别不明显。强化大曲的酯化力和发酵力明显高于普通大曲,可能是培曲前期强化大曲的升温略高于普通大曲,强化大曲的“顶火”时间维持较长,且培曲后期缓慢落火。结合图2 的大曲微生物分析表明,强化大曲中的酵母菌群丰富,有利于强化大曲的产酯产香,促使其曲香更加浓郁。

表5 强化大曲和普通大曲的理化指标检测结果
2.4.2 强化大曲和普通大曲的感官评分标准及评分
普通大曲的感官品质可依据成品曲的外观、断面和香味等感官指标进行初步描述。本文对强化大曲和普通大曲的外观、火圈及菌丝情况、曲心及窝潮情况、曲皮厚度以及曲香等五个方面进行感官评价评分。由表6 可知,在外观、曲心及窝潮情况、曲皮厚度等方面,强化大曲和普通大曲的差别不明显,均在9.3~9.5分;曲香方面,强化大曲评分为9.8分,高于普通大曲的9.5 分。结合理化分析结果表明,强化大曲的酯化力明显高于普通大曲,可能是强化大曲中添加的生香活性干酵母对大曲发酵过程中的产酯产香起到积极促进作用,有利于增强强化大曲的曲香。

表6 强化大曲和普通大曲的感官评价评分(浓香型酿酒大曲的感官评价[12])
2.4.3 强化大曲和普通大曲的感官评价雷达图分析
感官评价雷达图具有数字化、直观性等特点,广泛应用于酒类、香精等食品或风味产品的感官质量评价及微生物发酵工艺优化等领域[21]。Englezos等[22]应用感官评价雷达图研究了混合菌种酒精发酵对乳酸菌生长及苹果酸-乳酸活性的影响;辛松林等[23]基于电子舌技术,采用雷达图对中国白酒与鸡尾酒基酒的比较作出感官评价;Lezaeta等[24]建立了以感官和消费感知为主导的香气评价方法,对白葡萄酒的香气进行研究。雷达图的使用能更直观、准确的分析不同大曲之间的感官差别及特点。
目前,感官评价雷达图在酿酒大曲感官评价中的应用较少。本研究结合感官评价雷达图分析对强化大曲与普通大曲的感官指标进行比较,以期直观反映出强化大曲和普通大曲的感官差异。将大曲的感官描述分为外观、火圈及菌丝情况、曲心及窝潮情况、曲皮厚度和曲香等五类,通过专业的评曲人员,对不同类别的大曲样品进行感官评价,并以评分结果为依据绘制感官评价雷达图。由图3可知,在外观、曲心及窝潮情况、曲皮厚度、火圈及菌丝情况等方面,强化大曲和普通大曲差别不明显;在曲香方面,强化大曲明显优于普通大曲,强化大曲的曲香更加浓郁。

图3 强化大曲和普通大曲的感官评价雷达图
3 结论
浓香型大曲通常采用小麦、豌豆等作为制曲原料,经粉碎润水后压制成砖块状曲坯,自然环境下接种环境微生物,经固态发酵培养成酿酒糖化发酵剂。大曲的质量关系到曲酒的品质,传统制曲采用自然接种,不同发酵阶段的微生物种类及数量不同[25]。大曲微生物多样性研究对探究不同制曲工艺的微生物差异、解析相关功能菌株具有重要意义;功能菌株的筛选、纯化及强化应用,对提高白酒品质、原料利用率和特征风味成分含量等具有重要影响,有利于为微生物菌群的强化应用提供思路。当前,强化大曲研究主要包括接种不同的有益菌株及其接种比例、制曲工艺优化等方面,常见的大曲强化菌种包括酵母菌、丝状真菌和细菌等[26]。
本研究采用MiSeq 高通量测序技术分别解析强化大曲和普通大曲曲皮和曲心的微生物群落结构,应用顶空固相微萃取-气相色谱-质谱联用技术(HS-SPME-GC-MS)进行大曲挥发性风味组分分析,得到的结论有:(1)强化大曲的微生物群落结构明显区别于普通大曲,强化大曲的主要优势真核微生物菌属有根霉属(Rhizopus)、嗜热子囊菌属(Thermoascus)和扣囊复膜孢酵母菌属(Saccharomycopsis),主要优势原核微生物菌属有魏斯氏菌属(Weissella)、泛菌属(Pantoea)和糖多孢菌属(Saccharopolyspora);(2)强化大曲中挥发性风味组分的种类及酯类、醛酮类和含氮化合物的含量均高于普通大曲,强化大曲的曲香更加浓郁。本研究有助于明确酵母强化大曲的微生物群落结构及其风味特征,为安琪生香活性干酵母等微生物制品的生产应用提供依据,有利于强化大曲的培养工艺调整及质量调控。
