载体形貌对Ni/γ-Al2O3催化甲烷干重整的影响
2022-11-23王传棽苏通明秦祖赠纪红兵
王传棽,苏通明,秦祖赠*,纪红兵,2
(1.广西大学化学化工学院,广西石化资源加工及过程强化技术重点实验室,广西 南宁 530004;2.中山大学化学学院,广东 广州 510275)
全球变暖正在不断影响人类的生态环境,2020年12月习近平总书记在气候雄心峰会上代表中国宣布力争2030年前实现碳达峰,2060年前实现碳中和,让中国实现从相对减排到绝对减排,实现零排放[1]。甲烷干重整(DRM)利用CO2和CH4作为反应物,生产H2和CO组成的合成气,反应如式(1)所示。合成气可用作化石燃料的可持续替代,也是甲醇、氨等生产的重要化学品原料[2-3],为碳达峰和碳中和提供了一条有效的途径。

ΔH298K=+247 kJ·mol-1
(1)

为考察γ-Al2O3载体的形貌与结构对催化剂催化性能的影响,本文合成γ-Al2O3纳米片、γ-Al2O3纳米棒和γ-Al2O3纳米颗粒,并以市售Al2O3为对比,制备Ni/Al2O3催化剂,并于700 ℃下催化DRM反应,对Al2O3载体和Ni/Al2O3反应前后结构和表面性质进行分析,研究Al2O3载体形貌对Ni/Al2O3催化剂的影响。
1 实验部分
1.1 催化剂制备
γ-Al2O3纳米片:根据文献[9]制备γ-Al2O3纳米片,将10.0 g异丙醇铝(AR,成都市科隆化学品有限公司)加入到100 mL无水乙醇(AR,四川西陇科学股份有限公司)和去离子水的混合物(V无水乙醇∶V水=1∶4)中,在80 ℃下搅拌1 h后,在200 ℃下水热处理24 h,过滤得到的沉淀物分别用去离子水和乙醇洗涤3次,收集沉淀,在100 ℃干燥12 h后,将样品在600 ℃下焙烧4 h,获得白色γ-Al2O3纳米片,记为Al2O3-S。
γ-Al2O3纳米棒:根据文献[10]制备γ-Al2O3纳米棒,将0.017 0 mol Al(NO3)3·H2O(AR,成都市科隆化学品有限公司)和0.155 mol CO(NH2)2(AR,天津市光复科技发展有限公司)溶于150 mL去离子水中,搅拌20 min以形成均匀溶液,在100 ℃下水热处理48 h,水热后溶液pH值约为9,过滤得到的白色沉淀物分别用去离子水和乙醇洗涤3次,收集得到的沉淀,在100 ℃干燥12 h后,将干燥后的样品在600 ℃下焙烧3 h,获得白色γ-Al2O3纳米棒,记为Al2O3-R。
γ-Al2O3纳米颗粒:将0.100 mol Al(NO3)3·9H2O溶于200 mL去离子水中,搅拌20 min以形成均匀溶液,在不断搅拌的条件下缓慢滴加50 mL氨水(AR,四川西陇科学股份有限公司)使其充分沉淀,充分沉淀后溶液的pH值约为9。过滤得到的白色沉淀物用去离子水洗涤3次,在100 ℃干燥12 h。最后,将干燥后的样品在600 ℃下焙烧3 h,获得白色γ-Al2O3纳米颗粒,记为Al2O3-P。
γ-Al2O3负载Ni基催化剂(Ni/Al2O3)的制备:以市售Al2O3(AR,四川西陇科学股份有限公司)、γ-Al2O3纳米片、γ-Al2O3纳米棒和γ-Al2O3纳米颗粒为载体,采用去离子水和正己烷(AR,四川西陇科学股份有限公司)“双溶剂”法[11-12]制备γ-Al2O3负载Ni基催化剂。以γ-Al2O3纳米颗粒负载Ni基催化剂(Ni/Al2O3-P)的制备为例:先采用N2吸附-脱附测出载体γ-Al2O3纳米颗粒的孔体积,孔体积的量决定了γ-Al2O3吸附的液体量;将1.00 g载体浸于20.0 mL的正己烷中15 min,以排出孔道内的气体;按负载量,将Ni(NO3)2·6H2O(AR,国药集团化学试剂有限公司)溶在相当于γ-Al2O3孔体积(约1.80 mL)的去离子水中,将Ni(NO3)2溶液加入到γ-Al2O3和正己烷的悬浮液中,继续搅拌4 h使Ni金属均匀负载到载体上,将浸渍后的样品在80 ℃烘箱中干燥12 h,将干燥后的样品在800 ℃下焙烧6 h,获得的固体粉末即为Ni/γ-Al2O3纳米颗粒催化剂,记为Ni/Al2O3-P。按上述方法,分别合成Ni负载量为质量分数5%的Ni/Al2O3-C(市售Al2O3)、Ni/Al2O3-S(γ-Al2O3纳米片)、Ni/Al2O3-R(γ-Al2O3纳米棒)和Ni/Al2O3-P(γ-Al2O3纳米颗粒)。
1.2 催化剂活性评价
DRM反应在AMI-300全自动程序升温化学吸附仪(AMI仪器公司,美国)上进行。在活性测试前,催化剂需在30 mL·min-1的H2/Ar(广东华特气体股份有限公司,φH2=10%)气氛中于800 ℃下还原60 min,还原结束后以30 mL·min-1N2(99.999%,广东华特气体股份有限公司)吹扫40 min去除物理吸附的杂质,并降温到700 ℃。随后以30 mL·min-1通入V(CH4)∶V(CO2)∶V(N2)=1∶1∶1的反应气,气相空速(GHSV)为18 000 mL·gcat-1·h-1,在700 ℃下反应10 h。反应产物和未反应的气体采用配有TCD检测器的Agilent 8890气相色谱仪(安捷伦科技有限公司,美国)在线分析,根据色谱峰面积定量计算原料气的转化率及产物H2、CO的选择性。
1.3 催化剂表征
采用日本株式会社理学公司SMARTLAB3KW X-射线粉末衍射仪进行XRD测试;采用美国麦克默瑞提克公司Micromeritics TriStar II比表面积和孔隙度分析仪测量催化剂的织构性能;采用美国AMI仪器公司AMI-300全自动程序升温化学吸附仪进行H2程序升温还原(H2-TPR)、CO2程序升温脱附(CO2-TPD)、H2化学吸附的分析测试;采用日本日立技术公司Hitachi SU8220型扫描电子显微镜(SEM)测试催化剂的形貌特征;采用美国梅特勒-托利多公司METTLER TOLEDO TGA热重分析仪进行热分析(TG-DTG)以检测反应后催化剂上的积炭含量与积炭类型,确定催化剂的抗积炭性能。
2 结果与讨论
2.1 反应前催化剂表征结果
2.1.1 N2吸附-脱附
图1为不同形貌的γ-Al2O3负载Ni前后的N2吸附-脱附等温线及孔径分布图。
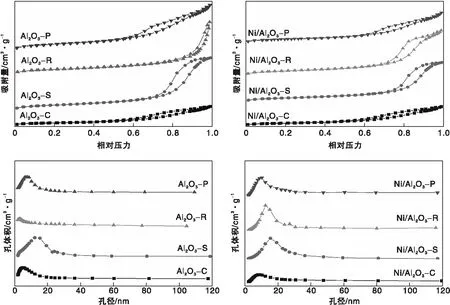
图1 不同形貌的Al2O3和Ni/Al2O3催化剂的N2吸附-脱附等温线和孔径分布Figure 1 N2 adsorption-desorption isotherms and pore size distribution of Al2O3 support and Ni/Al2O3 with different morphologies
根据IUPAC规定的分类标准,本文合成的Al2O3载体及催化剂的N2吸附-脱附等温线为Ⅳ型等温线,说明所制备的载体和催化剂为介孔材料,其吸附行为与凝固态中分子间的相互作用有关[13]。由图1中N2吸附-脱附等温线可以看出,随着相对压力的增加,所有样品对N2的吸附量都呈现缓慢上升的趋势,说明压力增加后,催化剂的孔道对N2的吸附由单层向多层转变[14]。四种形貌Al2O3载体的回滞环类型不同,Al2O3-C与Al2O3-P均表现出H3型回滞环,为随机聚集的纳米颗粒的颗粒间隙孔[2];而Al2O3-S表现出H1型回滞环,代表着均匀孔结构,是由于片层之间堆垛形成的楔形孔,孔径分布也相对集中;Al2O3-R表现出H2型回滞环,H2型回滞环是由于催化剂中的孔隙为典型的瓶状不规则孔,当小孔径瓶颈中的液氮脱附时,束缚在瓶中的液氮气体会突然逸出,一般是由于多个晶粒堆积在一起导致的,对比Al2O3-R和Ni/Al2O3-R的N2吸附-脱附等温线和孔径分布可以看出,负载Ni后,回滞环向低压移动、孔径分布更窄,形成更多的介孔。回滞环的差异说明介孔材料中孔道结构的不同,以Al2O3-R作为载体的催化剂,在负载Ni之后回滞环从H2型变成H3型,主要是由于硝酸盐分解沉积的Ni晶粒间形成新的孔道,孔径分布变得更窄而形成的[15]。除此之外,其他以Al2O3作为载体催化剂的回滞环与载体回滞环类型相同,孔径分布变化较小。
根据Brunauer-Emmett-Teller(BET)方程和Barrett-Joyner-Halenda(BJH)孔径分布计算得到Al2O3和Ni/Al2O3催化剂的织构特性,包括比表面积,孔体积和平均孔径,结果如表1所示。由表1可知,Al2O3载体负载Ni之后,比表面积、孔体积和平均孔径均有一定程度的减小,这是由于活性金属在载体表面分散的同时也会封闭和阻塞Al2O3载体的孔隙,使得负载金属后比表面积降低[16]。对于四种Ni/Al2O3催化剂,Ni/Al2O3-C的比表面积最小,不利于Ni颗粒在载体表面分散,反应过程中容易烧结,在催化剂表面易产生积炭而影响反应过程的稳定性;Ni/Al2O3-R的比表面积最大,有利于Ni金属在催化剂表面分散,可提供更多的活性位点,抑制反应过程中的Ni颗粒的团聚,促进DRM的进行。
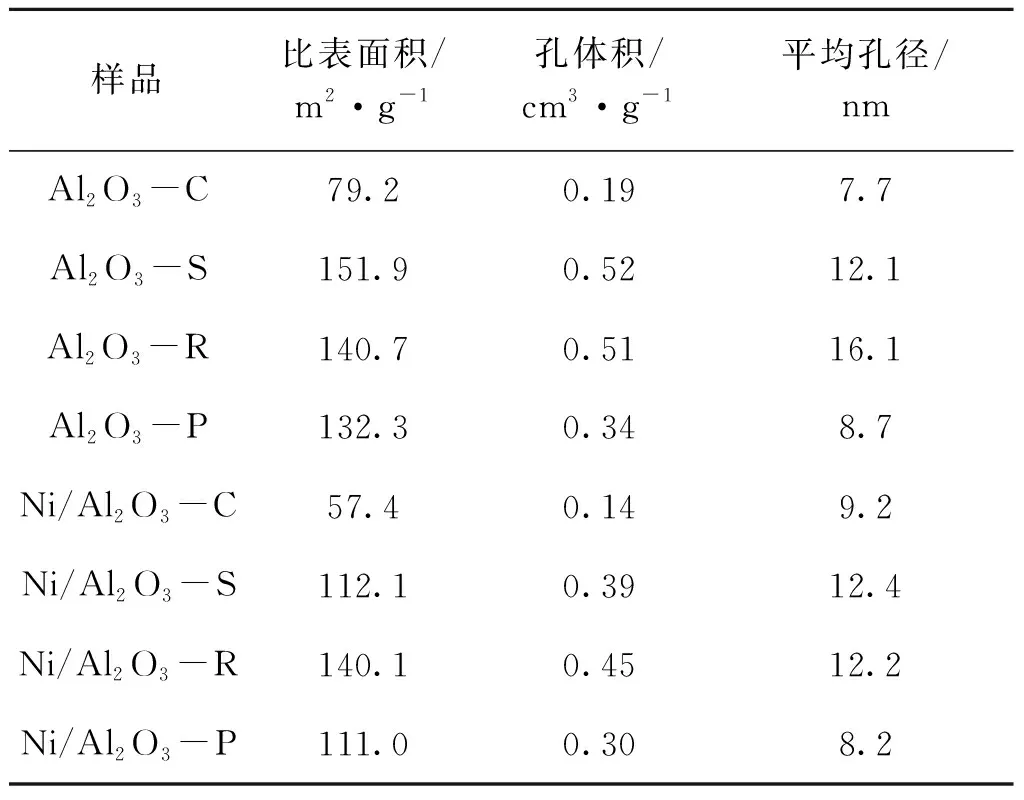
表1 Al2O3载体和Ni/Al2O3催化剂的织构性能
2.1.2 XRD
Al2O3负载Ni前后的XRD图如图2所示。
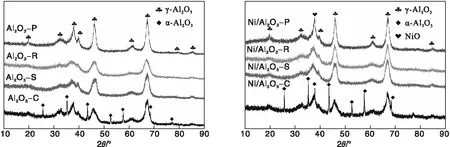
图2 Al2O3载体和Ni/Al2O3催化剂的XRD图Figure 2 XRD patterns of Al2O3 support and Ni/Al2O3 catalysts
从图2可以看出,所有Al2O3载体在19.5°、32.1°、37.7°、39.5°、45.8°、60.9°、67.1°、79.4°和85.1°的特征峰归属于γ-Al2O3(JCPDS No:80-0956),分别对应γ-Al2O3的(101)、(112)、(211)、(202)、(220)、(303)、(224)、(413)和(404)晶面。而Al2O3-C在25.6°、37.8°、41.7°、52.6°、59.7°、68.2°和77.2°的衍射特征峰归属于α-Al2O3(JCPDS No:74-1081),分别对应α-Al2O3的(110)、(222)、(220)、(210)、(121)和(432)晶面,说明Al2O3-C是α-Al2O3和γ-Al2O3的混合物;而制备的三种Al2O3均只存在γ-Al2O3的特征峰。负载活性金属Ni后,催化剂并没有出现新的特征峰,这是由于NiO(JCPDS No:89-7390)和γ-Al2O3的特征峰有一定程度的重合[17],并未出现明显新的特征峰,在37.7°的特征峰强度出现明显的增强,对应NiO的(101)晶面。
2.1.3 SEM
Ni/Al2O3催化剂的SEM照片如图3所示。制备的Al2O3均符合预期估计的形貌特征,活性金属Ni的负载并未影响其形貌。

图3 Ni/Al2O3催化剂的SEM照片Figure 3 SEM images of Ni/Al2O3 catalysts
由图3可知,Ni/Al2O3-C呈不规则的块状结构,Ni/Al2O3-S是分散的大型纳米片状材料,尺寸为(30~50) μm;Ni/Al2O3-R呈松散的堆积结构,纳米棒重叠在一起,Ni/Al2O3-R通过N2吸附脱附测得的比表面积最大,有利于活性金属Ni颗粒的分散;Ni/Al2O3-P中纳米颗粒大量团聚在一起,虽然测得的比表面积较大,但单个颗粒的尺寸很小,只有(0.5~1) μm,过于密集的堆积材料不利于活性金属在催化剂表面的分散。
2.1.4 H2-TPR
通过H2-TPR测试研究催化剂的还原性能及金属和载体之间的相互作用,载体形貌对Ni/Al2O3催化剂还原性的影响,结果如图4所示,计算得到程序升温过程中催化剂还原峰所对应的H2消耗量如表2所示。
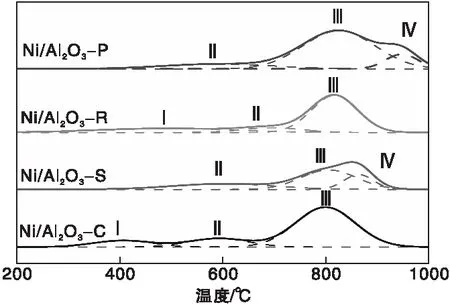
图4 Ni/Al2O3催化剂的H2-TPR曲线Figure 4 H2-TPR profiles of Ni/Al2O3 catalysts
从图4可以看出,Ni/Al2O3催化剂上共出现四种不同的还原峰,根据程序升温还原的温度标记为Ⅰ、Ⅱ、Ⅲ和Ⅳ,对应不同的Ni物种[18]:低于500 ℃的还原峰Ⅰ归属于催化剂中部分游离(比如载体表面)的NiO物种还原成Ni金属,NiO与Al2O3载体的相互作用较弱;(500~700) ℃间的还原峰Ⅱ属于NiO还原为Ni0粒子,此时NiO与Al2O3载体为中等强度的相互作用,但无新物质形成;而在高于700 ℃的还原峰则归属于NiO与载体间的强相互作用所产生,存在两种不同的还原峰(Ⅲ和Ⅳ),分别为NiO与Al2O3载体之间的强相互作用的NiO还原生成的还原峰,以及NiO反应产生的新相尖晶石NiAl2O4中Ni2+的还原峰,两种还原峰的存在都代表着NiO和Al2O3之间存在强相互作用[19-20]。
H2消耗量与催化剂的还原性相关,从表2可以看出,Ni/Al2O3还原峰的H2消耗量差别较小。一般来说,H2消耗量与催化剂还原性呈正比[21],Ni/Al2O3-P催化剂还原性最强,Ni/Al2O3-S和Ni/Al2O3-P均未出现Ⅰ型的还原峰,说明两种催化剂中都不存在游离的NiO,Ni物种与Al2O3载体之间相互作用较强。而Ni/Al2O3-C和Ni/Al2O3-R存在Ⅰ型还原峰,说明Ni物种与Al2O3载体相互作用较弱,已在700 ℃以下被完全还原。Ni/Al2O3-P的Ⅲ型还原峰数量最多,催化剂中的Ni物种与载体的相互作用最强,Ni/Al2O3-S的Ⅳ型还原峰数量最多,说明催化剂中的Ni物种与载体相互作用较强,形成的尖晶石NiAl2O4最多。Ni物种与载体间的相互作用程度过强会影响反应气CH4在活性物种Ni上的吸附[22],Ni/Al2O3-R还原性较强,且Ⅲ,Ⅳ型还原峰较少,作为DRM催化剂效果较好。
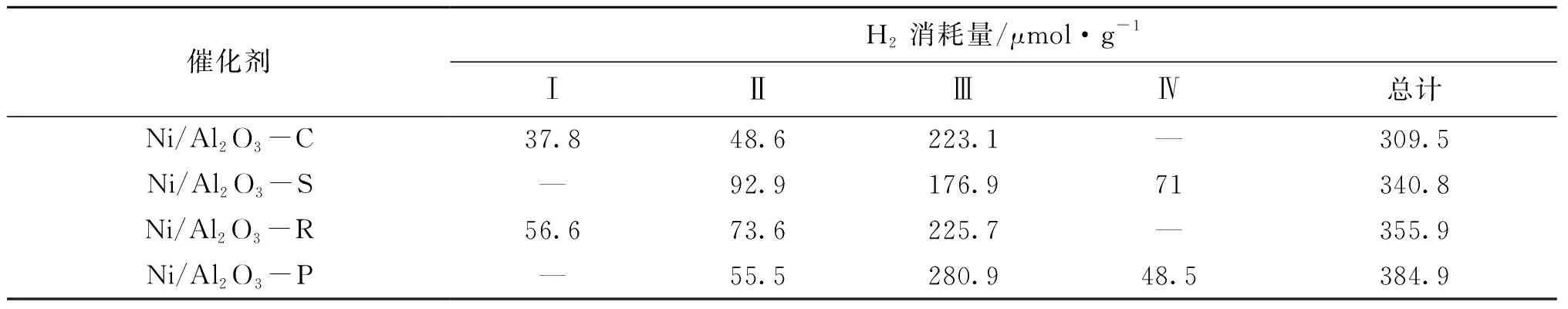
表2 Ni/Al2O3催化剂的H2消耗量
2.1.5 CO2-TPD
采用CO2-TPD测试对Ni/Al2O3催化剂的CO2吸附脱附能力和表面碱度进行研究,结果如图5所示,通过峰面积拟合计算得到的CO2脱附量如表3所示。
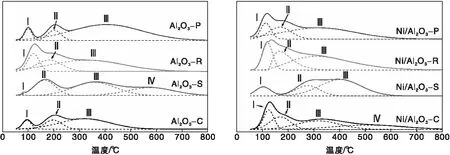
图5 Al2O3载体和Ni/Al2O3催化剂的CO2-TPD曲线Figure 5 CO2-TPD profiles of Al2O3 supports and Ni/Al2O3 catalysts
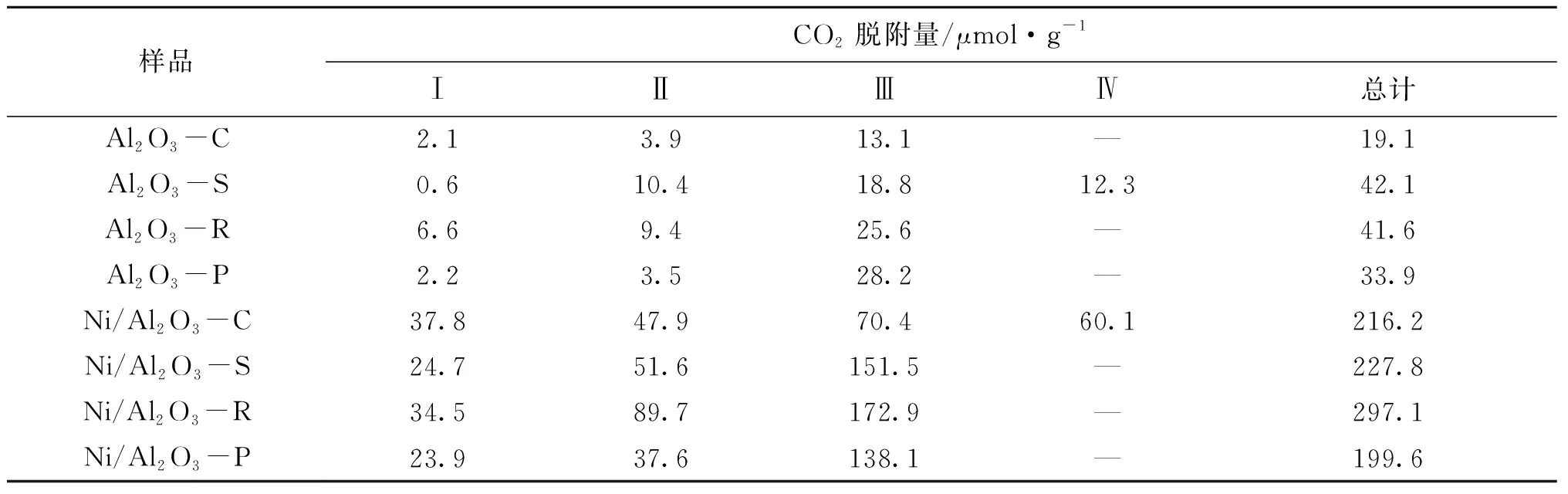
表3 Al2O3和Ni/Al2O3催化剂的CO2脱附量
通常CO2吸附的量越多,催化剂表面的碱度越强[23],CO2脱附温度代表碱性位点强度,而CO2脱附峰面积代表碱性位点的相对浓度,在(50~800) ℃范围内,根据CO2的脱附温度将碱性位点划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四类[24]:(50~150) ℃的是Ⅰ型弱碱性位点,对应CO2的弱吸附;Ⅱ型碱性位点在(150~300) ℃,是中等强度的碱性位点,对应中等强度CO2吸附;Ⅲ和Ⅳ型的碱性位点均在(300~700) ℃,分别对应强碱性位点和极强碱性位点。上述四种碱性位点中,Ⅱ型和Ⅲ型碱性位点的存在不仅有利于CO2脱附,也有利于CO2在催化剂表面的吸附活化[25],Ⅲ型碱性位点的数量与催化剂的抗积炭能力相关,Ⅲ型碱性位点数量越多,催化剂的抗积炭能力越强[26]。
从表3可以看出,γ-Al2O3载体上CO2脱附量的排序为:Al2O3-S>Al2O3-R>Al2O3-P>Al2O3-C,其中,Al2O3-S和Al2O3-R的CO2脱附量差距很小。载体上CO2吸附量明显小于负载型催化剂,Al2O3是弱酸性载体,其碱性位点较少,不利于CO2的吸附活化;在负载金属Ni之后,CO2倾向于在Ni和Al2O3载体之间的界面发生吸附和解离,CO2吸附量变多。负载活性金属Ni之后,CO2脱附量的排序为:Ni/Al2O3-R>Ni/Al2O3-S>Ni/Al2O3-C>Ni/Al2O3-P;DRM反应过程中反应气CO2和CH4在催化剂上的吸附活化过程受到催化剂的酸碱性的影响[7],催化剂的碱度越强,有利于CO2吸附在催化剂上,Ni/Al2O3-R表面存在最强的碱度和最多的Ⅲ型的碱性位点,说明该催化剂有利于CO2的吸附活化。
2.1.6 H2化学吸附
通过Ni/Al2O3催化剂在50 ℃下脉冲吸附H2的量,计算得到活性金属Ni的分散度,结果如表4所示。从表4可以看出,金属Ni分散度的大小为:Ni/Al2O3-S>Ni/Al2O3-R>Ni/Al2O3-C>Ni/Al2O3-P,说明Ni金属分散度受Al2O3载体形貌影响严重。从SEM和N2吸附-脱附结果可知,Al2O3-S是尺寸较大的分散片状结构,有利于活性金属Ni的分散,故Ni/Al2O3-S的Ni颗粒分散度最高;而Al2O3-P虽比表面积较大,但纳米颗粒堆叠严重,暴露的比表面积较少,不利于催化剂中活性金属Ni的分散,所以Ni/Al2O3-P催化剂的H2脉冲吸附量最少,活性金属Ni分散度最低。
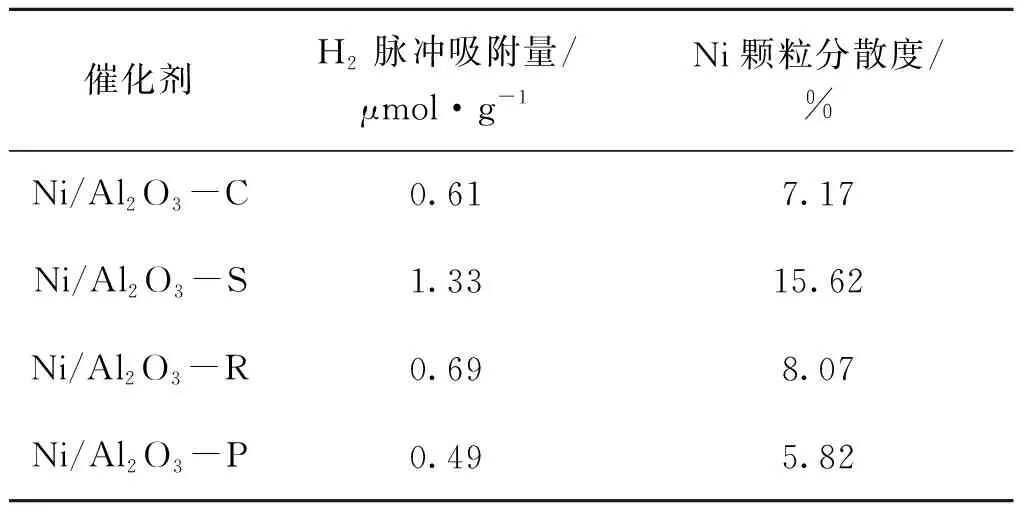
表4 Ni/Al2O3催化剂上Ni金属分散度
2.2 甲烷干重整催化剂性能研究
在气相空速为18 000 mL·(gcat·h)-1,反应温度700 ℃,V(CH4)∶V(CO2)∶V(N2)=1∶1∶1条件下,Ni/Al2O3催化甲烷干重整结果如图6所示。
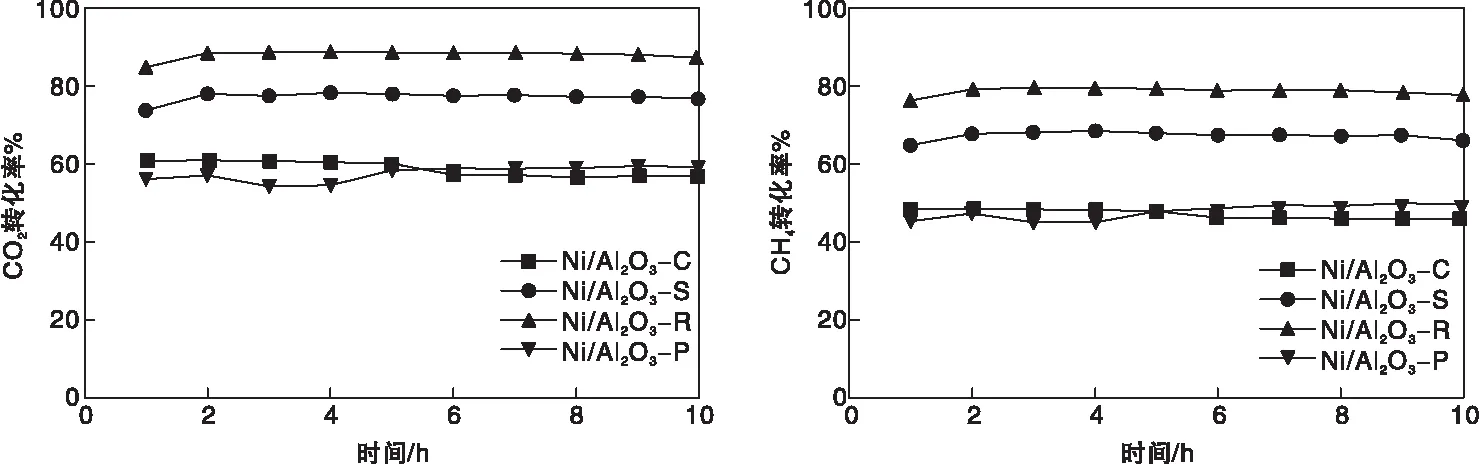
图6 Ni/Al2O3催化剂上CO2和CH4转化率Figure 6 CO2 and CH4 conversion over Ni/Al2O3 catalysts
从图6可以看出,Ni/Al2O3的甲烷干重整活性受γ-Al2O3载体形貌的影响,CO2和CH4的初始转化率从高到低为:Ni/Al2O3-R>Ni/Al2O3-S>Ni/Al2O3-C>Ni/Al2O3-P。其中,Ni/Al2O3-R上CO2和CH4的初始转化率最高,分别是84.3%和75.4%;Ni/Al2O3-P上,CO2和CH4的初始转化率最低,分别是56.6%和46.4%,且反应过程中活性有一定波动,说明催化剂在反应过程中不稳定。而Ni/Al2O3-S上CO2和CH4的转化率虽然较为稳定,但转化率明显低于Ni/Al2O3-R,CO2和CH4的初始转化率分别是73.7%和64.7%,Ni/Al2O3-C的CO2和CH4的初始转化率分别是60.7%和48.6%,分别比Ni/Al2O3-R催化剂低23.6和26.8个百分点。
γ-Al2O3载体的形貌影响Ni/Al2O3催化剂的比表面积、金属Ni的分散度、还原性、碱性位点的数量,从而影响催化活性。从N2吸附-脱附的结果可以看出,Ni/Al2O3-R具有最大的比表面积,Ni/Al2O3-C的比表面积最小;同时,比表面积的大小也影响活性,在反应过程中Ni颗粒容易团聚,而催化剂的比表面积越大,Ni颗粒团聚可能性越低,大比表面积的载体具有更多的Ni位点可用于初始反应的活化;比表面积最低的Ni/Al2O3-C催化剂在反应过程中活性较低,且有一定失活趋势。H2化学吸附说明Ni/Al2O3-S中的Ni分散度最高,而Ni/Al2O3-P的分散度最低,Ni的分散度影响催化剂在反应过程中的活性与稳定性,Ni颗粒的分散程度越高,催化剂的耐烧结和抗积炭能力越强,稳定性越高[5];H2-TPR说明Ni/Al2O3-R的还原性最强,还原性与催化剂的DRM活性呈正比,Ni/Al2O3-R的催化活性最高;CO2-TPD说明Ni/Al2O3-R的CO2吸附量最多,碱度最高,拥有最多的Ⅲ型碱性位点,一般来说,CO2吸附量的增加不仅可提高DRM的活性,而且可以与一部分积炭发生反应(CO2+C→CO),使反应过程中生成的积炭气化,在提高活性的同时还可以增加催化剂的稳定性[25,27],因此,Ni/Al2O3-R的抗积炭能力最强。

图7 Ni/Al2O3催化剂的H2产率,CO产率和产物气中H2/COFigure 7 H2 yield,CO yield, and H2/CO ratio in product gas on Ni/Al2O3 catalyst
2.3 反应后催化剂表征
2.3.1 XRD
为研究Ni/Al2O3反应后的变化,对反应后的催化剂进行表征,Ni/Al2O3催化剂经DRM反应10 h后的XRD图如图8所示。与反应前Ni/Al2O3催化剂的XRD(图2)相比,不同形貌的Ni/Al2O3催化剂反应后在26.5°出现一个石墨碳的特征峰(JCPDS No:89-8487),说明在反应过程中生成了石墨碳。但Ni/Al2O3-C催化剂在反应之后并没有出现石墨碳的特征峰,可能是Ni/Al2O3-C催化剂没有生成积炭,或是积炭沉积在孔道内,没有检测到石墨碳的生成[22]
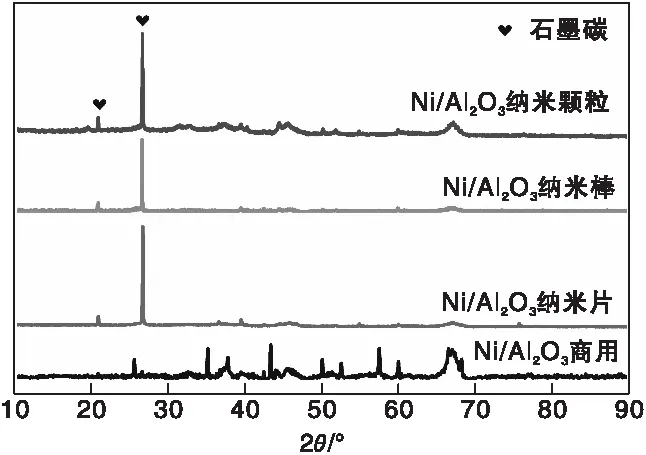
图8 反应后Ni/Al2O3催化剂的XRD图Figure 8 XRD patterns of spent Ni/Al2O3 catalysts
2.3.2 SEM
经10 h DRM反应后的Ni/Al2O3催化剂的SEM照片如图9所示。

图9 反应后催化剂的SEM照片Figure 9 SEM images of spent catalysts
由图9可知,与反应前的催化剂相比(图3),反应后Ni/Al2O3催化剂形貌基本不变,但表面和孔道都明显附着团聚的短杆状的丝状和球状颗粒,这是反应过程中产生的丝状碳和石墨碳[15]。所有Ni/Al2O3催化剂在反应之后均存在丝状碳和石墨碳,丝状碳作为对DRM反应影响最大的积炭,其生成会覆盖催化剂的活性位点,同时,由于丝状碳生长在催化剂的活性金属与载体之间的界面上,在其生长的过程中往往导致活性金属组分的移动和偏移,影响活性组分Ni与载体的接触,抑制催化剂的金属-载体相互作用[16,28],从而进一步影响催化剂的活性。丝状碳在反应过程中难以消除,其生长往往意味着催化剂稳定性的下降,所以,DRM反应过程中应避免丝状碳的生成。
但并不是所有的积炭都会对反应活性产生影响,少量无定型碳以及石墨碳在催化剂上生成后[29],可随反应的进行被CO2氧化从而去除掉,只有丝状碳的存在是难以去除而且会对反应产生较强的抑制作用的,但是无定型碳无法通过SEM直接观察,故只在反应后的催化剂上观察到丝状碳和石墨碳。虽然所有Ni/Al2O3催化剂在反应后表面都存在积炭,但如果反应后的催化剂表面的丝状碳的量较少,催化剂的稳定性较高。
2.3.3 TG-DTG
为进一步深入研究Ni/Al2O3催化剂在DRM反应后的积炭程度,通过TG-DTG分析反应后催化剂上的积炭量,结果如图10所示。通过热重曲线定量计算Ni/Al2O3催化剂上的积炭量,并用DTG研究催化剂上的积炭氧化的过程。从TG曲线可以看出,所有Ni/Al2O3催化剂在100 ℃附近都有一个明显的失重峰,这是催化剂表面物理吸附的水气化过程[30];Ni/Al2O3在(600~700) ℃出现较大程度的失重过程,这是催化剂表面大量碳物种的氧化过程[31]。从TG曲线可以定量计算出反应后Ni/Al2O3-C、Ni/Al2O3-S、Ni/Al2O3-R和Ni/Al2O3-P的失重率分别为13.5%、9.8%、8.6%和14.6%,Ni/Al2O3-P和Ni/Al2O3-C催化剂的失重率较高,说明这两种催化剂反应过程中产生较多的积炭,XRD和SEM分析可知,积炭主要为丝状碳和石墨碳。
DTG曲线可以确定积炭氧化峰的温度范围,从DTG曲线可以看出,所有Ni/Al2O3上除物理吸附水的气化峰外,还在(320~330) ℃和(600~650) ℃存在失重峰,分别对应于无定型碳Cβ和丝状碳Cv的氧化消除[32-33]。从TG曲线可以看出,由于(320~330) ℃间的失重较低,说明催化剂上的无定型碳含量较低,则所有Ni/Al2O3上的积碳以丝状碳为主。在(250~500) ℃形成的无定型Cβ是活性碳物种,覆盖在催化剂表面,在DRM反应过程中可被CO2氧化或者被CH4还原而去除,不会影响催化剂活性。但在(500~900) ℃时,因Ni金属颗粒表面会发生成核作用,无定型碳Cβ可转变为丝状碳Cv;随着丝状碳Cv的不断生成,所形成的碳层在超过80个原子直径时具有热力学稳定性,此时碳层难于去除,Cv覆盖在催化剂的活性位点上,使催化剂的金属活性位点失活,将不利于反应。
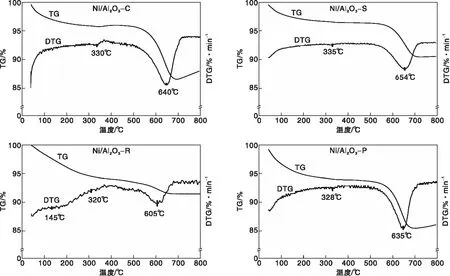
图10 反应后Ni/Al2O3催化剂的TG-DTG曲线Figure 10 TG-DTG curves of spent Ni/Al2O3 catalysts
γ-Al2O3载体的形貌影响Ni/Al2O3的催化活性与反应后的积炭量,从前述分析可知,反应后所有的Ni/Al2O3催化剂表面均积炭,积炭过多会覆盖在催化剂的活性位点上,导致催化剂的金属活性位点失活。积炭以丝状碳为主,丝状碳碳层难于去除,覆盖在催化剂的活性位点上,使催化剂的金属活性位点失活,不利于反应的进行。结合上述表征结果与分析,Ni负载γ-Al2O3-R催化剂的催化性能最好,反应生成的积炭最少。
3 结 论
(1) 制备了γ-Al2O3纳米片、γ-Al2O3纳米棒和γ-Al2O3纳米颗粒三种形貌的Al2O3载体,将Ni负载在Al2O3上制备Ni/Al2O3催化剂,并于700 ℃进行催化DRM反应。
(2) 载体Al2O3的形貌影响Ni/Al2O3催化剂的比表面积、还原性、碱度、活性金属分散程度,从而影响催化剂的活性和稳定性,Ni负载于Al2O3纳米棒催化剂的活性最高,CO2和CH4的初始转化率分别是84.3%和75.4%,合成气中H2/CO为0.88,经10 h反应稳定性最高,与Ni/Al2O3-C催化剂相比CO2和CH4的转化率提升23.6和26.8个百分点。
(3) Ni/Al2O3催化剂在反应后均存在丝状碳为主的积炭。
