Myostatin基因编辑家畜研究进展
2022-11-21王若茜李运生
金 晨,王若茜,刘 通,李运生
(安徽农业大学 动物科技学院,合肥 230036)
猪、牛、羊作为主要的畜牧动物,是重要的肉食来源,提升肉用家畜的产肉性能是人们育种的主要目标。肌肉生长抑制素基因(Myostatin,MSTN)主要表达于肌肉组织,参与骨骼肌负向生长调控。当MSTN缺失时家畜瘦肉产量和嫩度会大幅提高[1]。故对其进行基因编辑,是培育出具有优良肌肉性状家畜的有效方法。文章主要就猪、牛、羊MSTN基因编辑实例进行总结论述,包括基因编辑手段、编辑效率、编辑后表型等方面,为今后家畜MSTN基因编辑提供参考。
1 MSTN基因概述
1.1 MSTN基因研究背景
1807年,G.Culley首次发现了“双肌”牛,该种牛呈现出前后肢、胸部和一些支持性的中肌和前肌异常发达、皮下脂肪很少、皮肤薄而瘦的特点,完美符合人们对优良肉质的需求。1997年,美国约翰斯·霍普金斯大学医学院的A.C.Mcpherron等人首先从小鼠骨骼肌cDNA中克隆出一种新的基因,该基因具有转录生长因子-β(transforming growth factorβ,TGF-β)超家族的典型结构,但与其他基因成员的同源性较低,被列为新的TGF-β超家族成员,即生长分化因子8(growth and differentiation factor 8,GDF-8)。在研究过程中,该团队通过靶向破坏GDF-8基因发现,基因突变动物比野生型动物体型更大,并且骨骼肌显著增加,突变动物的个体肌肉重量是野生型动物的2~3倍。种种迹象均表明GDF-8是骨骼肌生长的负向调节剂,肌肉生长抑制素由此得名[2]。为了证明“双肌”牛是否与MSTN相关,科研人员在1997年通过基因连锁将牛的该基因定位到与肌肉肥大(muscular hypertrophy,MH)基因座相同的区间[3]。同年,比利时蓝牛被发现在MSTN编码区有一段11 bp的缺失导致了移码突变,从而造成自该碱基缺失后第14个密码子起停止翻译。同样在皮埃蒙特牛相同的编码区上发现,第941位的G-A转换突变,使得氨基酸314位的半胱氨酸被酪氨酸取代。这些变化都导致了“双肌”表型产生[4]。随后,大鼠、猪、绵羊、山羊、鸡、人、狒狒、鲶鱼等物种的MSTN基因信息都被陆续发掘出来,对MSTN的研究也逐步深入。
1.2 MSTN基因结构
在常见的猪、牛、羊等家畜中,MSTN基因均含有375个氨基酸残基,其基因编码区均含有3个外显子和2个内含子。在产生作用前,MSTN会先合成前体蛋白,该前体蛋白由三部分组成:信号肽、编码前肽(N端)和成熟的编码肽(C端)。该前体蛋白N端和C端区域之间有一个蛋白水解加工点[5]。前体蛋白合成后会被不同的蛋白酶酶解加工(去除信号肽、蛋白酶切割位点的切割),从而产生N-端前肽和C-端多肽两部分,后者通过二硫键组成二聚体,成为MSTN成熟蛋白并分泌至血液循环中,进一步与N-端前肽以非共价键形式形成一种潜伏蛋白(LAP),最终在BMP-1/TLD裂解前肽后,MSTN成熟蛋白被激活,与细胞膜上的特异性受体结合,发挥生物学功能[6]。与TGF-β超家族成员类似,MSTN同样具备以下四个特征:(1)N端有一个信号肽序列,可以穿过内质网;(2)与生物活性区相邻的一个由4个氨基酸组成的蛋白质分解加工点(RSRR,位置是263~266位);(3)C-末端有一个生物活性区,含有9个保守的半胱氨酸的生物活性位点,可以形成“Cys Knot”结构;(4)C-末端通过形成二硫键组成二聚体发挥功能。
1.3 MSTN基因功能
MSTN基因的关键功能是对骨骼肌进行调控,主要分为以下几条途径:一是激活SMAD经典通路。MSTN首先与激活素受体结合,导致Smad2/3磷酸化并与Smad4形成复合物,从而干扰MyoD的转录活性并抑制由MyoD诱导的成肌细胞的肌原性分化,抑制MSTN信号传导[7]。二是激活MAPKs通路。MSTN通过不同方式激活MAPKs通路,包括JNK通路[8]、p38MAPK通路[9]和ERK1/2通路[10],从而抑制肌肉生成因子的表达。三是抑制Akt通路。正常情况下,Akt会在胰岛素和胰岛素样生长因子-1(IGF-1)的相互作用下发生磷酸化,诱导mTOR进行调控,同时还会抑制叉头转录因子(FoxO)家族的成员。肌细胞增殖期间,FoxO以潜伏的磷酸化形式位于细胞质中。分化开始后,FoxO会转移到细胞核,并与DNA结合调节转录。而Akt会通过磷酸化FoxO调节其活性,从而使FoxO保留在细胞质中。但病理情况下,去磷酸化的Akt无法抑制FoxO,导致其在细胞核中积累,与DNA结合并诱导E3泛素连接酶MURF-1和Atrogin-1转录,参与蛋白质降解[11]。此外,MSTN基因敲除小鼠模型验证了该基因也可调控脂肪[12]。
2 家畜MSTN基因编辑进展
基因编辑也称基因组编辑或基因组工程,是一种新型的基因工程技术,可改变生物体基因组中的特定靶基因,能够高效地进行靶向基因组编辑,在基因研究、基因治疗和遗传改良方面显示出巨大的潜力。常用的基因编辑工具有Cre/LoxP(Cre重组酶和一段叫做LoxP位点的DNA序列组成的重组酶系统)、锌指核糖核酸酶(ZFN)、转录激活因子样效应物核酸酶(TALENs)、规律间隔成簇短回文重复序列(CRISPR/Cas9)、单碱基编辑技术(base editor)及最新的先导编辑技术(Prime editing)[13]。其中,RNA引导的CRISPR/Cas9系统在农作物和动物中都展示出其高效、广泛、通用的优点,成为当前主流基因编辑方案。而猪、牛和羊作为重要的畜牧物种,提高其产肉效率是科研人员的主要目标,因此负向调控肌肉性状的MSTN成为家畜基因编辑中的明星基因。
2.1 猪MSTN基因编辑进展
猪是与人类比较接近的家畜模型,具有性成熟早、繁殖周期短、每窝产仔数多的优点。随着体细胞核移植技术和基因组编辑技术的不断发展,使高效生成基因编辑大动物成为可能,而负向调控肌肉生长的MSTN基因成为了基因编辑猪的主流选择。猪MSTN基因编辑实例见表1。
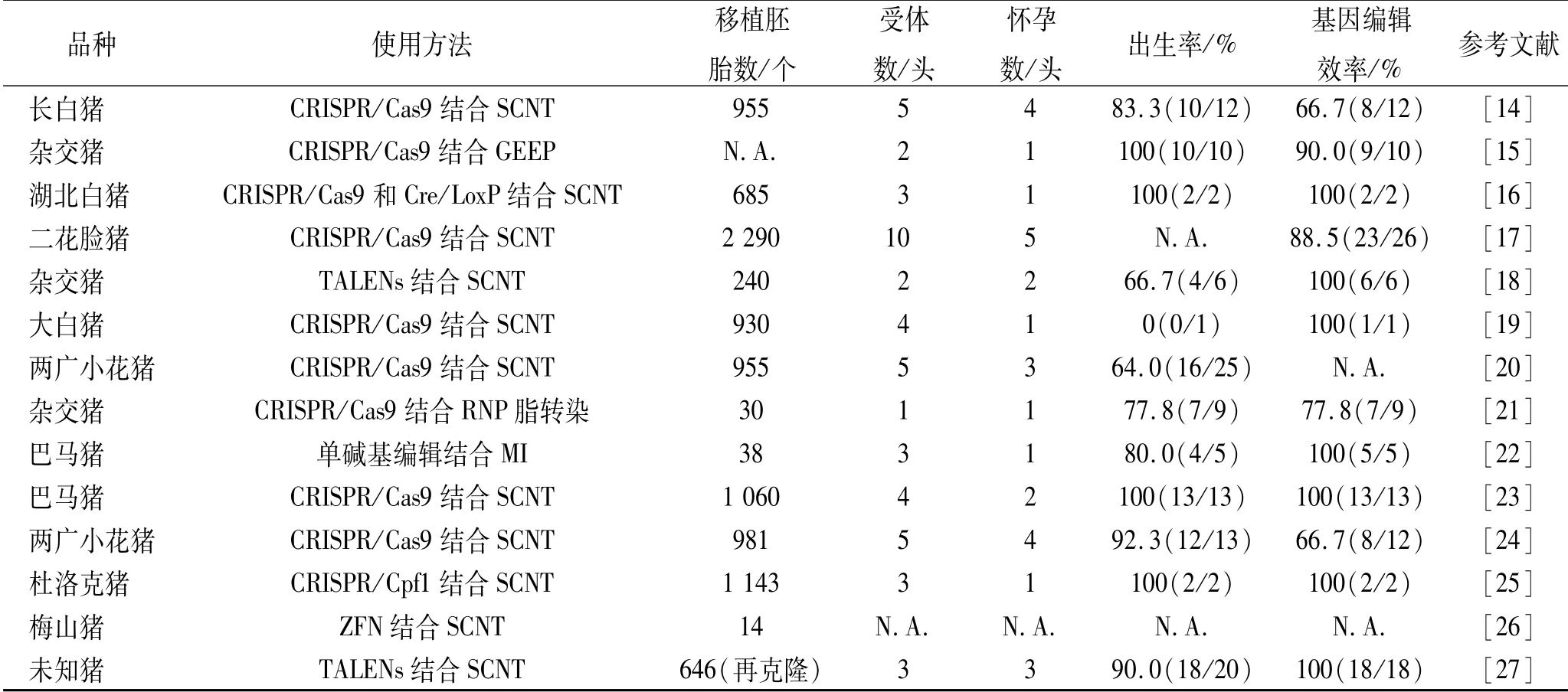
表1 猪MSTN基因编辑实例Tab.1 Exam p le of MSTN gene editing in pigs
猪的MSTN基因编辑尝试较多,加之大多使用体细胞核移植(somatic cell nuclear transplantation,SCNT)的缘故,仔猪基因编辑效率较高。在除SCNT以外的其余方法中,仔猪纯合突变率较低,如F.Tanihara等[15]和Song R.G.等[22]的研究中,仔猪MSTN纯合突变效率只有20%,其他研究中有的未出现纯合突变仔猪[21]。MSTN基因编辑仔猪整体出生率较高,但部分结果显示出生后的仔猪存活时间较短,存活仔猪体重和生长速度均高于野生型。同样,不同品种猪的体重与野生型出现显著差异的时间不同,如采用MSTN-KO技术的湖北白猪在4~6月龄体重出现显著性变化[16],而巴马猪在3月龄时就已经出现了显著性变化[23]。
肌肉表型上,MSTN基因编辑仔猪出现明显的双肌表型,主要在背部、臀部和后腿出现更宽阔的肌肉。但不同试验中出现明显变化的部位也不相同,如Peng D.W.等[24]报道:基因编辑仔猪肩部肌肉变化明显;对肌纤维分析发现,基因编辑仔猪的单位面积肌纤维数量显著高于野生型,但是肌纤维大小不变,故肌肉量增加是由于肌纤维增生而不是肥大[20]。 有趣的是,在ZFN方法编辑的梅山猪中,有部分突变猪出现15个胸椎[26](正常为14个),这在野生型猪中尚未发现,同时该现象在其他基因编辑中也未发现。可以肯定的是,MSTN对骨骼的形成和维持有影响,但为什么该现象只在此基因编辑猪中出现,是否与基因编辑方法或猪品种有关?具体机制还有待进一步研究。无论如何,胸椎数量与猪肉产量之间存在正相关关系,胸椎数量增加与猪肉生产经济效益相关,研究其中存在的机制对猪育种有着很大帮助。除此以外,还有部分MSTN基因编辑猪出现跛行现象[18],这可能与MSTN突变导致的猪隐性腿无力综合征有关[28]。
2.2 羊MSTN基因编辑进展
绵羊和山羊由于体型适宜,性情温顺,是最早的家养动物之一,可提供多种产品,包括羊毛、羊皮、肉类和奶制品。对MSTN进行基因编辑,是培育出具有优良肌肉性状羊的有效方法。羊MSTN基因编辑实例见表2。
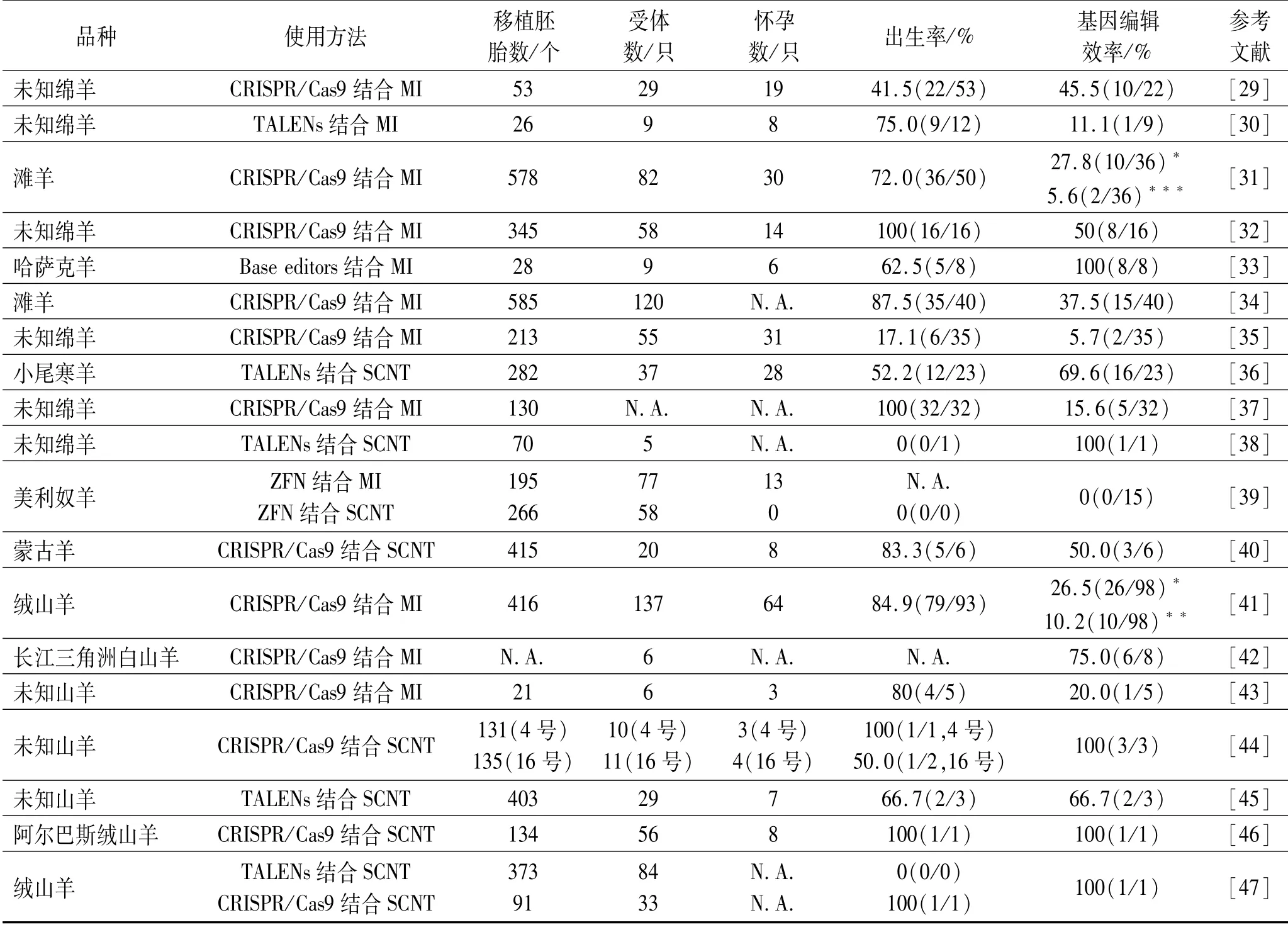
表2 羊MSTN基因编辑实例Tab.2 Exam p le of MSTN gene editing in sheep
山羊和绵羊的MSTN基因编辑大多使用的是CRISPR/Cas9和TALENs技术,从编辑效率来说CRISPR/Cas9显著高于TALENs,CRISPR/Cas9的敲除效率是TALENs的2.24倍[47]。在使用显微注射(microinjection,MI)生产基因编辑羊的实例中,羔羊MSTN纯合突变率也较低,如在绵羊中报道的有0[30]、25%[32]和36.4%[29],山羊中为33%[42]。
与预期相似,MSTN编辑后的羔羊体重会重于野生型(WT),背部、臀部和后腿部肌肉变化较为明显,但是每项研究出现体重显著性差异的时间有所不同。在绵羊中,M.Crispo等[29]的基因编辑羔羊在出生时体重和WT组没有差异,出生第15,30天时出现较大差异,第60天时超出20%~30%。其余如Zhou S.W.等[32]、Li H.H.等[36]的研究中,编辑羔羊出现显著差异的时间点大致相同,于出生后30,60,90天都表现出显著差异。也有研究者报道,羔羊体重在第60,90天未表现出明显差异,但在150~240 d表现出显著差异[31]。Ding Y.等[34]的研究中,基因编辑羔羊表现出与其他研究不同的变化,在0~60 d内体重存在显著差异,在90~180 d,基因编辑组体重高于WT组,但差异不显著。
在山羊上,He Z.Y.等[42]的基因编辑山羊表现出与绵羊不同的体重变化,基因编辑山羊在第0,20,36,60,90,120天的体重与WT山羊均没有显著差异,但在第210天的体重显著高于WT山羊。出现这种不同可能与研究人员使用的绵羊和山羊品种不同有关,遗传内在差异导致基因编辑后的羔羊出现不同的表型,具体的影响机制还需要进一步探索。
2.3 牛MSTN基因编辑进展
牛同样也是重要的畜牧物种之一,特别是在动物蛋白供应上,来自牛和水牛的牛奶及肉类占全球动物蛋白供应的45%[48]。因此增加牛肉产量和提高牛肉品质显得尤为重要,选择敲除负调控肌肉的MSTN基因也就成了科研人员的首要目标。牛MSTN基因编辑实例见表3。
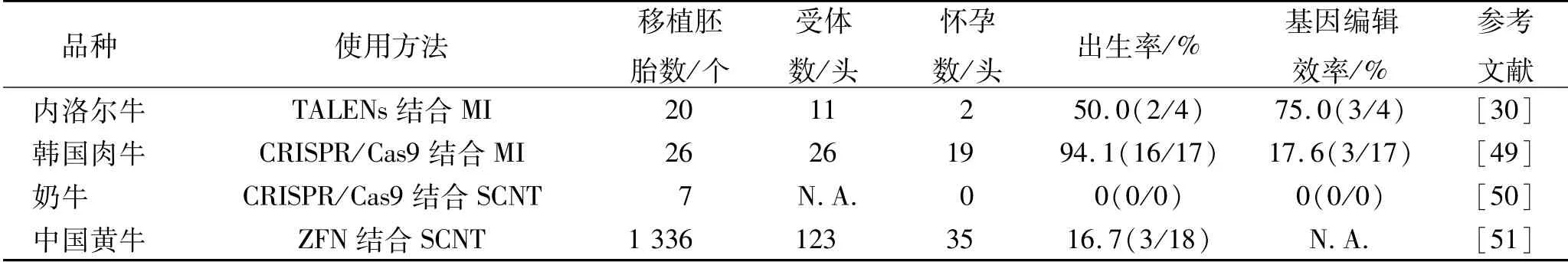
表3 牛MSTN基因编辑实例Tab.3 Exam p le of MSTN gene editing in cattle
相比于猪羊,牛MSTN基因编辑实例较少。牛MSTN基因编辑效率也比较低,大多数低于50%,出生率也相对较低,这说明牛MSTN基因编辑仍存在很多问题。MSTN基因编辑牛同样也出现了双肌表型,肩、髋部出现肌肉生长。由于基因编辑实例过少,未发现特殊的编辑表型。但有一个有趣的现象是在韩国肉牛基因编辑中,发现在细胞和胚胎试验时出现了多种突变模式,而所有基因编辑犊牛只发现了一种MSTN突变模式[49]。这表明其他的突变模式可能在胚胎移植后的某个时间段具有致死性,但对此缺乏试验证明,需要进一步研究。
3 家畜MSTN基因编辑存在问题及发展趋势
目前MSTN基因编辑在多种家畜上都已经取得不错的进展,在编辑效率和脱靶效应等方面都在不断改进。然而应用到生产实际中仍需面对很多挑战。如生产基因编辑动物的方法仍存在缺陷,生产MSTN基因编辑家畜是否安全及多基因联合编辑效率低等。特别值得注意的是,所有文章均未阐明SNP突变是否会改变MSTN基因在家畜各组织中的表达模式和是否会引发其他问题,这需要进一步试验证明。
3.1 基因编辑效率仍旧较低
当前生产基因编辑动物的主流方法是显微注射法(MI)和体细胞核移植法(SCNT)。通过显微注射进行基因编辑的生产过程,一般是胚胎在显微注射后不经过基因编辑效率检测而直接将胚胎移植到受体体内,在胎儿出生后再检测基因编辑效率。由于家畜妊娠时间较长,使得试验周期较长、科研经费投入较高。因此,提高胚胎基因编辑效率显得尤为重要。然而,目前显微注射基因编辑效率还不能令人满意。例如,在已经发表的利用显微注射法生产基因编辑MSTN羊的研究中,MSTN基因突变山羊占总出生 山 羊 的 比 率 分 别 为26.5%[41]、20%[43]和75%[42]。在绵羊上的编辑效率为分别为5.7%[35]、15.6%[37]和45.5%[29]。体细胞核移植技术已经发展了20年,但克隆大家畜出生率仍旧较低。虽然近年来一些基于早期克隆胚胎表观遗传修饰机制的研究提升了克隆动物胚胎的生产效率,但由于物种特异性差异,需要研究者深入解析不同家畜早期克隆胚胎发育的表观遗传机制,其成果有助于进一步提升基因编辑动物的生产效率。
3.2 基因编辑家畜健康问题
基因编辑动物健康问题一直被人们所关注,特别是像猪、牛、羊这样的家畜,其基因编辑后代是否健康是关系到能否大规模应用于生产的关键。目前,MSTN基因编辑家畜的存活率仍较低,例如在研究中,基因编辑仔猪在一周内全部死亡[14],甚至还有的24 h存活率仅为50%,存活的仔猪还出现了跛行现象[18]。这种死亡可能是由于体细胞核移植产生基因编辑动物的缺陷引起的,因为通过显微注射生产基因编辑猪存活率可达80%[22]。但在羊的研究中,使用显微注射产生了22只羔羊,有3只在出生第1天死亡,其中2只为MSTN突变羔羊,且死亡的MSTN基因编辑幼畜大多为双等位基因突变。显微注射实例虽较少,但也足以警示人们,MSTN突变的家畜可能存在健康问题,特别是纯合突变家畜。之前的研究也发现,缺乏MSTN基因的动物会表现出类似巨型胎儿综合症的疾病[52],MSTN纯合突变的比利时蓝牛会出现包括肺在内的多个器官体积减小[53];MSTN纯合敲除仔猪表现为前后肢异常、不能站立和行走,患病仔猪无法竞争哺乳并在出生后3 d内死亡(该结果尚未发表)[54]。基因编辑家畜的目的是为了产生优良性状,但若编辑家畜存活率低、优良性状无法表现,同时会导致无法应用于未来大规模生产。因此,MSTN基因编辑家畜的健康需要更全面的评估,如何设计生产出健康、与野生型无异的基因编辑幼畜一直是亟待解决的问题。
3.3 未来发展趋势
围绕基因编辑家畜MSTN基因的一系列问题,可以先从MSTN基因本身入手,运用分子生物学技术发掘更多上下游基因和结合位点,同时解析MSTN基因在不同家畜上的多态性,使用高通量测序及转录子分析技术,结合生物信息学方法,寻找有效的自然突变位点,为基因编辑打下基础。除加深对基因本身的研究外,改良使用工具也至关重要。单碱基编辑技术(base editing)是一项基于CRISPR/Cas9开发出的全新技术,目前能够实现碱基C到T、A到G[55]及C到G[56]的自由变换。对现有的文章进行检索,没有发现利用单碱基编辑技术对牛或羊包括MSTN基因在内的多个基因进行编辑的报道,而在猪上单碱基编辑技术已经同时被应用于对CD163、IGF2和MSTN基因进行编辑,仔猪中这些基因均发生了需要的突变,编辑效率为100%。因此在羊和牛多基因编辑上可以尝试单碱基编辑,以提高效率、优化育种。而面对有些文章提到的MSTN编辑安全问题,死亡大多出现在纯合敲除MSTN动物上,但如果使用单碱基编辑技术、不敲除MSTN基因,而是使用上述研究发现的SNP突变位点对其进行突变,生产肉质优良的家畜,可能是一种有效的解决基因编辑动物健康问题的方法。在动物育种方面,可以选择不同物种的动物,比如在猪、牛上发现了一些有效的SNP位点,且这些位点位于猪、牛、羊MSTN共同序列上,但在羊上未见突变报道,就可以在羊上运用单碱基编辑技术对其进行突变,研究该位点突变是否会对生长发育造成影响。同样不只是单碱基编辑技术,先导编辑技术在SNP突变方面更具优势。它可有效实现所有12种碱基的自由转换,而且还能有效实现多碱基的精确插入与删除[57],扩大了基因编辑范围,可实现更多自然位点突变。除此以外,还有改造Cas蛋白的多种新型CRISPR工具,如Cas12iMax、Cas12iHiFi[58]等,它们在实现高特异性编辑的同时,能够识别更多的PAM位点,突破编辑窗口单一限制,在今后的MSTN基因编辑过程中可提供更多的sgRNA选择,实现更高效的编辑。这些新技术产生的同时也面临着新的挑战,如先导编辑的编辑效率低、prgRNA设计困难,单碱基编辑容易脱靶等。但基因编辑也是一项不断发展进步的技术,最新研究表明,单碱基编辑技术实现了单窗口编辑,大大提高了编辑精确性[59]。先导编辑也在不断优化Cas9蛋白,从而提高编辑效率,增大应用范围[60]。因此,未来家畜MSTN基因编辑发展的主要方向依然是改良原技术、创造新技术。
4 结语
MSTN作为重要的肌肉生产调控基因,在动物育种方面意义重大。虽然目前MSTN基因编辑家畜实例很多,编辑方法也逐渐完善,但仍存在一些问题有待解决。因此,继续深入研究家畜MSTN基因功能、优化基因编辑方法,是高效生产MSTN基因编辑动物的基础。相信随着基因编辑技术的不断完善,和对MSTN基因编辑动物的不断了解,MSTN基因编辑家畜必将为促进畜牧业生产高效发展做出贡献。
