超声造影时间-强度曲线诊断肝硬化患者肝内小结节病灶价值研究*
2022-11-21张耀辉郑章增张亚利
张耀辉,郑章增,高 星,张亚利
肝硬化患者肝内小结节包括恶性结节和良性结节,其中约40%左右为恶性结节[1,2]。超声造影(CEUS)是诊断、鉴别肝硬化患者肝内小结节的常用检查方法之一[3,4]。对于小结节病理学性质的判断主要参照病灶在造影各时相的表现,具有一定的主观性。近年来,随着超声造影剂的不断研制和超声造影技术的快速发展, CEUS诊断病灶已由定性研究逐渐过渡到定量研究[5,6]。目前,关于CEUS时间-强度曲线诊断肝硬化伴肝小结节病灶的价值尚未完全清晰。本研究采用CEUS检查肝内结节患者,分析了时间-强度曲线上峰值强度(peak intensity,PI) 、上升时间(rise time、RT)和达峰时间(peak time,PT)等参数鉴别诊断肝硬化患者肝小结节病灶的价值,现报道如下。
1 资料与方法
1.1 临床资料 2019年2月~2020年12月我院诊治的肝硬化患者108例,男81例,女27例;年龄为34~65岁,平均年龄为(54.2±8.9)岁。肝硬化的病因包括乙型肝炎病毒感染65例,丙型肝炎病毒感染19例,原发性胆汁性肝硬化10例,酒精性肝病14例。肝硬化诊断符合《肝硬化诊治指南》[7]的标准。排除标准:接受过射频消融、介入或肝脏手术治疗者、肝外转移病灶、存在CEUS检查禁忌证或对本研究所用超声造影剂过敏者。
1.2 CEUS检查 超声检查前,禁食、禁水。取仰卧位,双臂置于身体两侧。使用德国西门子公司生产的Sequoia Paraon彩色多普勒超声检测仪(探头频率为1.5 MHz)检查,该仪器配有对比脉冲序列造影成像软件和自动追踪增强定量分析软件,机械指数为0.18。在CEUS前,行常规彩色多普勒超声检查,记录病灶形态、边界、内部回声等特征,并在清晰显示病灶的情况下,切换至CEUS状态。将Sono Vue冻干粉剂(意大利Bracco公司)59 mg加入生理盐水,配成浓度为8 μl/ml的六氟化硫微泡混悬液,用力振荡30 s,使微泡分散均匀。在谐波状态下,抽取2.5 ml混悬液经肘部浅静脉快速注射,再注入生理盐水5 ml。在注射造影剂期间,嘱患者平静呼吸,并启动超声图像工作站及内置光盘,记录扫查结果。在造影完成后,将造影动态图像导入随机自动追踪增强定量分析软件,在造影图像病灶处勾画出感兴趣区(尽量使勾画区域包括整个病灶)。在感兴趣区中选出病灶区、参考区(正常肝组织,范围和深度尽量与病灶相同),优化图像,由软件自动进行CEUS时间-强度曲线分析,得到动态血管模式曲线和时间-强度曲线(拟合度>70%),记录CEUS时间-强度曲线的PI、RT和PT。
1.3 图像分析与诊断 2名影像科医师独立进行双盲阅片。CEUS诊断恶性结节标准[8]:动脉相快速增强,门脉相和实质相快速消退呈低回声,呈“快进快出”现象;CEUS时间-强度曲线诊断恶性结节标准[9]:曲线陡直;CEUS诊断良性结节标准[10]:无明显异常增生血管,与病灶旁肝实质时相和强度基本一致,呈“慢进慢出”现象;CEUS时间-强度曲线诊断良性结节标准[11]:曲线平滑。

2 结果
2.1 组织病理学诊断情况 在108例肝硬化伴肝小结节病灶患者,经穿刺或手术后组织病理学检查,诊断肝细胞癌(HCC)43例,肝结节性再生性增生(nodular regenerative hyperplasia of the liver(NRH)65例。
2.2 典型病例CEUS表现 见图1、图2。
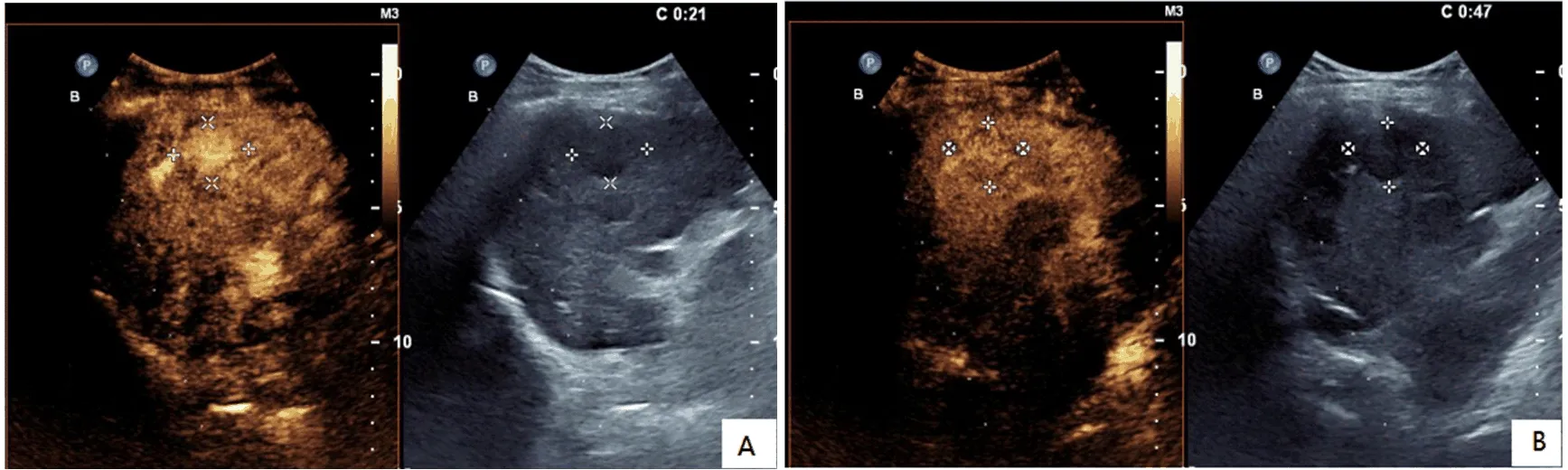
图1 HCC患者CEUS表现 55岁女性
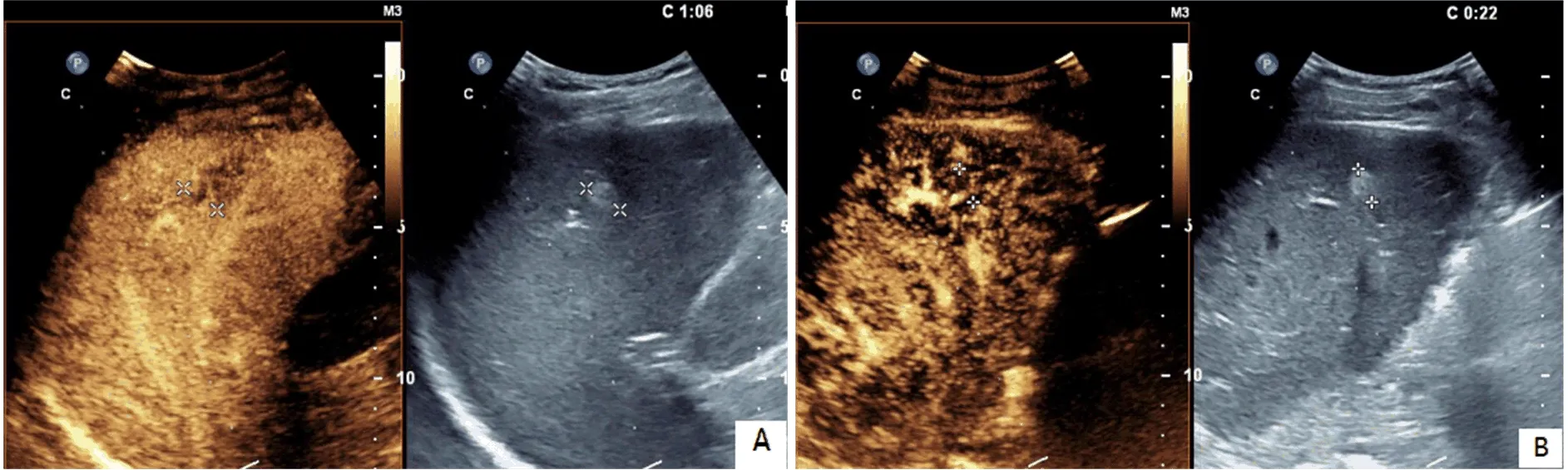
图2 肝结节性再生性增生患者CEUS表现 43岁男性
2.3不同组织CEUS时间-强度曲线参数比较 恶性结节组织PI水平显著高于良性结节或病灶旁肝组织(P<0.05),而RT和PT水平均显著低于良性结节或病灶旁组织(P<0.05,表1)。
表1 不同组织CEUS时间-强度曲线参数比较
2.4 CEUS和CEUS时间-强度曲线诊断肝硬化伴肝内结节效能情况 CEUS诊断恶性结节的灵敏度、特异度和准确性分别为72.1%、73.8%和73.1%,而应用CEUS时间-强度曲线诊断则分别提高到了97.7%、87.7%和91.7%(表2)。
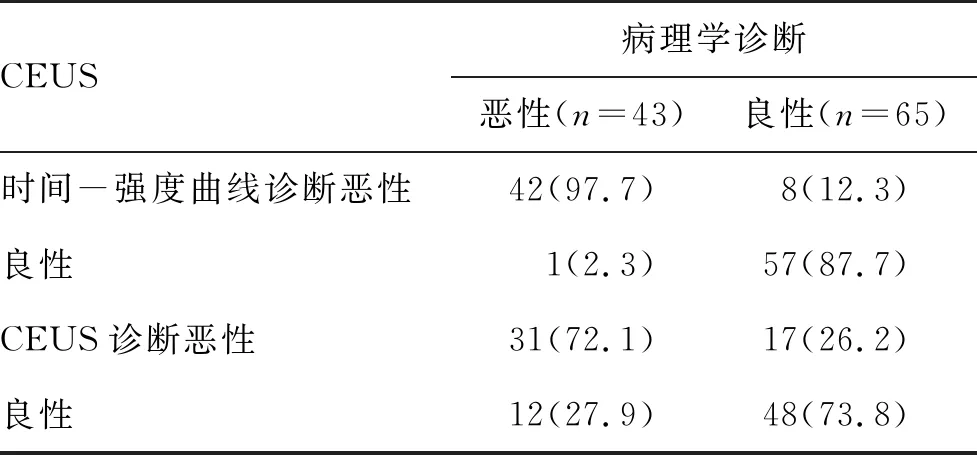
表2 CEUS参数诊断肝硬化肝内结节效能(%)分析
3 讨论
小肝癌发病复杂,肝硬化结节是其发生的重要阶段。肝内结节持续进展可发展为小肝癌,故早期发现、早期诊断出恶性结节意义重大[12,13]。常规彩色多普勒超声对位置深在、血流低速的肿瘤检测不敏感,不能充分表现出肿瘤内的血流灌注情况,而声学造影可动态显示出肿瘤内血管丰富程度和血流灌注情况[14]。CEUS技术与自动追踪增强定量分析软件相结合,不仅可清晰地显示出肝脏病灶血管和血流灌注随时间的变化情况,还可通过参数设置定量分析肿瘤内血管的丰富程度及灌注模式,避免肉眼观察的主观性干扰,在诊断肉眼无法鉴别的良、恶性占位病灶方面有明显的优势[15,16]。
本研究显示,病灶旁肝组织与良性结节组织CEUS显示的PI 、RT和PT比较差异均无统计学意义,而它们与恶性结节组织比,差异非常显著,提示与CEUS直观结果类似,肿瘤组织表现出造影剂“快进快出”的特征。肝脏内外血流动力学和微循环可影响肝脏实质对造影剂增强的变化过程。病理组织学认为组织纤维间隔形成后,隔中血管可将肝内门静脉血液分流入肝静脉,从而减少肝实质血供,导致肝内微循环障碍、肝内血管网减少,使造影剂的PI、RT和PT发生变化[17,18]。良性结节内无异常明显增生的血管。良性结节内动脉血供与正常肝实质基本一致,故CEUS时间-强度曲线诊断中的PI 、RT和PT与病灶旁肝实质的时相和强度类似[19,20]。小肝癌恶性病灶多由动脉供血,造影剂可于动脉期的早中期完全充填,导致达峰时间短,表现为“快进”的特点。恶性病灶内多见大量的新生血管,进而导致PI过高。
本研究发现,108例肝硬化伴肝内小结节病灶患者CEUS诊断为恶性结节31例,而CEUS时间-强度曲线诊断肝硬化伴恶性结节者42例,后者诊断的灵敏度、特异度和准确度显著提高,提示基于CEUS时间-强度曲线诊断肝硬化伴肝内小结节病灶的效能更高。本研究中有CEUS和CEUS时间-强度曲线均诊断恶性结节患者,CEUS显示早期动脉期轻度增强或快速强化,门静脉期仍填充,延迟期消退稍早于肝组织,而组织病理学检查则诊断为良性结节,故推测判断结节良性与恶性的重点不在于动脉期CEUS增强的程度,而在于门静脉期和延迟期的消退速度和程度[21,22]。相关研究显示[23,24],CEUS初始增强时间与肝内局灶性病变的动脉血供丰富程度有关。动脉血供越丰富,造影剂的初始增强时间就越短,与本研究结果类似,提示在判断肝硬化结节性质方面,恶性结节除典型的“快进快出”特征外,延迟期消退早于肝组织者,也可判定为恶性结节。
综上所述,基于CEUS时间-强度曲线参数诊断肝硬化伴肝内小结节病灶的准确率更高,可为临床诊断提供较为可靠的影像学依据,值得在临床上进一步验证。本研究的创新之处在于,通过对所有研究对象均行CEUS检查和CEUS时间-强度曲线分析,并进行对比分析,进一步强化的超声造影检查的优点。组织器官结节性病变越来越成为临床上的常见问题,给人群带来了困惑,也给临床医生提出了挑战。如何在众多检查中优选出合理、高效的方法,针对个体作出简单的选择,能叫准确地作出早期诊断,任重而道远。我们必须强调金标准概念,优化研究方案,得出令人信服的结论,给临床医生和患者一个满意的答案,而不是让他们无所适从。
