非酒精性脂肪性肝病进展性肝纤维化患者空腹血糖受损和胰岛素抵抗调查*
2022-11-21王晓华曾雅琳郭萃蓉
王晓华,曾雅琳,郭萃蓉
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是以弥漫性肝细胞大泡性脂肪变为病理学特征的临床综合征,大部分患者无症状,或仅有肝区隐痛、乏力等非特异性症状[1]。近年来,NAFLD已成为临床最常见的慢性肝病,伴有肝纤维化的NAFLD也愈来愈多,尤其是进展性肝纤维化,可引起疾病进展或肝硬化和肝癌[2]。因此,做好NAFLD患者肝纤维化的防治工作有重要的临床意义。研究[3]显示,胰岛素抵抗(IR)是NAFLD发生发展过程中的一个重要环节,对肝纤维化也存在影响[4,5]。本研究调查了NAFLD患者空腹血糖受损(impaired fasting glucose,IFG)和IR现象及其与肝纤维化的关系,现报道如下。
1 资料与方法
1.1 临床资料 本研究经我院医学伦理委员会审核通过,患者签署知情同意书。2020年5月~2021年5月我院健康管理门诊诊治的NAFLD患者110例,男62例,女48例;平均年龄为(55.8±10.2)岁。依据《非酒精性脂肪性肝病防治指南(2018年更新版)》的标准[6]诊断。排除标准:患有病毒性肝炎、自身免疫性肝病、药物性肝损伤等其他肝病;合并恶性肿瘤;妊娠或哺乳期妇女;伴有严重的感染或重要脏器疾病;近1个月内服用过影响糖脂代谢的药物。
1.2 口服葡萄糖耐量试验(OGTT)[7]常规进行。根据OGTT检查结果,将患者分为正常糖耐量(NGT)组、糖耐量异常(IGT)和IFG组,分别有43例、35例和32例。
1.3 研究方法 记录患者基线资料,包括年龄、性别、身高、体质量,血压等,计算体质指数(body mass index,BMI),即BMI=体质量/身高2;采集空腹血,测定血糖(FPG)和胰岛素(FINS)水平;NGT是指空腹血糖小于6.1 mmol/L,且口服葡萄糖后2 h血糖小于7.8 mmol/L;IGT是指7.8mmol/L≤口服葡萄糖后2 h血糖<11.1 mmol/L,且空腹血糖<7 mmol/L;IFG是指6.1mmol/L≤空腹血糖<7.0 mmol/L,且口服葡萄糖后2 h血糖<7.8 mmol/L;计算稳态模型胰岛素抵抗指数(homeostasis model insulin resistance index,HOMA-IR),即HOMA-IR=FINS×FPG/22.5,其中当HOMA-IR﹥2.69时提示存在IR[8];采用NAFLD纤维化评分(NAFLD fibrosis score,NFS)评估进展性肝纤维化,即NFS=-1.675+0.037×年龄+0.094×BMI+1.13×IFG或糖尿病(是=1,无=0)+0.99×天冬氨酸氨基转移酶/丙氨酸氨基转移酶-0.013×血小板计数-0.66×白蛋白,以NFS﹥0.676被定义为存在进展性肝纤维化[9];采用放射免疫法检测血清Ⅳ型胶原、Ⅲ型前胶原(procollagen Ⅲ,PCⅢ)、层黏连蛋白(laminin,LN)和透明质酸(hyaluronic acid,HA,上海恒远生物科技有限公司)。

2 结果
2.1 三组FPG、FINS和HOMA-IR指数比较 IFG组FPG、FINS和HOMA-IR指数显著高于IGT组或NGT组(P<0.05),而IGT组FINS和HOMA-IR指数显著高于NGT组(P<0.05,表1)。
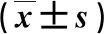
表1 三组FPG、FINS和HOMA-IR指数比较
2.2 三组血清肝纤维化指标的比较 IFG组血清Ⅳ型胶原、PCⅢ、LN和HA水平显著高于IGT组或NGT组(P<0.05),而IGT组Ⅳ型胶原、LN和HA水平显著高于NGT组(P<0.05,表2)。
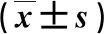
表2 三组血清肝纤维化指标的比较
2.3 进展性与非进展性肝纤维化的NAFLD患者有关指标比较及其发生进展性肝纤维化的因素分析 以NFS﹥0.676为标准,本组诊断进展性肝纤维化患者18例;进展性与非进展性肝纤维化组糖耐量试验和IR比较,差异有统计学意义(P<0.05),但两组年龄、性别(资料未显示)和BMI比较,差异无统计学意义(P﹥0.05,表3)。以NAFLD患者发生进展性肝纤维化为因变量,以糖耐量和IR为自变量进行多因素Logistic回归分析,结果显示,IFG和IR是NAFLD患者发生进展性肝纤维化的独立危险因素(P<0.05,表4)。
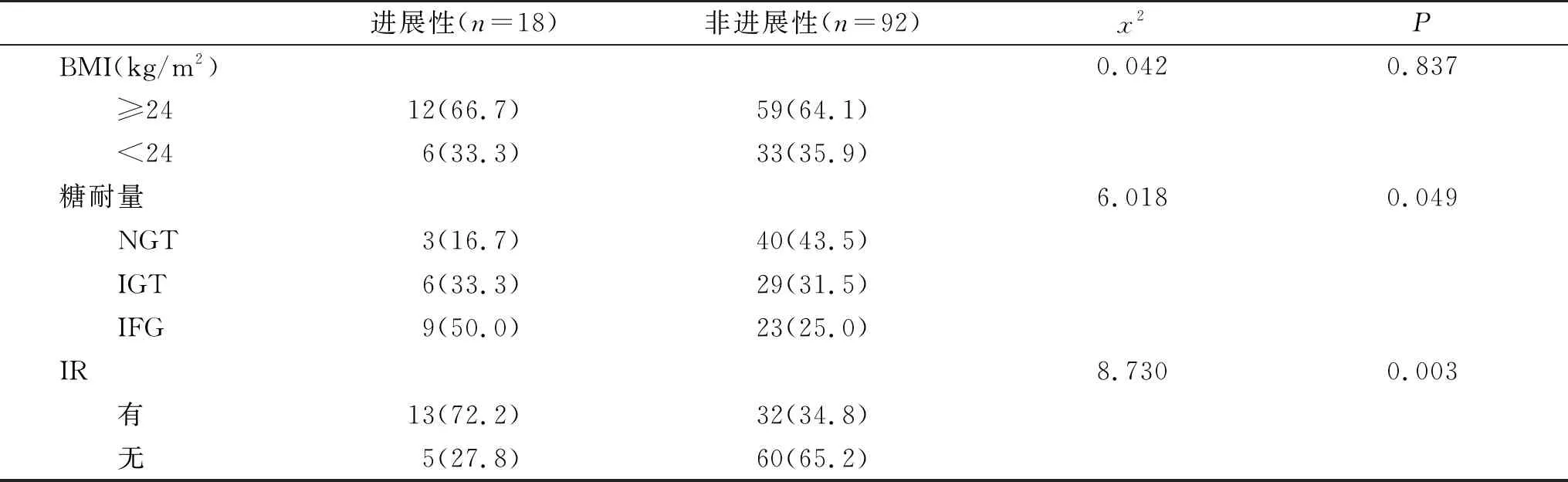
表3 进展性与非进展性肝纤维化组临床资料[n(%)]的比较

表4 NAFLD患者发生进展性肝纤维化的多因素分析
3 讨论
近年来,NAFLD作为全球重要的公共健康问题受到广泛的关注。随着肥胖和代谢综合征的日益流行,NAFLD增长迅速,且发病年龄呈低龄化发展。NAFLD的疾病谱包括非酒精性脂肪肝、脂肪性肝炎及相关肝硬化和肝细胞癌,其病理学改变与酒精性肝病相似,但患者并无过量饮酒史。NAFLD发病机制虽尚未完全明了,但大多认为与炎症反应、氧化应激、自噬等多种生理病理过程密切相关[10,11]。临床观察发现,与健康人比,2型糖尿病患者NAFLD发病率明显升高,非酒精性脂肪性肝炎和肝纤维化的发生率也更高[12]。这一结果表明NAFLD的发生与机体代谢失调存在关联,肥胖、高胰岛素、高血糖等相关因素可引起肝脂肪变,也决定NAFLD病情的严重程度,而NAFLD体内代谢失调将诱发和加重全身炎症反应和外周胰岛素抵抗,促进2型糖尿病的发生,两者互为因果。2型糖尿病是晚期肝硬化的高危人群,糖代谢异常作为糖尿病的前期状态,存在糖耐量异常的患者是否也推进肝纤维化的发展仍有待研究。
NAFLD促进脂肪的堆积,将导致病理性胰岛素抵抗,进一步增强外周组织脂肪分解和肝脏脂肪酸的摄入,减弱对胰岛素的敏感性,过多的游离脂肪酸经门静脉堆积于肝脏,加重肝脏内脂肪蓄积[13]。反映胰岛素抵抗的指标较多,如胰岛素抵抗指数、胰岛素钳夹技术、胰岛素抑制试验、胰岛素释放曲线等,其中HOMA-IR指数是应用最广的指标[14]。本研究结果显示,IFG组FPG、FINS和HOMA-IR指数显著高于IGT组和NGT组,且IGT组FINS和HOMA-IR指数显著高于NGT组,提示NAFLD患者IFG和IGT阶段已存在显著的胰岛素抵抗,与既往研究[15,16]结果相符。糖耐量异常是处于正常与2型糖尿病间的中间状态,胰岛素抵抗可能是引起糖耐量异常的始发因素。由于正常人胰岛功能健全,外周组织对胰岛素敏感,而NAFLD患者由于侧支循环建立、肝功能状态等改变,将影响体内代谢水平,容易出现糖耐量异常。因此,对于NAFLD患者需要进行早期干预,积极防止糖耐量异常的发生。
肝纤维化的发生主要与慢性炎症、损伤修复反应有关,最终会进展为肝硬化,这个过程涉及肝脏细胞外基质合成升高和降解下降。Ⅳ型胶原、PCⅢ、LN和HA均是细胞外基质代谢过程中的重要标志物,是衡量肝纤维化程度的重要依据[17]。Ⅳ型胶原是基底膜的主要成分,可反映基底膜胶原的更新率,是肝纤维化的早期标志;PCⅢ可反映Ⅲ型胶原合成,与肝纤维化形成的活动程度密切相关;LN为基底膜中特有的非胶原性结构蛋白,也可反映肝纤维化的进展和严重程度;HA是基质的成分之一,由间质细胞合成,可较准确灵敏地反映肝内已生成的纤维量和肝细胞受损情况[18,19]。在本研究,IFG组血清Ⅳ型胶原、PCⅢ、LN和HA水平显著高于IGT组和NGT组,且IGT组Ⅳ型胶原、LN和HA水平显著高于NGT组,说明IFG可能促进NAFLD患者肝纤维化进展。据报道,进展性肝纤维化不仅引起NAFLD患者并发症发生率增加,也是导致肝移植的重要原因[20]。故早期识别并及时干预NAFLD纤维化进展,对于改善患者预后有重要意义。为进一步分析NAFLD患者发生进展性肝纤维化的影响因素,我们的分析结果显示,进展性肝纤维化与非进展性肝纤维化患者糖耐量和胰岛素抵抗存在明显差异,且IFG和胰岛素抵抗是NAFLD患者发生进展性肝纤维化的独立危险因素。HOMA-IR指数是非糖尿病患者进展性肝纤维化的独立危险因素[21]。但本研究用NFS评估进展性肝纤维化,可能与实际肝纤维化诊断有一定的出入,后续还需要进行金标准诊断。
综上所述,NAFLD患者发生IFG时已存在明显的胰岛素抵抗,且IFG和胰岛素抵抗均是患者发生进展性肝纤维化的独立危险因素。在临床工作中,对于NAFLD患者应尽早筛查肝纤维化,尤其是存在IFG的患者,遵循个体化原则进行合理管理,以改善肝病结局。
