高强度聚焦超声联合人工液胸治疗不可切除小儿肝母细胞瘤短期疗效研究*
2022-11-21吴旭栋
蒋 彪,付 彤,吴旭栋
肝母细胞瘤(hepatoblastoma,HB)是起源于原始肝干细胞的肝脏恶性肿瘤,其发病率仅次于肾母细胞瘤和神经母细胞瘤。多数肿瘤为单发,多发于5岁以下的婴幼儿,男女比例约为1.5∶1.0~2.0∶1.0[1]。HB恶性程度较高,可通过血液和淋巴途径广泛转移,导致淋巴结和腹腔等部位出现转移性肿瘤[2]。目前,临床治疗HB主要以手术切除为主,但多数患儿就诊时已错失最佳治疗时机,单纯进行手术切除治疗早期并发症多,总体生存率低,容易出现复发和远处转移,尤其是Ⅲ期/Ⅳ期HB患儿,单纯肿瘤切除并不能获取较为满意的治疗效果。近年来,已有临床研究[3, 4]表明,采用化疗联合高强度聚焦超声(high intensity focused ultrasound,HIFU)治疗儿童肝脏肿瘤可有效延缓病情发展,提高肿瘤缓解率和手术可切除率,降低术后肿瘤复发率,延长患儿生存期,已成为治疗儿童肝脏肿瘤的较好选择。由于处于膈顶部的肝脏肿瘤常被含气的肺阻挡,导致采用HIFU治疗难度加大,而化疗药物常存在骨髓抑制和心肝肾等脏器功能损害[5]。目前,国外研究[6]肯定了采用HIFU联合人工液胸治疗膈顶部和边缘区域肝肿瘤的效果,但对于不可切除的HB患儿,在人工液胸下行HIFU治疗的临床效果,临床相关报道还较少。本研究采用HIFU联合人工液胸治疗不可切除的HB患儿,观察了疗效情况,现将结果报道如下。
1 资料与方法
1.1 一般资料 2018年6月~2020年6月我院收治的不可切除的HB患儿48例,男31例,女17例;年龄为2个月~7岁,平均年龄为(3.0±0.6)岁。诊断符合《儿童肝母细胞瘤多学科诊疗专家共识(CCCG-HB-2016)》[7]标准,均经活检或手术切除组织病理学检查诊断,外科评价为不可切除的中晚期肿瘤。排除标准:合并严重的心、脑、肾、肺等重要器官损害;合并其他脏器恶性肿瘤;美国麻醉师协会(American society of anesthesiologists,ASA)分级为V级;Child-Pugh分级为C级;大量胸水(压缩肺组织未超过1/3)但注水后病灶仍无法充分暴露;因无法耐受胸水[呼吸参数调整后血氧饱和度(blood oxygen saturation,SpO2) 仍持续低于94%]而抽出胸水者;肝外存在肿瘤转移;已接受外科手术治疗者;伴有精神性疾病无法配合检查。采用随机数字表法将患儿分为对照组24例和观察组24例,分别给予HIFU或HIFU联合人工液胸治疗观察12 w。两组一般资料和病情比较,无统计学差异(P>0.05)。患儿家属签署知情同意书,本研究获得我院医学伦理委员会批准。
1.2 人工液胸和HIFU治疗 使用重庆海扶技术有限公司生产的JC200型聚焦超声肿瘤治疗系统、美国欧美达公司提供的Ohmeda/5麻醉机和美国Corporation East Windsor 公司提供的I-STAT微量血气分析仪。术前行动脉穿刺测压、导尿。采用静脉和吸入复合全身麻醉,麻醉诱导:给予丙泊酚1.5~2.0 mg.kg-1、咪唑安定0.05 mg.kg-1、舒芬太尼0.5~1.0 μg.kg-1、顺式阿曲库铵0.1 mg.kg-1。气管插管后,连接Ohmeda麻醉机进行机械通气。选择容量控制通气模式,呼吸频率为16~20次/min,潮气量为8.0~10.0 ml/kg。按照手术要求对术中呼吸频率进行调整,吸呼比为1:2。给予持续静脉泵入瑞芬太尼、丙泊酚和顺式阿曲库铵维持麻醉,吸入氧浓度为40%~50%,于各操作步骤间断吸入1.0%~1.5%七氟烷。术中,常规给予恩丹西酮,避免术后呕吐。术毕前30 min给予舒芬太尼。构建人工液胸:在麻醉后,患儿取左侧卧位,取生理盐水500 mL,经输液管连接穿刺针。在超声引导下明确穿刺部位,采用硬膜外穿刺针顺着右腋前线第6、7肋间隙行胸腔穿刺,进入皮下组织后将输液器开关打开,缓慢进针,进入胸腔,将生理盐水注入胸腔,缓慢推开肺叶下极,在超声监测下直至肿瘤完全暴露,在肺压缩<1/3前,保持SpO2>94%,提示成功建立人工液胸。当SpO2≤94%或人工胸水诱导肺叶压缩为肺叶的1/3时,未完全推开肺下极,且未完全显现肝脏病灶,则不再继续注入胸水,提示人工液胸构建失败。由于肺脏可能出现粘连,根据病灶暴露状况给予部分病灶行HIFU治疗。HIFU治疗:待麻醉平稳后,将治疗区皮肤浸泡于“脱气水”(温度维持在10℃~15℃)中,结合术前影像学检查结果,在超声监视下判断治疗范围并明确治疗方案,在超声准确定位后经治疗探头诱导具备高能量的焦点于靶区进行三位立体扫描,治疗范围为焦域平均直径10 mm、焦域长度10 mm、频率0.9 Mhz、功率为30~300 w。当定位或治疗受患儿呼吸动度的影响时,则采取控制性通气诱导呼吸暂停,促使病灶呈静止状态。当SpO2降至90%并存在持续下降时,则立刻恢复通气。
1.3 疗效判定标准[7]在治疗后3 m,评估近期肿瘤缓解程度。完全缓解(complete response,CR):全部肿瘤病灶消失,影像学检查未发现肿瘤残留证据,血清甲胎蛋白(alpha-fetoprotein,AFP)正常且维持4 w以上;部分缓解(partial response,PR):肿瘤体积缩小50%或以上,且未发现任何新发病灶或疾病进展证据;疾病稳定(stable disease,SD):肿瘤体积缩小50%以下,且未发现任何肿瘤增大或新发病灶证据;疾病进展(progressive disease,PD):肿瘤体积增大25%或以上,或出现新发肿瘤,或连续2 w血清AFP水平升高至原水平的20%。
1.4 检测指标 使用美国贝克曼库尔特有限公司提供的AU5800型全自动生化分析仪检测血生化指标;采用双抗体夹心ELISA法检测血清AFP水平[罗氏诊断产品(上海)有限公司];采用免疫比浊法检测血清IgM、IgG和IgA水平(上海信帆生物科技有限公司);采用散射比浊法检测血清补体C3和C4水平(上海斐凡信息技术有限公司)。

2 结果
2.1 两组临床疗效比较 在治疗12 w末,观察组有效率显著高于对照组(P<0.05,表1、图1)。

表1 两组临床疗效[n(%)]比较
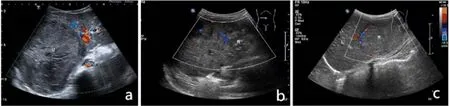
图1 HB患儿腹部超声表现
2.2 两组血生化指标和血红蛋白水平比较 在治疗12 w末,观察组血清ALT、AST和AFP水平显著低于对照组(P<0.05),而Hb水平显著高于对照组(P<0.05,表2)。
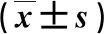
表2 两组血生化指标和血红蛋白水平比较
2.3 两组血清免疫球蛋白、C3和C4水平比较 在治疗12 w末,两组血清IgM、IgG、IgA、C3和C4水平比较,差异无统计学意义(P>0.05,表3)。
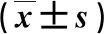
表3 两组血清免疫球蛋白和补体水平比较
2.4 两组并发症发生率比较 在治疗期间,观察组并发症发生率显著低于对照组(P<0.05,表4)。

表4 两组并发症发生率[n(%)]比较
3 讨论
HB作为一种主要由含有软骨、骨样和胚胎性间叶组织或者胚胎性上皮组织构成的胚胎性恶性实体肿瘤,约占儿童肝脏原发性恶性肿瘤的80%,恶性程度极高,与患儿低出生体质量及产妇年龄、肥胖、家族性腺息肉病等因素密切相关[8, 9]。目前,手术切除已成为治疗HB的首选方法,但据相关研究[10, 11]显示,大部分HB初诊患儿往往因肿瘤体积过大或已侵犯肝门、出现远处转移而无法实施手术切除,而对于不可切除的HB患儿采用HIFU治疗可有效提高手术切除率。但在HIFU治疗过程中,由于处于膈顶部的肿瘤组织常被含气的肺阻挡,致使HIFU治疗难度加大。国外研究[12]肯定了HIFU联合人工液胸治疗不可切除的HB患儿的效果,认为该方法能提供安全的超声通路,拓宽治疗范围,维持患儿呼吸、血流动力学和内环境稳定,并且可减少临近组织的损伤,避免严重并发症的发生。
本研究结果显示,观察组有效率显著高于对照组,而并发症发生率显著低于对照组,提示在人工液胸辅助下行HIFU治疗可保证治疗得到实施、安全[13-16]。HIFU治疗不仅可破坏肿瘤细胞,抑制肿瘤生长,而且可通过改善HB患儿免疫功能状态,提升抗癌效果[17-20]。
