肝细胞癌进展:代谢综合征相关危险因素研究
2022-11-21郑希彦林志群李瑞曦张广权何方平史宪杰
郑希彦,杜 飞,林志群,李瑞曦,周 正,张广权,周 红,何方平,史宪杰
肝细胞癌(hepatocellular carcinoma,HCC)是我国常见原发性肝癌类型,死亡率较高,仅次于肺癌和胃癌,且近年来发病率有着明显上升的趋势[1,2]。关于HCC发生的危险因素已进行多年探索,证实其与乙型肝炎病毒(hepatitis B,HBV)、丙型肝炎病毒感染、大量酗酒、吸烟和黄曲霉菌摄入等密切相关,但其发病机制仍未明确。代谢综合症(metabolic syndrome,MetS)是以肥胖、血脂异常、高血糖和高血压等代谢异常为主的临床症候群[3,4]。近年来,已有多项研究证实[5,6]中心型肥胖和2型糖尿病可增加HCC的发病风险,而对于MetS其他因素与HCC的相关性报道仍较少。目前,关于MetS与HCC的相关性研究多集中于日本和欧美等国家,HCC发病因素可能存在地区差异。基于此,本研究收集了我院诊治的HCC患者的病例资料,分析了合并MetS对HCC肿瘤进展的影响。
1 资料与方法
1.1 研究对象 2013年1月~2021年12月在中山大学附属第八医院肝胆胰外科收治的HCC患者203例,男性164例,女性39例;平均年龄为61.0±15.4岁。均符合2019年发布的原发性肝癌诊疗规范[7],纳入患者既往未接受过任何治疗,经病理学诊断为HCC(非手术治疗患者经穿刺活检病理学诊断),其中116例(57.1%)行肝癌切除术或肝癌消融术。MetS诊断标准参照屮国2型糖尿病防治指南(2017年版)[8]:(1)腹型肥胖(即屮心型肥胖):腰围男性≥90 cm,女性≥85 cm;(2)血糖升高:空腹血糖≥6.1 mmol/或糖负荷后2 h血糖≥7.8 mmol/L和(或)已确诊为糖尿病并接受治疗者;(3)血压升高:血压≥130/85 mmHg或已确认为高血压并接受治疗者;(4)空腹 TG≥1.70 mmol/L;(5)空腹 HDL-C<1.04 mmol/L。以上具备三项或更多项即诊断。排除标准:转移性肝癌或合并其他类型肿瘤,存在免疫功能障碍性疾病。
1.2 资料收集 包括年龄、性别、体质量、体质指数(body mass index,BMI)、腰围和血压;血清指标包括空腹血清葡萄糖(glucose,GLU)、γ-谷氨酰转肽酶(gamma-glutamyltransferase,GGT)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)、白蛋白(albumin,ALB)、高密度脂蛋白(high-density lipoprotein,HDL)、甘油三酯(triglyceride,TG)、总胆固醇(cholesterol,CHO);以影像学和组织病理学检查评估是否存在淋巴结转移和肝内多发病灶,超过单个病灶提示肝内转移、以合并腔静脉、门静脉癌栓与否或术后病理学检查提示微血管侵犯评估是否出现血管侵犯和远处转移。

2 结果
2.1 合并MetS与未合并MetS的HCC患者临床资料比较 合并MetS组GLU、TBIL、TG水平显著高于未合并MetS组(P<0.05),而HDL水平和合并HBV感染率显著低于未合并MetS组(P<0.05);合并MetS组肝内转移和淋巴转移发生率显著高于未合并MetS组(P<0.05),中心型肥胖和血压升高发生率显著高于未合并MetS组(P<0.05,表1)。
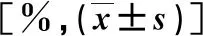
表1 两组HCC患者临床资料比较
2.2 合并MetS组分与HCC进展的关系情况 将存在肝内转移、血管侵犯、肿瘤最大径>5 cm、淋巴转移和远处转移等肿瘤生物学特征定义为肿瘤进展,结果合并MetS组分患者更容易发生肿瘤进展(P<0.05)。
2.3 影响肿瘤进展的MetS相关组分危险因素分析 经多因素Logistic回归分析显示,低HDL、血糖升高和血压升高是HCC发生肿瘤进展的独立危险因素(P<0.05,表2)。
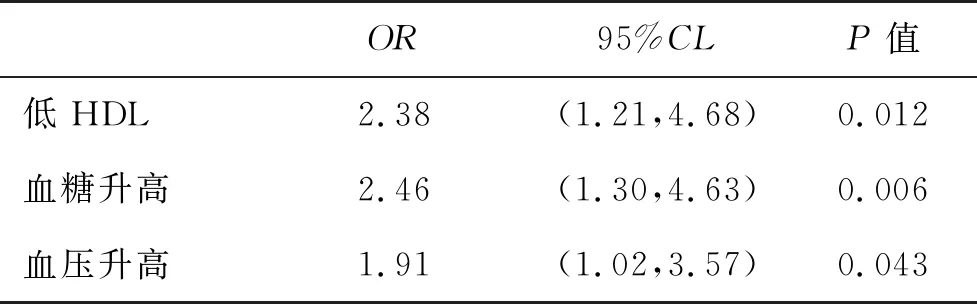
表2 多因素Logistic回归分析结果
3 讨论
我国MetS人群流行率呈现逐年上升的趋势,有学者提出其与恶性肿瘤的发生及发展具有密切的关系[9]。大量流行病学研究报道指出,MetS可能促进HCC的发生发展[10,11],尤其是在2型糖尿病人群,内脏脂肪堆积能促进HCC手术切除后肿瘤复发,这些研究数据来自欧洲,其主要的HCC病因是基于脂肪肝、酒精性肝病和丙型肝炎相关HCC。我国HCC患者约70%~95%具有HBV感染证据。目前,Mets对HBV感染相关HCC进展的相关性研究文献较少。本研究对Mets与HCC的关系进行了探讨。
HCC恶性进展的主要表现是肿瘤转移。90%HCC患者死于转移相关并发症。HCC的转移包括肝内转移、血管侵犯、淋巴转移和远处转移。一般临床观点认为肝内早期发生多个HCC病灶是肝内转移的结果,与HCC恶性程度相关,存在多发病灶的HCC患者预后较差。尽管淋巴结转移并非HCC患者最常见的转移方式,但合并淋巴结转移的HCC患者术后生存率明显低于无淋巴结转移者[12]。本项研究将肝内转移和淋巴结转移与否作为HCC发生就近播散和远处转移的指标,即疾病进展的标志,分析了代谢因素对HCC患者肿瘤进展的影响。
本研究纳入203例HCC患者,其中HBV感染者约占80.8%,共有89例患者同时满足合并MetS诊断,即至少合并血糖升高、血压升高、TG升高、HDL降低、腹型肥胖中的3项,提示本组HCC患者虽然以HBV相关为主,但合并MetS的比例显著高于普通人群。此外,未合并MetS组患者与合并MetS组HBV感染率存在显著差异(P<0.05),提示在非HBV感染的群体内,代谢综合征可能促进了HCC的发生。在对合并MetS与未合并MetS组疾病特征比较可见合并MetS组患者肝内转移和淋巴转移发生率显著高于未合并MetS组,这一结果提示MetS的存在可能促进了HCC的肝内转移和淋巴结转移。我们对代谢异常组分进一步分析,显示随着合并MetS代谢组分的增多,HCC患者发生肝内转移和淋巴转移的比例增高。
进一步对影响HCC患者疾病进展的因素进行分析,结果显示,低HDL、血糖升高和血压升高是影响HCC进展的因素,其中低HDL和血糖升高均是影响HCC发生肝内转移和淋巴转移的独立危险因素。多因素分析显示,低HDL、血糖升高和血压升高为促进HCC患者发生肿瘤肝内转移的独立相关危险因素。
HDL是一种由肝脏合成的脂蛋白,可提高外周组织的胆固醇清除作用,在维持细胞稳态上具有较为重要的价值[13]。在肝脏受损后,肝脏合成HDL功能减弱,其血清水平降低,机体维持细胞稳态功能下降,促进癌细胞的转移[14]。因此,我们推论血清HDL水平降低对HCC患者发生肝内和淋巴转移均有促进作用。有研究也提出血清HDL水平与肝癌的发生发展具有密切的关系[15]。我们的分析结果显示在HCC综合诊疗方面,血清HDL降低可能是一个值得重视的指标,因为血清HDL是一个重要的代谢组分之一。
高血糖是代谢性疾病中的常见表现。机体长期处于高血糖环境下,易激活氧化应激反应,造成肝细胞线粒体损伤并加速HCC的发展[16,17]。有研究也提到2型糖尿病患者发生HCC的风险相对较高,是HCC发生的独立危险因素之一[18]。结合本研究结论,我们认为即便是在HBV感染为主要病因的HCC患病人群,高血糖也会对HCC肝内和淋巴转移有促进作用。本研究显示高血压是影响HCC患者肝内转移的独立危险因素。既往有研究显示[19,20],肿瘤合并高血压的患者其肿瘤标志物水平相对较高,也从侧面反映了高血压对肿瘤发展的影响。分析其原因可能是,高血压患者存在高水平血管紧张素II,从而刺激血管内皮生长因子的生成,且机体长期处于高血压状态,血管内皮受损,激活炎性和氧化应激反应[21,22],促进肿瘤细胞的分化和转移。高血压和高血糖与肝脏疾病的发生明显相关[23]。本研究以HBV感染为主要病因的HCC患者群体为研究对象,其分析结果将有助于为HBV感染相关HCC合并代谢综合症患者的诊疗方案制定提供参考建议。
综上所述,MetS的发生促进了HCC患者肿瘤恶性发展,而低HDL、血糖升高和高血压是影响肿瘤进展的独立危险因素。研究HCC患者合并存在的MetS组分并做好控制可能对肿瘤的发生发展和治疗带来举足轻重的影响。本研究的不足为将同时合并代谢异常三个组分以上者才归入合并Mets组,而未纳入未达到三项代谢组分者,这意味着在所谓的未合并Mets组中也存在一些病例事实上也已存在一些代谢指标的异常,也就是说在未合并MetS组依然存在部分HCC患者合并有1项或2项代谢组分异常。尽管如此,我们的分析结果提示临床应积极干预HBV相关HCC患者合并存在的代谢异常,可能对控制病情、治疗应答和改善预后方面获益,进一步的研究将是有意义和必要的。
