小脑发育不良性神经节细胞瘤的多模态磁共振诊断*
2022-11-21何荣华任转勤田宏哲
何荣华 苏 航 张 坤 许 凯 王 艳 任转勤 田宏哲 张 明
1.西安交通大学第一附属医院医学影像科(陕西 西安 710061)
2.陕西省宝鸡市中心医院医学影像科(陕西 宝鸡 721008)
小脑发育不良性神经节细胞瘤(dysplastic cerebellar gangliocytoma)由Lhermitte和Duclos于1920年首次报道[1],又称Lhermitte-Duclos病(lhermitte duclos disease,LDD),是一种罕见的小脑良性肿瘤,目前国内外文献报道主要描述其CT及常规序列MRI表现,本文报道一例典型LDD,并复习相关文献,详细阐述其多模态MRI表现,旨在提高对本病的认识。
1 资料与方法
1.1 一般资料女性,29岁,2年前劳累时自觉间断性头痛、头晕,无视物不清,无恶心、呕吐,无肢体无力,休息可缓解;2周前头痛加重,额部及后枕部明显,呈间断性,偶有恶心,未呕吐,伴有颈部活动受限。查体见患者头围增大,颈部抵抗,个人史、婚育史、家族史均无特殊,实验室检查无异常。
1.2 方法采用GE MR750W 3.0T 8通道头部线圈,扫描序列及参数见表1。所得图像经AW4.6工作站后处理获得ADC图、CBF伪彩图、FA灰度图、FA方向彩色编码图、磁敏感图、各体素代谢图。FA方向彩色编码图中红色表示白质纤维走行方向为从左到右,蓝色表示从下到上,绿色表示从后到前,亮度表示此方向的权重;在皮质脊髓束走形区手工画出感兴趣区,采用“种子”法行纤维束追踪重建。

表1 磁共振扫描序列及参数
2 结 果
2.1 MRI结果左侧小脑半球见大小约6.2×7.9×4.6cm(RL×AP×SI)肿块影,占位效应显著,T1WI呈等、低信号,T2WI呈等、高信号相间条纹状,T2Flair呈略高信号条纹状,病变周围未见明确水肿区;DWI呈稍高信号影,ADC图呈稍高信号;颅神经成像示左侧面听神经轻度受压向前方移位;MRA示颅内大血管及主要分支未见明显异常;MRV示左侧乙状窦充盈不良;3D ASL(PLD=2.0s)CBF测值(单位mL·100g/min):病变区(60.987~61.367),对侧(46.145~50.238);DTI FA灰度图示病变区多个感兴趣区(ROI)FA平均值约0.253,对侧约0.425,FA方向伪彩图示病变区以红色为主,右侧小脑半球以绿色为主,白质纤维束追踪示肿瘤推压周围纤维束;SWAN图见病变区有增多小静脉血管影;增强扫描示病变内可见多发线状强化细小血管影;MRS示病变区域NAA略减低,Cho/Cr未见增高;病变延续至左侧桥小脑角区,左侧小脑中脚、脑桥、第四脑室受压,小脑扁桃体向枕骨大孔处下移,上段颈髓内见长T2信号影,幕上脑室扩张、积水,双侧侧脑室周围白质信号略增高。MRI结果:考虑小脑发育不良性神经节细胞瘤。
2.2 手术及病理结果探查:小脑扁桃体疝入枕骨大孔,下缘达寰椎水平,肿瘤位于左侧小脑半球,呈米黄色,无明确边界,血供一般,质韧,因肿瘤与正常脑组织无明确边界,遂行肿瘤部分切除术。病理示:送检组织由紊乱伴轻度异型性增生的神经节细胞样细胞及微囊变明显的胶质纤维及胶质细胞增生构成,瘤组织呈层状,可见增生的分子层,分子层内微囊形成,可见血管相关微小钙化,缺乏小脑颗粒层,代之以异常增生的神经元,神经元细胞排列紊乱,轴突缺失,部分细胞核深染。免疫组化:S-100(+),NeuN(节细胞+),Syn(+),CgA(节细胞散在+),Ki-67(1%),GFAP(胶质细胞+),NF(+),CD34(-)。诊断:小脑发育不良性节细胞瘤(WHOⅠ级),建议基因检测是否伴有多发性错构瘤综合征(Cowden综合征)。
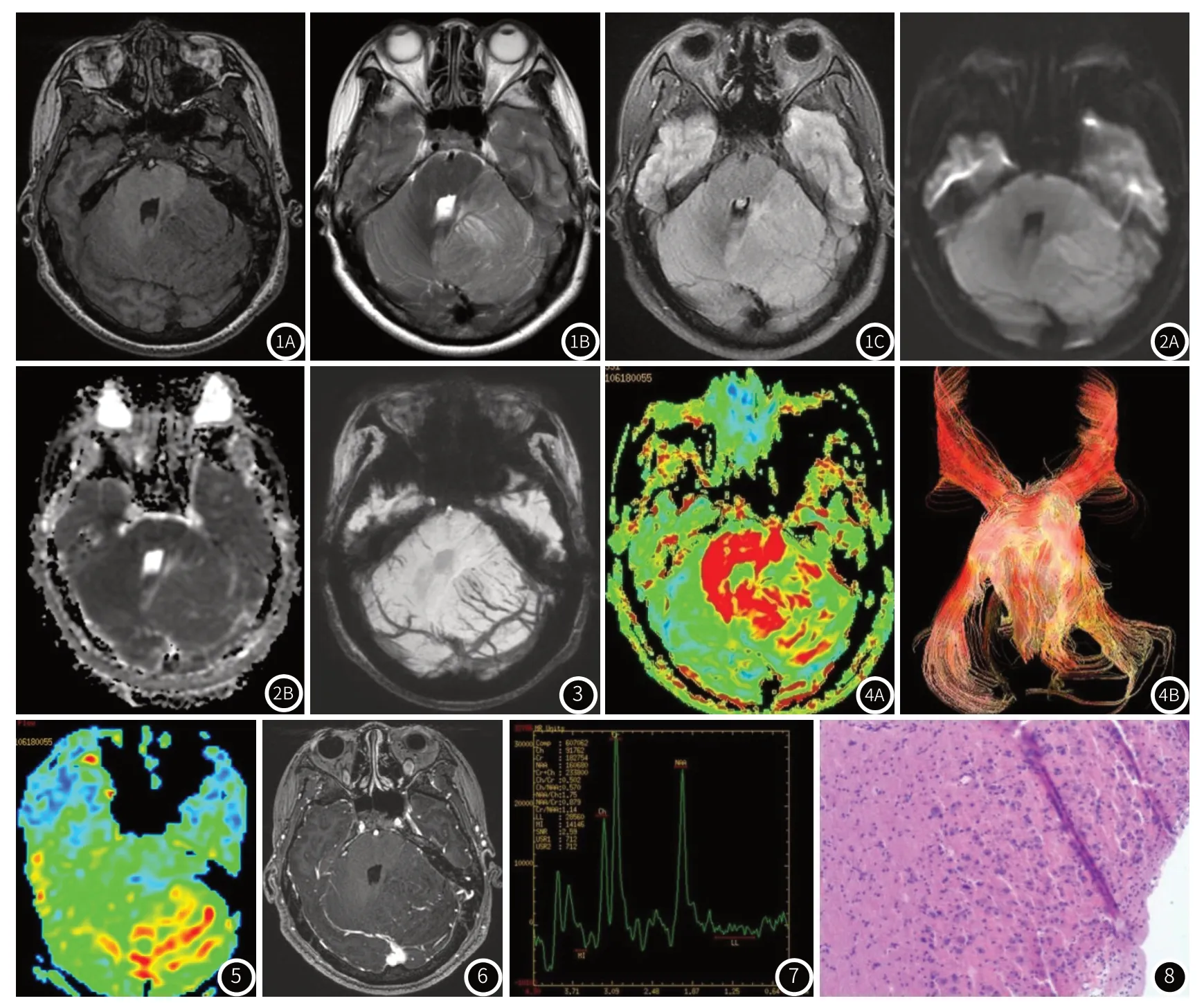
图1 图1A:T1WI,病变呈等低相间条纹影。图1B:T2WI,病变呈等高相间条纹影。图1C:T2FLAIR,病变呈略高信号条纹状,病变周围未见明确水肿区。图2 图2A:DWI图,呈稍高信号。图2B:ADC图,呈稍高信号,ADC值约(0.831-0.920)×10-3mm2/s。图3 磁敏感图(SWAN图),病变区见多发细小静脉血管影,引流入乙状窦及横窦。图4 图4A:FA方向伪彩图,病变区以红色为主,右侧小脑半球以绿色为主。图4B:白质纤维束追踪图,病变周围白质受压改变。图5 3D ASL(PLD=2.0s):病变区较对侧血流量增高。图6 增强,病变无强化,其内见多发细小血管影强化。图7 MRS图(病变中央区),NAA略减低,Cho/Cr未见增高。图8 HE染色病理结果(×200)。增生的分子层,分子层内微囊形成,缺乏小脑颗粒层,代之以异常增生、排列紊乱的神经元。
3 讨 论
3.1 LDD概述LDD是一种缓慢进展、具有错构瘤及真性肿瘤特征的良性小脑肿物[2]。本病罕见,多累及单侧小脑半球,偶尔累及双侧及小脑蚓部;青年人多发,20~40岁多见,性别无明显差异[3]。2016年WHO中枢神经系统肿瘤分类归为WHOⅠ级,属于神经元和混合性神经元-胶质肿瘤[4]。目前,有部分切除术后复发报道,尚未见病变恶变相关报道[5]。本病的病因与发病机制仍存在广泛的争议,主要学说包括肿瘤性、错构性、先天性起源。
多数病例早期无明显症状或出现因颅高压所致的较轻症状,后期可出现小脑扁桃体下疝、幕上积水、颅神经麻痹等。部分病例可与Cowden综合征相伴发生[6],确诊为LDD的病人应进一步检查甲状腺、乳腺、肠道等以除外合并肿瘤[7]。本例病人头围增大,有颅高压表现,无视力改变及颅神经麻痹症状,全身检查后未见Cowden氏综合征相关的临床表现。
3.2 LDD的多模态MRI表现①MRI平扫呈T1等、低、T2WI等、高信号相间条纹影—“虎纹”征[8],其被认为是诊断本病的特征性征象;病变周围水肿区少见;②DWI呈等、稍高信号影,ADC图多呈等、稍高信号,病变区水分子扩散受限不明显,考虑T2透射效应所致;少部分病例ADC值略降低,可能与神经胶质增生、轴索密度增加有关[9]。③DTI FA灰度图上病变区亮度降低、FA值减小,FA方向伪彩图上显示肿瘤区以红色为主,对侧小脑半球以绿色为主,考虑可能与颗粒层及节细胞层缺失、神经节细胞异常增生、排列紊乱、分子层增厚、病变区白质在主要扩散方向上的一致性丧失等有关;纤维束追踪示病变周围纤维束移位,考虑肿瘤的占位效应所致;肿瘤周边组织ADC值减低、FA值增高,推测与组织受压缺血、细胞外水容量减少有关[10]。FA方向伪彩图及纤维束追踪重建可以清楚显示病变对周围组织推移及肿瘤与周围纤维束关系。④MRA、MRV:可显示颅内大血管情况,本例病人左侧乙状窦及横窦充盈欠佳,考虑系病变压迫所致;⑤SWAN对不同组织磁敏感性差异高度敏感,故对病变区出血及小静脉显示能力较强。本例病变区见多发小静脉,此被认为是LDD的重要征象,既往文献中行此序列检查者较少;⑥本病例PLD=2.0s时呈高灌注,与既往文献报道一致[10];⑦增强扫描病变无强化,部分病变内见增多细小血管影;本例病变增强所见血管影结合磁敏感图,认为是小静脉血管,与既往Moenninghoff等[11]用7.0TMR磁敏感成像发现的异常小静脉一致,此被认为是LDD的独特征象。由于肿瘤内小血管多且缺乏内部弹性膜、血管反应性增高、异常增生的神经元摄取葡萄糖增高[12],致使灌注增高,而瘤体血脑屏障完整,所以增强未见强化或仅见线样强化。⑧MRS:无异常或NAA减低,考虑与异常增生的神经元有关;LDD中Cho/Cr无增高,而低级别胶质瘤的Cho峰升高,可资鉴别;LDD可出现Lac峰、缺乏Lip峰、Cho峰减低,表明糖无氧酵解增加,细胞髓鞘脱失。
随着病变进展、占位效应显著,可出现脑桥受压移位、第四脑室变小、幕上脑积水、间质性脑水肿、小脑扁桃体下疝等,MRI多模态成像对以上改变可敏感、准确的识别。
3.3 影像表现的病理学基础大体病理见小脑半球肿瘤样肿块替代局部正常脑组织,脑叶增厚呈层状,此与MRI观察到小脑局部肿块形成、皮质增厚一致。镜下见小脑颗粒细胞层和节细胞层被异常增生的神经元取代,分子层含有异常增生的有髓纤维而增宽,肿瘤与正常组织呈分层状结构,其中T1/T2WI的低/高信号区对应病变脑叶中心,包括萎缩的白质、异常的颗粒细胞层和节细胞层和增厚的内分子层,T1/T2WI的等信号区对应于脑叶的表层,包括外分子层及软脑膜层。镜下见到增多小血管影可由SWAN序列显示,钙化明显时可在CT上呈条状高密度影,MRI上呈双低信号,本例病理上见血管相关微小钙化,CT及MRI上未见明确钙化。
免疫组化:神经元标志物如突触素(Syn)、神经元特异性烯醇化酶(NSE),神经纤维丝(NF)等呈阳性,胶质细胞标志物如胶质纤维酸性蛋白(GFAPG)等阴性表达,MIB-1LI<1%,Ki-67阴性或小于1%,提示肿瘤无明显增殖活性[13]。本例病人胶质纤维酸性蛋白(GFAPG)阳性考虑病变内可能存在部分正常组织,其余免疫组化标志物与文献报道一致[13]。
MRI多模态成像不仅有助于病变细微结构观察、成份分析、提高对常规扫描难以鉴别的幕下肿瘤的性质判定,亦利于观察病变与周围血管、神经、重要组织的关系、发现更多并发征象、评估颅脑功能,为临床医生术前选择安全入路、避开重要脑结构、尽量完整切除肿瘤、评估预后提供有利支持,更有利于术后与病理相互验证,深层次解析病变特征。总之,多模态MRI成像在LDD诊断中有重要作用,但目前仍需要大宗病例多参数成像回顾性研究、深入探索和充分描述这一罕见疾病的影像学及病理生理特征。
