高效液相色谱法测定食用油中7种抗氧化剂的含量
2022-11-21卢姗,伍志航,刘海卿
食用油是人们生活中的必需品之一,但油脂极易被氧化,不宜长时间储存,氧化不仅使食用油褪色、变色,还会破坏食用油中的维生素等营养物质,进而降低食用油的感官品质,使其变质,甚至产生有害物质,引起食物中毒[1]。因此在食用油生产过程中需要加入抗氧化剂。目前,食品抗氧化剂在食用油中的应用极为广泛,常用的食品抗氧化剂种类有人工合成的叔丁基对羟基茴香醚(Butyl Hydroxy Anisol,BHA)、二丁基羟基甲苯(Dibutyl Hydroxy Toluene,BHT)、没食子酸丙酯(Propyl Gallate,PG)、叔丁基对苯二酚(Tert-Butylhydroquinone,TBHQ)[2]。本实验以上述4种常见的抗氧化剂为研究对象。此外,参考近年间白酒中检测出塑料制品用塑化剂的报道,本实验把食品接触材料(塑料瓶)中的常见抗氧化剂也一起列入研究范围[3]。食用油在长期储存的情况下,盛装容器添加的抗氧化剂有可能渗透或者迁移到食用油中,并随着食品进入人体,对机体内正常的内分泌系统造成影响,干扰机体内激素的合成、释放、运转、代谢及结合的过程,有损血浆中正常激素水平的维持,故将塑料中常用的2,2'-亚甲基双-(4-甲基-6-叔丁基苯酚)(抗氧化剂2246)、四(3,5-二叔丁基-4-羟基)苯丙酸季戊四醇酯(抗氧化剂1010)和三(2,4-二叔丁基苯基)亚磷酸酯(抗氧化剂168)这三种抗氧化剂作为补充研究对象,弥补食用油中抗氧化剂检测的遗漏[4]。
目前,《食品安全国家标准 食品中9种抗氧化剂的测定》(GB 5009.32—2016)规定了食品中9种抗氧化剂的测定方法。《食品容器、包装用塑料原料 第2部分:聚乙烯中抗氧剂和芥酸酰胺爽滑剂的测定 液相色谱法》(SN/T 1504.2—2017)规定了食品容器,包装用塑料原料抗氧化剂的测定方法,而对于可能存在于食品中由塑料产品迁移到食品中的几种常见抗氧化剂的测定尚未规定方法。
本文采用高效液相色谱法技术建立了一种简单、快速测定食用油中多种抗氧化剂的方法。该方法具有较好的线性关系、精密度和回收率,还具有分离效能高、选择性高、检测灵敏度高和分析速度快等优点[5-10]。基于以上优点选择高效液相色谱法作为本实验的检测方法,为高效液相色谱法快速测定食用油中抗氧化剂试验在普通实验室的建立和应用提供参考。
1 材料与方法
1.1 仪器、试剂及耗材
1260 Infinify II高效液相色谱仪(美国安捷伦公司);Centrifuge 5804R高速离心机(德国Eppendorf公司);ME 204电子天平(瑞士梅特勒.托利多公司)、-1100旋转蒸发仪(日本EYELA公司)、超声波清洗机(广州吉普公司)、Milli-Q去离子水发生器(美国Millipore公司)。
甲醇(色谱纯,美国赛默飞世尔科技公司);乙腈(色谱纯,美国赛默飞世尔科技公司公司)、Bond Elut C18柱(2 g,20 mL,120 µm,美国安捷伦公司)。
没食子酸丙酯(CAS:121-79-9,纯度:99.7%,Dr.Ehrenstorfer);叔丁基对苯二酚(CAS:1948-33-0,纯度:99.2%,Dr.Ehrenstorfer);叔丁基对羟 基 茴 香醚(CAS:25013-16-5, 纯 度:99.4%,Dr.Ehrenstorfer);二丁基羟基甲苯(CAS:128-37-0,纯度:100%,北京哈曼格生物科技公司);2,2'-亚甲基双-(4-甲基-6-叔丁基苯酚)(抗氧化剂2246)(CAS:119-47-1,纯度:99.3%,上海安谱实验科技股份有限公司);四(3,5-二叔丁基-4-羟基)苯丙酸季戊四醇酯(抗氧化剂1010)(CAS:6683-19-8,纯度:98.2%,上海安谱实验科技股份有限公司);三(2,4-二叔丁基苯基)亚磷酸酯(抗氧化剂168)(CAS:31570-04-4,纯度99.05%,Dr.Ehrenstorfer)。
1.2 实验方法
1.2.1 标准溶液的配制
分别称取没食子酸丙酯(Propyl Gallate,PG)、叔丁基对苯二酚(Tert-Butylhydroquinone,TBHQ)、二丁基羟基甲苯(Dibutyl Hydroxy Toluene,BHT)、叔丁基对羟基茴香醚(Butyl Hydroxy Anisol,BHA)、四(3,5-二叔丁基-4-羟基)苯丙酸季戊四醇酯(抗氧化剂1010)、2,2'-亚甲基双-(4-甲基-6-叔丁基苯酚)(抗氧化剂2246)、三(2,4-二叔丁基苯基)亚磷酸酯(抗氧化剂168)0.2 g(精确至0.000 1 g)于100 mL的容量瓶中,加入约5 0 mL乙腈,待完全溶解后再用乙腈定容至刻度,配制成浓度均为2 000 mg·L-1的标准品混合溶液。用乙腈稀释成浓度分别为 0.5 mg·L-1、1.0 mg·L-1、2.0 mg·L-1、5.0 mg·L-1、10.0 mg·L-1、20.0 mg·L-1、50.0 mg·L-1、100.0 mg·L-1和200.0 mg·L-1的系列标准工作液。
1.2.2 样品前处理
准确称取1 g(精确至0.000 1 g)样品于50 mL具塞离心管中,加入10 mL乙腈溶液涡旋提取2 min,超声30 min,8 000 r·min-1离心1 min,收集提取液于另一离心管中,待净化。
将提取液倒入装有约2 g无水硫酸钠并经活化的C18固相萃取柱中,收集流出液,再用15 mL甲醇溶液洗脱萃取小柱,控制流速至每秒1~2滴,合并流出液与洗脱液于旋转蒸发瓶中,于40 ℃下旋转蒸发至近干,加2 mL乙腈复溶,充分溶解后过0.22 μm有机系滤膜,供液相色谱仪测定。
1.2.3 液相色谱条件
色谱柱:X Bridge C18柱(5 μm,4.6 mm×250 mm);柱温:室温;检测波长:230 nm;进样量:10 μL;流动相与梯度洗脱条件见表1。
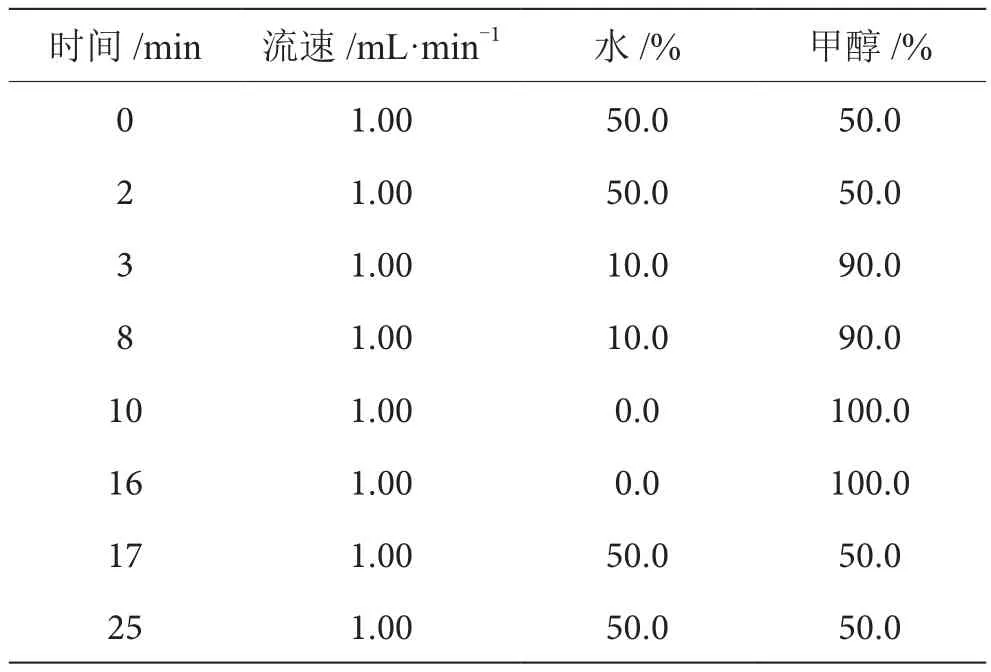
表1 流动相及梯度洗脱条件表
2 结果与分析
2.1 前处理条件的优化
2.1.1 提取条件的优化
《食品安全国家标准 食品中9种抗氧化剂的测定》(GB 5009.32—2016)对于油类样品的提取采用以正己烷溶解后加入乙腈萃取的方式进行。考虑到本研究中作为食品包装材料中常用的抗氧化剂2246、抗氧化剂1010和抗氧化剂168的极性小,萃取效果可能不理想,本研究直接用乙腈提取,并以加标回收的方式与国家标准方法进行对比,结果如图1所示,两种方法的PG、TBHQ、BHA、BHT的回收率接近,而按国家标准方法提取的抗氧化剂2246、抗氧化剂1010和抗氧化剂168回收率较低。
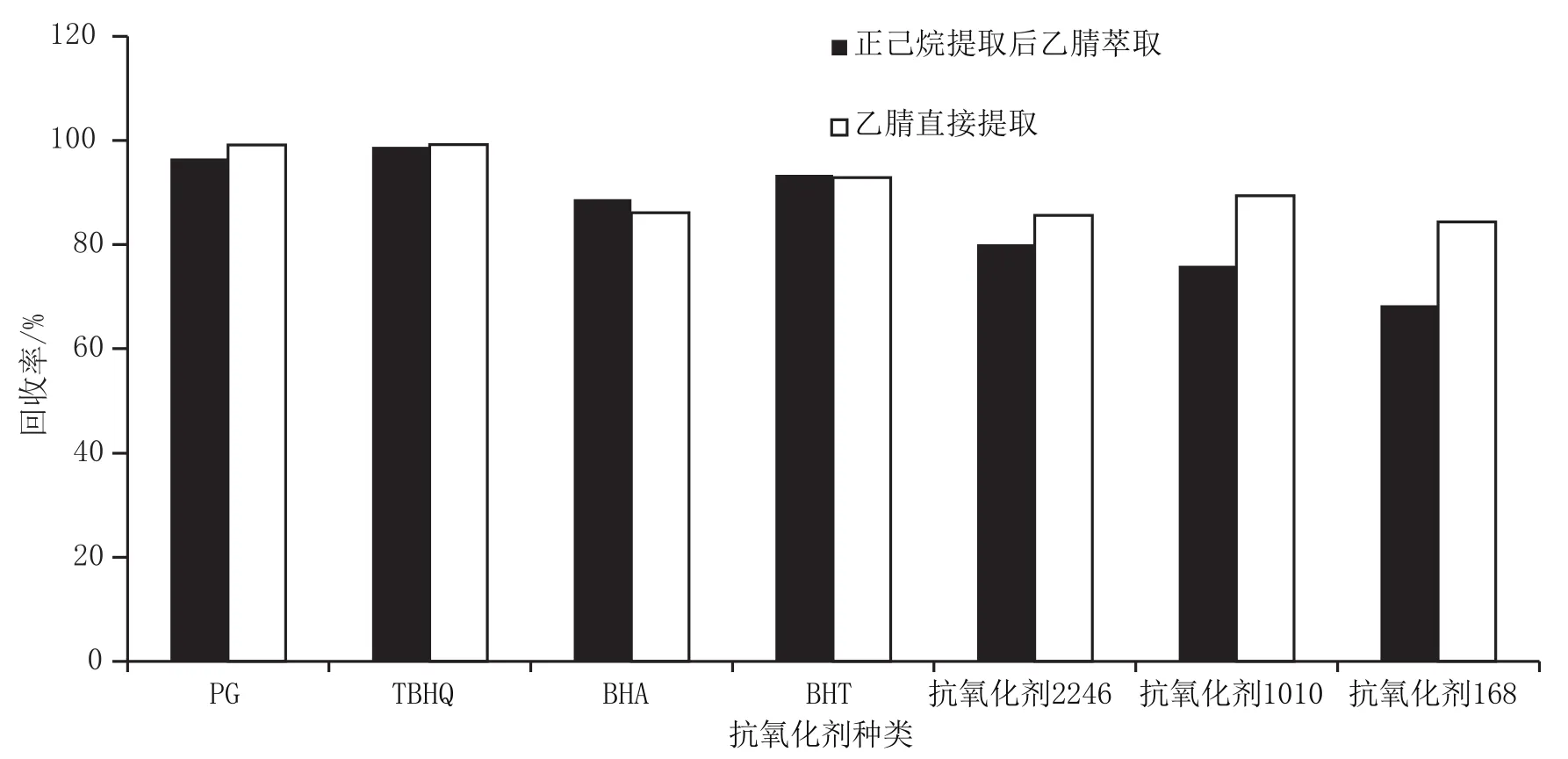
图1 两种提取方法的回收率对比图
2.1.2 净化条件的优化
考虑到食用油中组分相对复杂,研究人员通常用C18固相萃取柱对其进行净化,本研究对是否过固相萃取柱净化做对照实验,取同一样品分别以乙腈直接提取和按2.2前处理方法过柱净化两个方法处理后上机测定的色谱对比图如图2,如图所示C18固相萃取柱的净化效果良好。

图2 提取后过柱与不过柱色谱图对比图
在确保待测物回收率不受影响的前提下尽量优化净化效果,本文进一步做洗脱效果的对比实验。对6个加标样品按照前处理方法提取后,将提取液加至经活化的C18固相萃取柱,接收样品流出液后再以每次5 mL甲醇多次淋洗C18固相萃取柱,将样品流出液以及每次淋洗液分开收集浓缩后上机测定。6个样品各个组分在各个流出液的平均回收率如表2所示。综合考虑各个组分的洗脱情况,本研究采取将样品流出液和15 mL洗脱液合并收集的方法。

表2 各组分的洗脱效果平均回收率对比表(单位:%)
2.2 方法学验证结果
2.2.1 线性范围及检出限
按照上述标准溶液配制方法配制系列标准工作液,分别上机测定,以浓度为横坐标、峰面积为纵坐标绘制标准曲线。7种抗氧化剂在质量浓度范围0.5~200.0 mg·L-1内线性良好,再在空白样品中加入适量的标准品混合溶液,按照上述的前处理方法处理加标样品,根据色谱图信噪比(S/N)>3确定方法检出限。本方法在浓度范围0.5~200.0 mg·L-1内的线性方程、相关系数及检出限见表3。

表3 各组分线性方程、相关系数及检出限表
2.2.2 方法回收率和精密度
在空白样品中加入标准物质,按上述前处理方法处理后测定,当添加水平为 5 mg·kg-1、50 mg·kg-1、100 mg·kg-1时,回收率范围为81.66%~95.58%,相对标准偏差(n=6)均小于10%,样品加标图谱见图3,具体平均回收率及相对标准偏差见表4。

表4 各组分平均回收率及相对标准偏差表(n=6)

图3 样品加标图谱图
2.2.3 实际样品测定
按照本方法对50个市售植物油进行检测,其中2个样品中检出TBHQ,检出含量分别为0.016 g·kg-1,0.072 g·kg-1。其他项目均未检出。
3 结论
本文针对食用油中食品及食品包装材料常见的7种抗氧化剂建立以乙腈提取、C18固相萃取柱净化、高效液相色谱仪测定的检测方法。本方法高效、准确、灵敏度好,适用于日常食用油中抗氧化剂的检测。
