膳食胆酸对营养性肥胖大鼠肠道炎症的改善及对肠道菌群中拟杆菌门与厚壁菌门比例的影响
2022-11-19范艳飞彭卫群洪小瑜吴佩娴
陈 说, 张 帆, 范艳飞, 彭卫群, 洪小瑜, 吴佩娴
北京大学深圳医院内分泌科,广东 深圳 518036
肥胖症是一种由各种原因导致脂肪组织在体内过度蓄积的代谢障碍性疾病,一般以体质量超过标准体质量10%~15%为界定肥胖的标准[1]。肥胖症病因分为内源性、外源性两种因素,前者包括遗传、内分泌失调等,后者为摄入过多高碳水化合物、高脂肪食物或运动不足[2]。此外,Macchione等[3]报道,肠道菌群稳态失衡也可诱发肥胖症。当前,许多研究[4-5]均指向通过药物控制体质量的研究方向,但实际上仅有小部分药物被批准用于临床,且其潜在不良反应不可避免。胆酸是动物体内胆固醇代谢时产生的固醇类物质,由于其经胆囊与胆汁一同排泄至肠道,且具有酸性,故称为“胆酸”,多项报道[6-7]证明,其可促进糖类新陈代谢。现阶段,胆酸不仅是胆固醇代谢副产品,在膳食脂类吸收与胆酸合成方面发挥重要作用,Sun等[8]报道,消融肠道微生物群可通过调节胆酸代谢来减轻肥胖所致脂肪肝和葡萄糖耐受不良等问题。但胆酸对肥胖人群的肠道炎症及其对生物群结构的作用及其机制的报道较少见,故本研究以膳食胆酸为实验药物,分析其对营养性肥胖大鼠模型肠道的影响及可能机制,为营养性肥胖治疗研究新的方法。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性Wistar大鼠,60只,7周龄,体质量260~270 g,购自中国医学科学院医学生物学研究所[生产许可证号:SCXK(滇)K2019-0002]。实验开展前适应性饲养1周,动物实验室温度20~25 ℃,湿度40%~70%,自然光照,自由摄食、饮水。本实验全部操作符合一般动物实验伦理学原则。
1.1.2 药物、主要试剂和仪器:膳食胆酸(纯度99.8%,西华天生物科技有限公司),芬氟拉明片(北京曙光药业有限责任公司,国药准字H11021033,规格20 mg)。甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)试剂盒(中生北控生物科技股份有限公司),大鼠血清肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6) ELISA试剂盒(晶美生物工程有限公司)。兔抗大鼠G蛋白偶联胆汁酸受体1(G-protein coupled bile acid receptor 1,GPBAR1/TGR5)、核因子κB(nuclear factor-κB,NF-κB)、GAPDH一抗(ABcam,货号ab72608、ab145954、ab3486),辣根过氧化物酶标记的山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司,货号ZB2306)。BS-800全自动生化分析仪(迈瑞医疗国际股份有限公司),164-5070蛋白电泳仪(美国Bio-Rad公司)。
1.2 方法
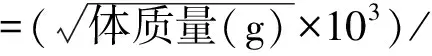
1.2.1 造模、分组和干预:取50只大鼠建造营养性肥胖大鼠模型[9],予以高脂饲料(饲料组成:30%猪油、65%基础饲料和5%蛋黄粉;主要营养成分:蛋白质20%、碳水化合物30%和脂肪35%)喂养,每日一次性提供足够饲料,自由饮水,喂养12周后称重,若造模大鼠与健康大鼠体质量差值/健康大鼠体质量×100%>20%,表示造模成功。经筛选获得40只营养性肥胖大鼠,随机分为模型组、低剂量组、高剂量组和阳性对照组,每组各10只。剩余10只设为健康组,予以基础饲料(基础饲料组成:玉米280 g/kg、麸皮300 g/kg、豆饼200 g/kg、小麦110 g/kg、鱼粉80 g/kg、骨粉20 g/kg、食盐1 g/kg、多维素0.075 g/kg和植物油500 ml,主要营养成分:蛋白质20%、碳水化合物35%和脂肪5%)喂养,1次/d。
造模成功后,阳性对照组灌胃4.16 mg/kg芬氟拉明(该剂量参考黄继汉等[10]提出的“动物与人每公斤体质量折算系数6.25”计算所得),低剂量组、高剂量组分别灌胃50、100 mg/kg膳食胆酸(用0.5%羟甲基纤维素钠溶解)[11],模型组和健康组灌胃等体积0.5%羟甲基纤维素钠,1次/d,连续干预17 d。
1.2.3 ELISA检测血清炎症因子和血清生化指标检测:末次给药后,麻醉大鼠,心脏采血,离心取上清,置于-20 ℃保存备用。一半血清样品参考TNF-α、IL-6 ELISA试剂盒说明书进行操作,用酶标仪在450 nm波长处检测吸光度值,根据生存曲线计算各种大鼠血清TNF-α、IL-6水平。取剩余血清,用全自动生化分析仪检测TG、TC、HDL-C和LDL-C水平。实验均重复3次,取平均值。
1.2.4 高通量测序技术检测肠道菌群结构:取肛门到回盲肠部分结肠组织,取其内含的新鲜粪便200 mg,加入70%乙醇1 ml,7 500 r/min离心5 min后弃上清,加PBS离心弃上清。将离心管置于吸水纸上,倒置无液体流出,在55 ℃烘箱内放置10 min。用DNA提取试剂盒提取细菌总DNA,按试剂盒说明书进行扩增、纯化。高通量测序上机操作,按照可操作分类单元分类物种,特定导出拟杆菌门、厚壁菌门样品进行比较。实验重复3次,取平均值。
1.2.5 HE染色观察脂肪细胞大小:心脏采血处死大鼠,剖腹分离出肾和睾丸周围脂肪,固定于10%多聚甲醛溶液,经乙醇脱水、透明、浸蜡、包埋等一系列操作后,制作4 μm厚的切片。脱蜡至水,进行HE染色,显微镜下观察组织上脂肪细胞大小变化。
1.2.6 Western blotting检测大鼠结肠中TGR5、NF-κB蛋白表达:取结肠组织清洗干净后,在加入液氮的研钵内剪碎,加RIPA裂解液提取蛋白,BCA检测蛋白浓度,加上样缓冲液,沸水浴变性,进行SDS-PAGE电泳,电转PVDF膜,质量浓度为50 g/L脱脂奶粉封闭2 h。加TGR5、NF-κB、GAPDH一抗(稀释1∶1 000)过夜,次日加二抗(1∶2 000)孵育2 h。ECL曝光显色,计算目标蛋白与内参蛋白灰度值比值。

2 结果
2.1 大鼠增重率和肥胖指数与健康组比较,模型组、低剂量组、高剂量组和阳性对照组大鼠增重率和肥胖指数较高(P<0.05);与模型组比较,低剂量组、高剂量组和阳性对照组大鼠增重率和肥胖指数较低(P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠增重率和肥胖指数较低(P<0.05);与高剂量组比较,阳性对照组大鼠增重率和肥胖指数较低(P<0.05)(见表1)。
2.2 大鼠血清炎症因子水平与健康组比较,模型组、低剂量组、高剂量组及阳性对照组大鼠血清TNF-α、IL-6水平较高(P<0.05);与模型组比较,低剂量组、高剂量组和阳性对照组大鼠血清TNF-α、IL-6水平较低(P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠血清TNF-α、IL-6水平较低(P<0.05);与高剂量组比较,阳性对照组大鼠血清TNF-α、IL-6水平较低(P<0.05)(见表2)。
表1 各组大鼠增重率和肥胖指数Tab 1 Weight gain rate and obesity index of rats in each

表2 各组大鼠血清TNF-α、IL-6水平Tab 2 Serum TNF-α and IL-6 levels of rats in
2.3 大鼠血脂水平各组大鼠血清HDL-C水平组间比较,差异无统计学意义(P>0.05);与健康组比较,模型组、低剂量组、高剂量组和阳性对照组大鼠血清TG、TC和LDL-C水平较高(P<0.05);与模型组比较,低剂量组、高剂量组和阳性对照组大鼠血清TG、TC和LDL-C水平较低(P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠血清TG、TC和LDL-C水平较低(P<0.05);与高剂量组比较,阳性对照组大鼠血清TG、TC和LDL-C水平较低(P<0.05)(见表3)。

表3 各组大鼠血清TG、TC、HDL-C和LDL-C水平Tab 3 Serum TG, TC, HDL-C and LDL-C levels of rats in each group mol/L)
2.4 大鼠肠道菌群中拟杆菌门与厚壁菌门比例与健康组比较,模型组、低剂量组、高剂量组和阳性对照组大鼠肠道中拟杆菌门比例较低,厚壁菌门比例较高(P<0.05);与模型组比较,低剂量组、高剂量组和阳性对照组大鼠拟杆菌门比例较高,厚壁菌门比例较低(P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠拟杆菌门比例较高,厚壁菌门比例较低(P<0.05);与高剂量组比较,阳性对照组大鼠拟杆菌门比例较高,厚壁菌门比例较低(P<0.05)(见表4)。
2.5 大鼠肾与睾丸周围脂肪病理学健康组大鼠脂肪细胞体积较小,偏椭圆形。与健康组比较,模型组大鼠脂肪细胞形态饱满,呈圆形,细胞壁模糊,细胞相交处可见有融合成大细胞团的趋势;与模型组比较,低剂量组、高剂量组和阳性对照组细胞呈多角形,细胞体塌陷,体积较小,细胞壁清晰(见图1)。

表4 各组大鼠肠道菌群中拟杆菌门与厚壁菌门
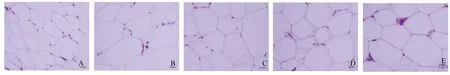
注:A:健康组;B:模型组;C:低剂量组;D:高剂量组;E:阳性对照组。
2.6 大鼠结肠中TGR5、NF-κB蛋白表达与健康组比较,模型组、低剂量组、高剂量组和阳性对照组大鼠结肠中TGR5蛋白相对表达量较低,NF-κB蛋白相对表达量较高(P<0.05);与模型组比较,低剂量组、高剂量组和阳性对照组结肠中TGR5蛋白相对表达量较高,NF-κB蛋白相对表达量较低(P<0.05);与低剂量组比较,高剂量组和阳性对照组结肠中TGR5蛋白相对表达量较高,NF-κB蛋白相对表达量较低(P<0.05);与高剂量组比较,阳性对照组结肠中TGR5蛋白相对表达量较高,NF-κB蛋白相对表达量较低(P<0.05)(见图2、表5)。

注:A:健康组;B:模型组;C:低剂量组;D:高剂量组;E:阳性对照组。
表5 大鼠结肠中TGR5、NF-κB蛋白表达Tab 5 Expressions of TGR5 and NF-κB proteins
3 讨论
随着人们生活水平提高和饮食习惯变化,全球范围内肥胖群体快速壮大,肥胖不但影响人们外形美观和正常生活活动,还与酒瘾、艾滋病、毒药麻痹并列为世界四大医学社会问题,危害人类健康,亟需重视和解决。据Tilg等[12]报道,营养性肥胖患者因机体摄入营养物质不均衡导致肠道微生态环境失调,宿主在能量获取和脂肪堆积上出现变化,削弱肠道屏障功能,激发炎症通路,诱发肠道炎症问题。因此,抗炎是营养性肥胖治疗过程中的必要环节。胆酸不但有抗病毒、抗寄生虫和抗菌能力,还可加大脂肪在胰脂肪酶中的暴露面积,促进脂肪分解和消化,兼顾抗炎和减肥的双重功效。故本研究建立了营养性肥胖大鼠模型,通过补充膳食胆酸方式观察大鼠生理病理变化,为膳食胆酸疗法的研发提供实验依据。
Jia等[13]认为,胆酸可用于治疗脂肪肝,在解决营养性肥胖问题上有一定作用。本实验结果显示,与模型组比较,低、高剂量组大鼠增重率、肥胖指数较低,HE染色显示肾与睾丸周围脂肪细胞较小,共同提示胆酸作为膳食添加剂使用时具备减肥作用,符合Jia等[13]的观点。Desai等[14]提出的胆汁酸学说证实了胃肠道微生态对代谢疾病的调控作用。Zhao等[15]报道肠道菌群紊乱与肥胖有密切关系,推测可能是因肠道菌群紊乱影响肠道功能,其中对肥胖微生物摄取能力较强的肠道菌群占据优势,导致脂肪大量聚集诱发肥胖。肠道菌群紊乱不但影响脂肪存储,还干扰血脂代谢功能,如肠道菌群中多糖消化酶、胆固醇氧化镁等可降解胆固醇,降低血清TG和TC浓度。拟杆菌门与厚壁菌门同为肠道主要菌群之一,二者存在一种互相促进的共生关系,可共同促进宿主吸收或储存能量,故消化道内拟杆菌门与厚壁菌门对发酵多糖十分重要,二者比例也十分重要,拟杆菌门降低或者厚壁菌门增高均有助于促进肥胖。血脂、肠道菌群和肥胖密切相关,高脂饲料可减少大鼠肠道黏蛋白,降低菌群多样性,削弱肠道屏障能力,导致厚壁菌门等致病菌的侵袭风险增加,拟杆菌门等肠道屏障修复菌减少。本研究结果显示,与模型组比较,低、高剂量组大鼠血清TG、TC和LDL-C水平较低,拟杆菌门比例较高、厚壁菌门比例较低,提示膳食胆酸可调节大鼠血脂代谢,增加有益菌比例,减少致病菌比例,调节菌群结构,增强肠道屏障能力。营养性肥胖大鼠因肠道菌群变化,肠道屏障修复菌比例降低,致病菌感染概率升高,诱发慢性炎症反应,表现为肠道炎症。TNF-α为炎症反应中始动细胞因子,IL-6参与炎症急性期反应,二者均为促炎细胞因子,结果显示:低、高剂量组血清TNF-α和IL-6水平均低于模型组,提示膳食胆酸可减轻大鼠肠道炎症。
研究[16]发现,胆酸可作为一种信号分子激活不同信号转导途径,发挥控制肥胖的作用。G蛋白偶联受体是细胞信号转导时的重要调节器,调控机体生长、发育、繁殖等多方面,有报道证明其可通过调控DNA合成影响促有丝分裂信号,从而影响脂肪细胞凋亡[17]。TGR5为一种G蛋白偶联受体,是胆酸受体家族的重要成员之一,可与胆酸结合,引起下游一系列生物学效应,从而调节机体能量平衡、新产代谢等。Chaudhari等[18]表明,TGR5激活参与了减肥过程。Xiao等[19]报道TGR5激活后可抑制NF-κB通路,发挥抗炎作用。NF-κB可被TNF-α、IL-6等刺激因子激活,从而调节多种促炎细胞因子转录,促进炎症反应。结果显示:与模型组比较,低、高剂量组TGR5蛋白相对表达量较高、NF-κB蛋白相对表达量较低,提示胆酸可能通过激活TGR5蛋白、抑制NF-κB通路发挥作用。
综上所述,膳食胆酸对营养性肥胖大鼠有减肥作用,可调节肠道内拟杆菌门与厚壁菌门比例,发挥抗炎作用,可能是通过激活TGR5蛋白、抑制NF-κB通路实现的。
