羟氯扎胺阿苯达唑复方混悬液中抑菌剂的添加剂量筛选及抑菌效力评价
2022-11-17张东辉路宁宁白玉彬张继瑜周绪正
张东辉,路宁宁,白玉彬,董 朕,陈 晨,李 冰,张继瑜,周绪正
(中国农业科学院兰州畜牧与兽药研究所 农村农业部兽用药物创制重点实验室 甘肃省新兽药工程重点实验室,甘肃 兰州 730050)
羟氯扎胺阿苯达唑复方混悬液是由中国农业科学院兰州畜牧与兽药研究所正在研发的新复方驱虫制剂,在临床上将被用于治疗牛羊线虫病、吸虫病和绦虫病,尤其是肝片吸虫病。根据2020版《中华人民共和国兽药典(二部)》抑菌效力检查法(通则1121)规定[1-2]:如果药物本身不具有充分的抗菌效力,则应根据制剂特性(如水溶性制剂)添加适宜的抑菌剂,以防止制剂在正常贮藏或使用过程中由于微生物生长和繁殖而引起污染,尤其是多剂量包装制剂。因此,可加入适当剂量的抑菌剂以防止混悬液被微生物污染。如果抑菌剂剂量不足,可能导致混悬液在多次使用过程中存在微生物污染现象;如果剂量过大,将会引起一定的毒副作用[3]。在混悬液中,抑菌剂的剂量一般应为最低有效剂量,既能达到规定抑菌效果的最低浓度,同时又能尽量减小抑菌剂的毒副作用[4]。为了合理使用抑菌剂,本试验对羟氯扎胺阿苯达唑复方混悬液的抑菌剂添加浓度进行筛选,并对其抑菌效力进行评估。
1 材料与方法
1.1 主要仪器 恒温培养箱(GHP-9270型),上海一恒科学仪器有限公司;生物安全柜(HFsafe-1200LC型),上海力申有限公司;比浊仪,Densichek plus有限公司;电子天平(ME-403),梅特勒-托利多仪器有限公司;高压蒸汽灭菌锅(CT62A型),驰通仪器(上海)有限公司。
1.2 供试品 羟氯扎胺阿苯达唑复方混悬剂(乳白色不透明混浊均一液体,规格为4.0%,每100 mL含羟氯扎胺和阿苯达唑各4.0 g),由中国农业科学院兰州畜牧与兽药研究所研制。
1.3 试验菌种 金黄色葡萄球菌[CMCC(B)26003]、铜绿假单胞菌[CMCC(B)10104]、大肠埃希菌[CMCC(B)44102]、白色念珠菌[CMCC(F)98001]和黑曲霉菌[CMCC(F)98003],均购自中国食品药品检定研究院医学菌种保藏中心,试验中均使用第3代传代菌株。
1.4 主要试剂 沙氏葡萄糖琼脂培养基(批号:1072401)、胰酪大豆胨液体培养基(批号:1073051)、胰酪大豆胨琼脂培养基(批号:1073191)和沙氏葡萄糖液体培养基(批号:1071001),均购自广东环凯微生物科技有限公司,各培养基均经适用性试验,结果应符合2020版《中华人民共和国兽药典(二部)》要求[2];0.9%氯化钠注射液;氯化钠-蛋白胨缓冲液[含中和剂:3.0%聚山梨酯-80(Tween-80)、0.3%卵磷脂和0.1%组氨酸,pH 7.0]。
1.5 方法
1.5.1 菌液制备 分别接种大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌的新鲜培养物至10 mL胰酪大豆胨液体培养基中,30~35 ℃培养24 h;接种白色念珠菌至沙氏葡萄糖液体培养基上,20~25 ℃培养24 h。对上述培养物分别用0.9%氯化钠注射液稀释制成适宜浓度的菌悬液。取黑曲霉菌新鲜培养物至沙氏葡萄糖琼脂斜面培养基上,20~25 ℃培养7 d,加入含0.05% Tween-80的0.9%无菌氯化钠溶液3 mL,将孢子洗脱,过滤菌丝吸出孢子悬液至无菌试管中,然后制成适宜浓度的菌悬液。
1.5.2 未添加抑菌剂供试品的抑菌效力测定 取未添加抑菌剂的羟氯扎胺阿苯达唑复方混悬液供试品1瓶,分别移取10 mL至5支无菌试管中。分别接种1.5.1项中5种适宜浓度的菌悬液各100 μL,使接种后供试品中的菌浓度为105~106CFU/mL,充分摇匀,细菌于30~35 ℃(真菌于20~25 ℃)培养箱中避光培养,分别在第14天和第28天对供试品中存活的微生物进行菌落计数,考察无抑菌剂情况下供试品中试验菌的存活情况,为供试品中是否需要添加抑菌剂提供依据。抑菌效力判定标准如表1所示。
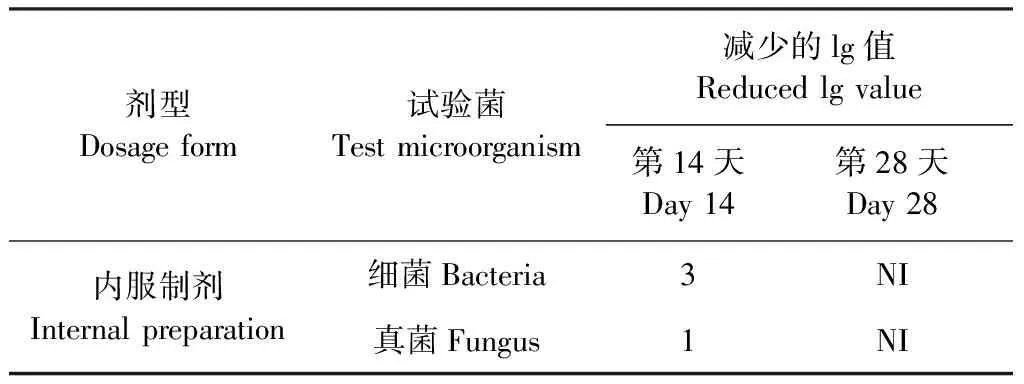
表1 抑菌效力试验结果判定标准
1.5.3 抑菌剂剂量筛选 (1)第1次筛选试验:在试验中分别选取了苯甲酸钠的常用浓度0.01%、0.02%、0.05%、0.10%、0.15%和0.20% 进行试验。分别考察添加以上不同浓度苯甲酸钠的羟氯扎胺阿苯达唑复方混悬液对5种试验菌的抑菌能力,寻找合适的抑菌浓度区间,然后进行正式试验。观察试验菌的生长情况,“+”表示有菌落生长,“-”表示无菌落生长。(2)第2次筛选试验:选择第1次筛选试验结果中对抑菌剂抑制作用最弱的微生物作为试验菌进行第2次筛选试验。分别制备含0.015%、0.020%、0.030%、0.040%和0.050%共5个不同浓度的苯甲酸钠供试品,即a、b、c、d组和e组。分别取上述各组供试品20 mL于无菌离心管中,接种1.5.1项中5种适宜浓度的菌悬液各100 μL,使接种后供试品中的菌浓度为105~106CFU/mL,充分摇匀,于适宜温度的培养箱中避光培养。分别于第14天和第28天进行菌落计数。
1.5.4 菌落计数方法适用性试验 根据第2次筛选试验结果选择最佳供试品中抑菌剂的添加量,进行抑菌效力测定。供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该供试品的微生物计数。(1)试验组:取含有最佳抑菌剂添加量的供试品,用含中和剂的无菌氯化钠-蛋白胨缓冲液(pH 7.0)进行10倍稀释,即作为1∶10的供试液。吸取1∶10的供试液9.9 mL于5支无菌离心管中,分别加入1.5.1项中5种适宜浓度的菌悬液各100 μL,混匀,使每毫升供试液中含菌量不大于100 CFU。(2)供试品对照组:用等量无菌氯化钠-蛋白胨缓冲液(pH 7.0)替代菌液,其余按试验组操作。(3)菌液对照组:用等量无菌氯化钠-蛋白胨缓冲液(pH 7.0)替代试验组中的供试品,其余按试验组操作。(4)中和剂对照组:用等量含中和剂的无菌氯化钠-蛋白胨缓冲液(pH 7.0)替代试验组中的供试品,其余按试验组操作。分别吸取试验组、供试品对照组、菌液对照组和中和剂对照组液体1 mL各2份,置于90 mm无菌培养皿中,细菌注入约20 mL适宜温度的胰酪大豆胨琼脂培养基,摇匀,凝固后置于30~35 ℃培养箱中培养2~3 d;真菌注入约20 mL适宜温度的沙氏葡萄糖琼脂培养基,摇匀,凝固后置于20~25 ℃培养箱中培养3~5 d。
1.5.5 回收率测定 采用平皿法进行菌落计数。适用性试验的回收率计算方法分别为:试验组回收率/%=(试验组菌落数-供试品对照组菌落数)/菌液对照组菌落数×100%;中和剂组回收率/%=(中和剂对照组菌落数-供试品对照组菌落数)/菌液对照组菌落数×100%。当回收率大于70%时,符合要求。
1.5.6 抑菌效力测定 (1)供试品制备:取3瓶不同批次含最佳抑菌剂浓度的包装完整的羟氯扎胺阿苯达唑复方混悬液供试品,分别吸取9.9 mL至无菌离心管中,每批次准备5个以检测5种试验菌。(2)供试品接种:取上述每批次5个无菌离心管,分别接种1.5.1项中5种适宜浓度的菌悬液各100 μL,使接种后供试品中的菌浓度为105~106CFU/mL,振荡摇匀,然后将接种后的供试品放置于适宜温度的培养箱中避光培养。(3)存活菌落数测定:分别于接种后的第0、14天和第28天测定供试品中所含菌落数。精密量取接种后的供试品1 mL,用含中和剂的无菌氯化钠-蛋白胨缓冲液(pH 7.0)依次进行10倍稀释至适当的稀释级,按照1.5.4项中适用性试验的方法进行菌落计数。
2 结果
2.1 未添加抑菌剂供试品的抑菌效力测定 结果如表2所示,不添加抑菌剂的羟氯扎胺阿苯达唑复方混悬液对5种试验菌几乎均无抑菌效果,可能是由于在混悬液制备过程中选用Tween-80作为药物的润湿剂,而具有抑菌效力的原料药被包被在其中,从而失去了抑菌能力。试验结果表明:未添加抑菌剂的羟氯扎胺阿苯达唑复方混悬液供试品菌落数lg值的减少均不符合规定,因此,需要在混悬液中添加抑菌剂来确保用药安全。
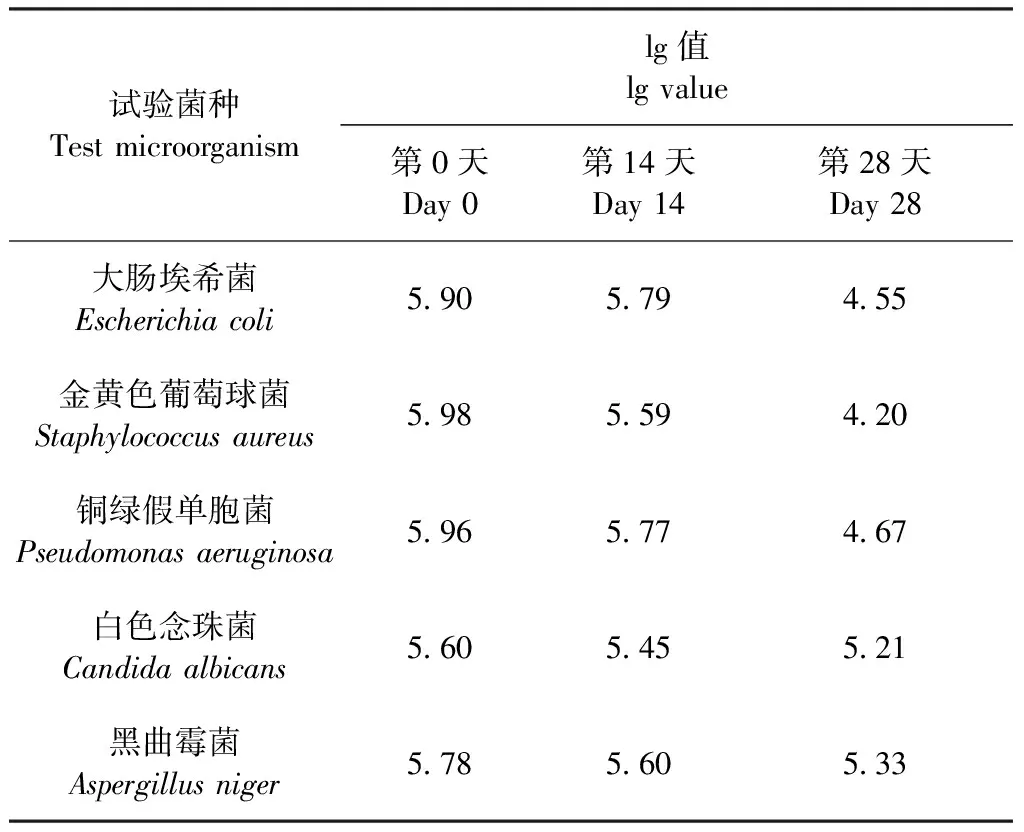
表2 未添加抑菌剂供试品第0、14天和第28天试验菌对数值
2.2 抑菌剂剂量筛选
2.2.1 第1次筛选试验 结果如表3所示,当抑菌剂苯甲酸钠的浓度大于0.05%时,5种试验菌均不生长;而当苯甲酸钠的浓度小于0.02%时,表现出对部分或全部试验菌有抑制作用。因此需要进一步筛选抑菌剂浓度,设计浓度为0.015%、0.020%、0.030%、0.040%和0.050%。

表3 第1次筛选试验结果
2.2.2 第2次筛选试验 选择第1次筛选试验中对抑菌剂抑制作用最弱的黑曲霉菌和白色念珠菌作为第2次筛选试验的试验菌。结果如表4所示,在5个不同浓度的试验组中,a组(含0.015%苯甲酸钠)虽然有抑菌作用,但是对黑曲霉菌的抑菌效果未达到抑菌效力判定标准;b、c、d组和e组(即苯甲酸钠浓度在0.020%以上时)在第14天时对白色念珠菌和黑曲霉菌的菌落数lg值下降均大于1.0,且第28天时菌落数未增加,表现出有效的抑菌作用。即苯甲酸钠浓度在0.020%以上时可有效抑制试验菌的生长繁殖。由于抑菌剂存在一定的毒副作用,为了保证用药安全,综合以上因素考虑,最终选用b组(含0.020%苯甲酸钠)作为供试品中抑菌剂的添加量。
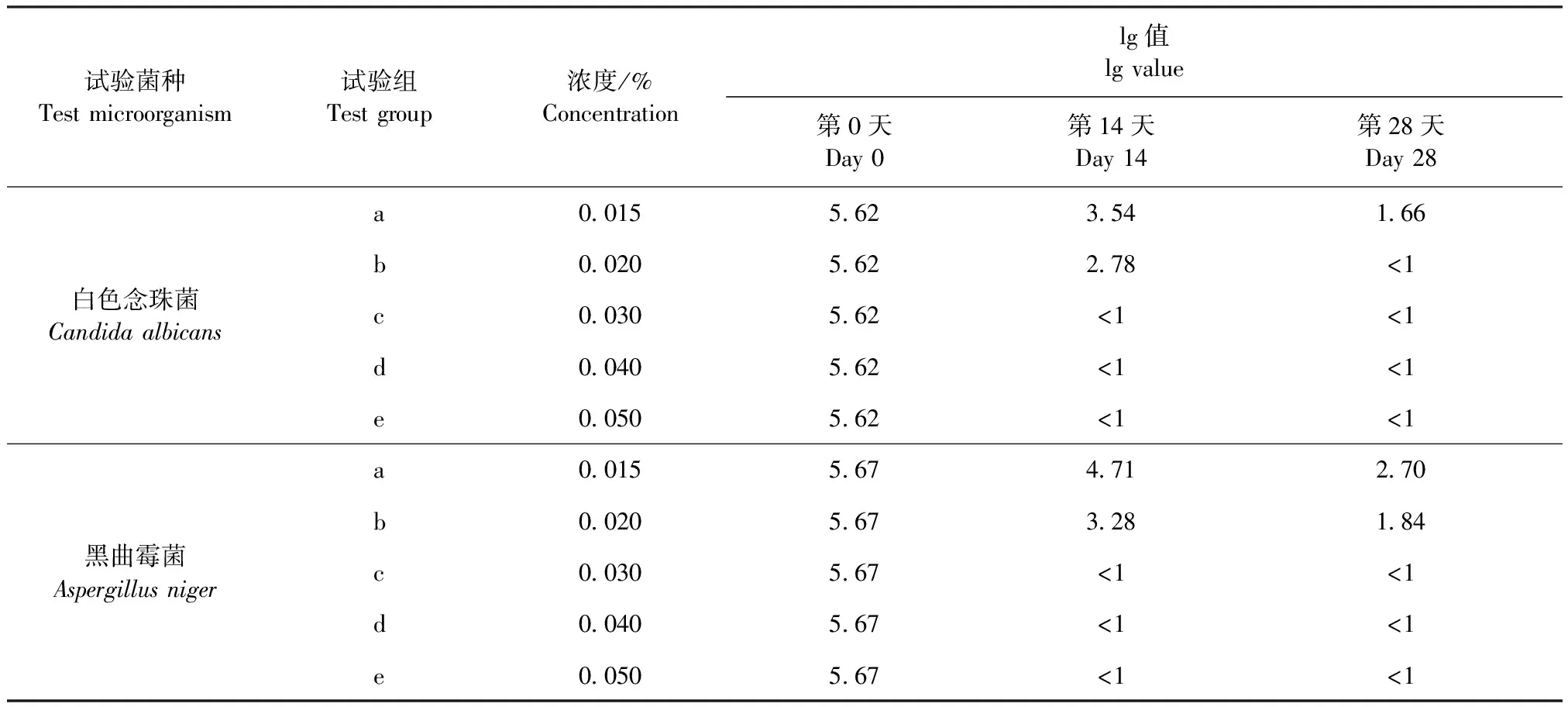
表4 第2次筛选试验结果
2.3 菌落计数方法适用性试验 结果如表5所示,5种试验菌的回收率均大于70%。表明该方法可以用于供试品的抑菌效力测定试验。
表5 菌落计数方法适用性试验结果
2.4 抑菌效力测定 结果如表6所示,细菌在第14天时不再生长;真菌在第14天时菌落数下降大于1.0个lg值且不再增加,故抑菌剂浓度为0.020%的供试品抑菌效力试验结果符合判定标准。
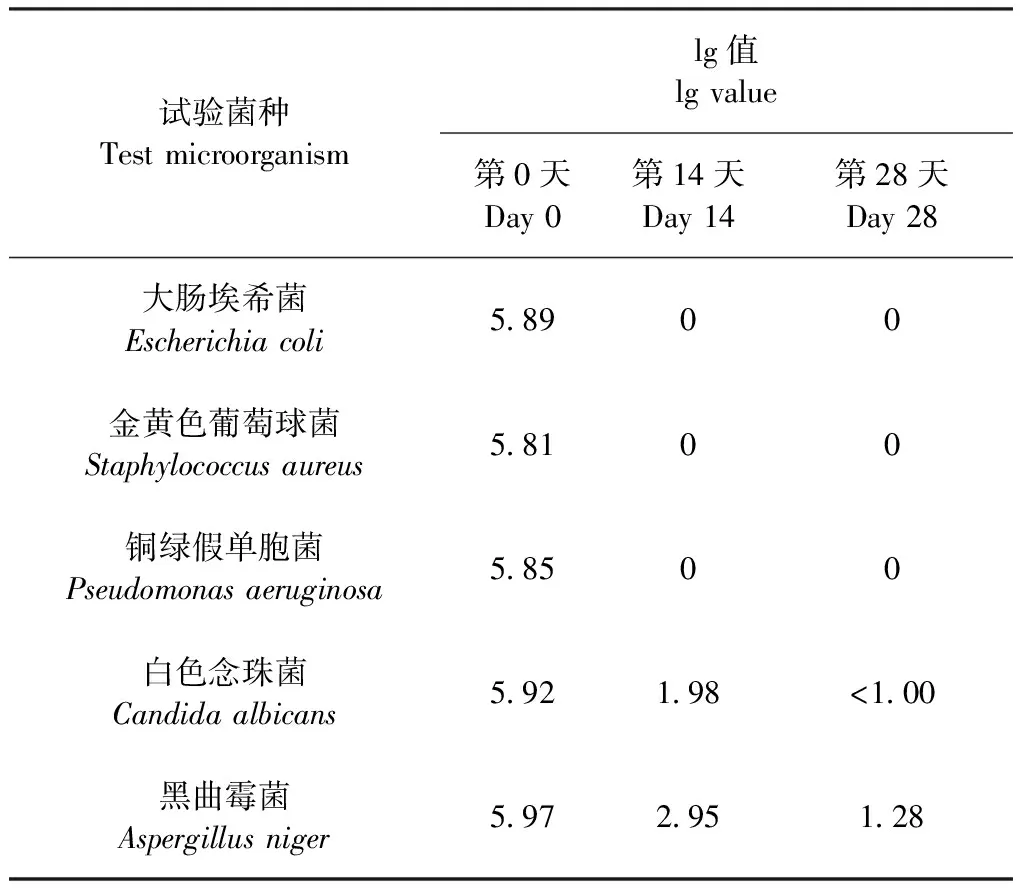
表6 抑菌效力测定结果
3 讨论
3.1 抑菌剂剂量筛选 口服混悬液是最常见的非处方兽药制剂之一,为了避免在使用过程中发生二次污染,需要在其处方中加入适宜浓度的抑菌剂,同时抑菌剂的添加量应当在确保制剂有足够抑菌能力的前提下添加越少越好[5-6],且抑菌剂种类应对主药含量无影响。国内的口服制剂在研发过程中,对抑菌剂的合理使用和质量控制没有引起重视,许多制剂中存在抑菌剂添加过量的情况,其抑菌剂添加剂量是否合理值得深思[7-8]。因此,本试验通过对抑菌剂苯甲酸钠的浓度进行筛选,寻找最低有效抑菌浓度,同时还能保证药物安全稳定。在第1次剂量筛选过程中,低浓度的苯甲酸钠对细菌有强烈的抑制作用,对真菌的抑菌较差,因此在第2次抑菌剂剂量筛选过程中主要以白色念珠菌和黑曲霉菌为考察对象。本试验在浓度筛选过程中,依据“最低且有效”的原则,最终选择的浓度合适的抑菌剂是0.020%的苯甲酸钠。
3.2 计数方法适用性 计数方法适用性是进行抑菌效力试验的重要一步,只有方法合适才能准确地反映样品中微生物的存活情况,保障试验的准确性,选出“低量有效”的抑菌剂浓度[9]。本试验采用稀释法联用中和法(3% Tween-80、0.3%卵磷脂和0.1%组氨酸)进行菌落计数方法学适用性试验[10-12],消除混悬液中药物对微生物的抑菌性,以便达到各试验菌株回收率均大于70%的要求。
3.3 抑菌效力测定 在处方设计中,对抑菌剂浓度的筛选可能产生试验偏差,同时还应考虑到在实际生产过程中可能存在的投料偏差[13],为了保证抑菌作用的有效性,在试验过程中分别取3瓶不同批次的混悬液进行抑菌效力测定。结果表明,供试品中添加0.020%的苯甲酸钠可以满足该混悬液在贮藏和使用的无菌要求。
