高频超声、实时剪切波弹性成像、彩色多普勒血流显像联合检查对BI-RADS 4 类乳腺肿块良恶性的诊断价值
2022-11-17刘海华程扬眉解红娟胡金花
刘海华 夏 群 程扬眉 解红娟 胡金花
安徽省安庆市第一人民医院超声科,安徽安庆 246000
BI-RADS 是根据乳腺肿块的形态学特征进行分类,是评价乳腺肿块性质的常用手段[1]。一般情况下,BI-RADS 4 类的乳腺肿块属于可疑恶性,但此类肿块无典型恶性征象,仅凭常规影像学手段和BI-RADS 分类难以明确其病变性质[2]。
剪切波弹性成像(shear wave elastic imaging,SWE)通过剪切波在组织中传播成像和波速的不同对病灶组织的弹性值进行测定,能够较好地对病灶的软硬程度进行评价[3]。而彩色多普勒血流显像(color Doppler flow imaging,CDFI)能够清晰显示肿块内部的血流情况[4]。本研究采用高频超声、SWE 及CDFI 对BI-RADS 4类乳腺肿块的良恶性进行联合诊断,旨在进一步提升乳腺肿块的诊断准确率。
1 资料与方法
1.1 一般资料
选择2020 年9 月至2021 年9 月安徽省安庆市第一人民医院(以下简称“我院”)收治的80 例乳腺肿块患者为研究对象,根据手术后病理学结果或穿刺活检结果分为良性组(53 例)和恶性组(27 例)。良性组年龄16~68 岁,平均(51.72±12.65)岁;乳腺肿块63 个,直径0.61~5.03 cm,平均(1.89±0.35)cm。恶性组年龄38~80 岁,平均(54.30±11.29)岁;乳腺肿块34 个,直径0.59~5.22 cm,平均(1.94±0.41)cm。两组一般资料比较,差异无统计学意义(P >0.05),具有可比性。本研究经我院伦理委员会审核批准(AQYY--YXLL--20--03)
纳入标准:①BI-RADS 4 类;②手术病理学结果或活检穿刺结果明确其肿块性质;③肿块为首次发现,入院前无放疗、化疗等治疗史。排除标准:①合并其他类型恶性肿瘤;②合并心脏、肝肾等其他严重器质性病变;③合并急性感染性疾病;④合并血液系统疾病。
1.2 检查方法
所有患者在穿刺检查或术前1 周内完成检查。采用GE LOGIQ E8 彩色多普勒超声诊断仪进行SWE检查,设置9L 探头,频率为2.5~10 MHz。患者取仰卧位,双手举起充分暴露乳腺位置。首先采用二维超声进行对双侧乳腺的各个象限进行扫查,通过横向、纵向、斜向多方位对肿块位置、大小、形态、边界、钙化、回声情况等形态学特征进行观察和记录。之后调至CDFI 模式对肿块内部和周边的血流情况进行观察,彩色增益设定为50 dB,采用Adler 血流定量分级法对乳腺肿块进行分级,0 级:肿块内无血流;Ⅰ级:肿块内有少量血流,可见1~2 处微小血流信号;Ⅱ级:肿块内可见长度接近或超过肿块半径的血管;Ⅲ级:肿块内血流丰富,存在多条血管或交叉形成网络。
准备SWE 检查时,将探头置于肿块中心位置,不施加压力,选取最大横切面,图像清晰后切换至SWE模式,将取样框移至肿块位置,尽可能包括周围乳腺组织,叮嘱患者屏住呼吸后等待3 s,图像稳定后冻结图像,选择合适的图像进行测量保存。采用自带的软件测量肿块的弹性模量值最大值(Emax)、弹性模量值平均值(Emean)、弹性模量值方差值(Esd)及乳腺肿块与同层低脂肪弹性平均值的比值(Eratio)。每个切面均测量3 次取平均值。
1.3 统计学方法
采用SPSS 19.0 统计学软件进行数据分析。计量资料用均数±标准差()表示,组间比较采用t 检验;计数资料用肿块数和百分率表示;等级资料采用秩和检验;绘制不同诊断方式的受试者操作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC)。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组SWE 参数比较
恶性组Emax、Emean、Eratio 和Esd 高于良性组,差异有统计学意义(P <0.05)。见表1。
表1 两组SWE 参数比较(kPa,)
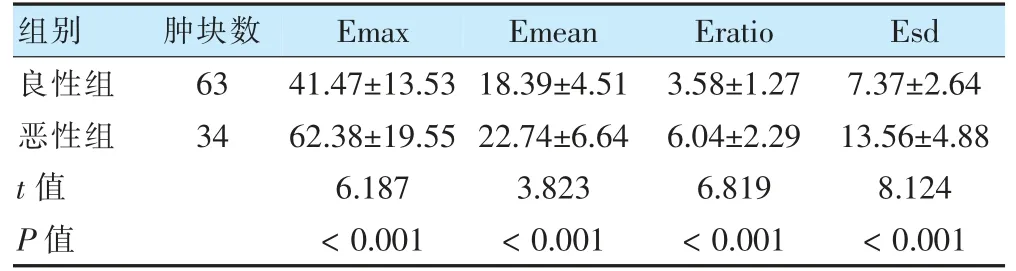
表1 两组SWE 参数比较(kPa,)
注 SWE:剪切波弹性成像;Emax:弹性模量值最大值;Emean:弹性模量值平均值;Esd:弹性模量值方差值;Eratio:乳腺肿块与同层低脂肪弹性平均值的比值
2.2 两组CDFI 血流分级比较
两组CDFI 血流分级比较,差异有统计学意义(P<0.05)。见表2。
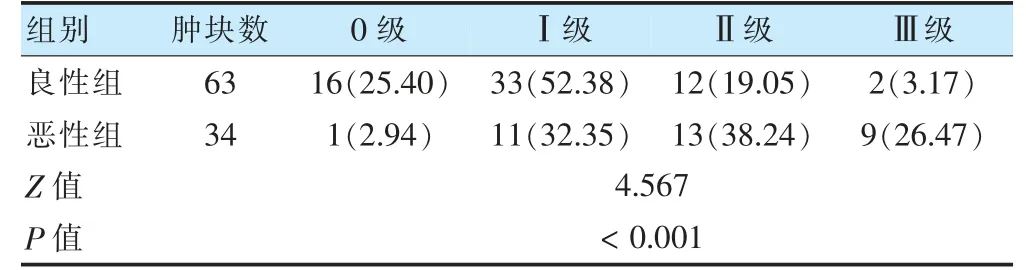
表2 两组CDFI 血流分级比较[肿块数(%)]
2.3 高频超声、SWE 和CDFI 单项及联合检查对恶性乳腺肿块的诊断价值
联合检查的AUC、敏感度、特异度高于各项单独检测。见表3、图1。
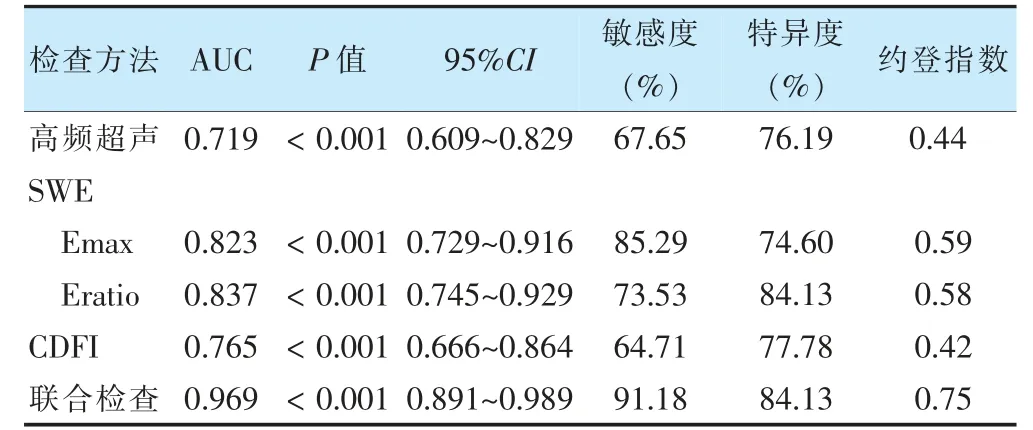
表3 高频超声、SWE 和CDFI 单项及联合检查对恶性乳腺肿块的诊断价值
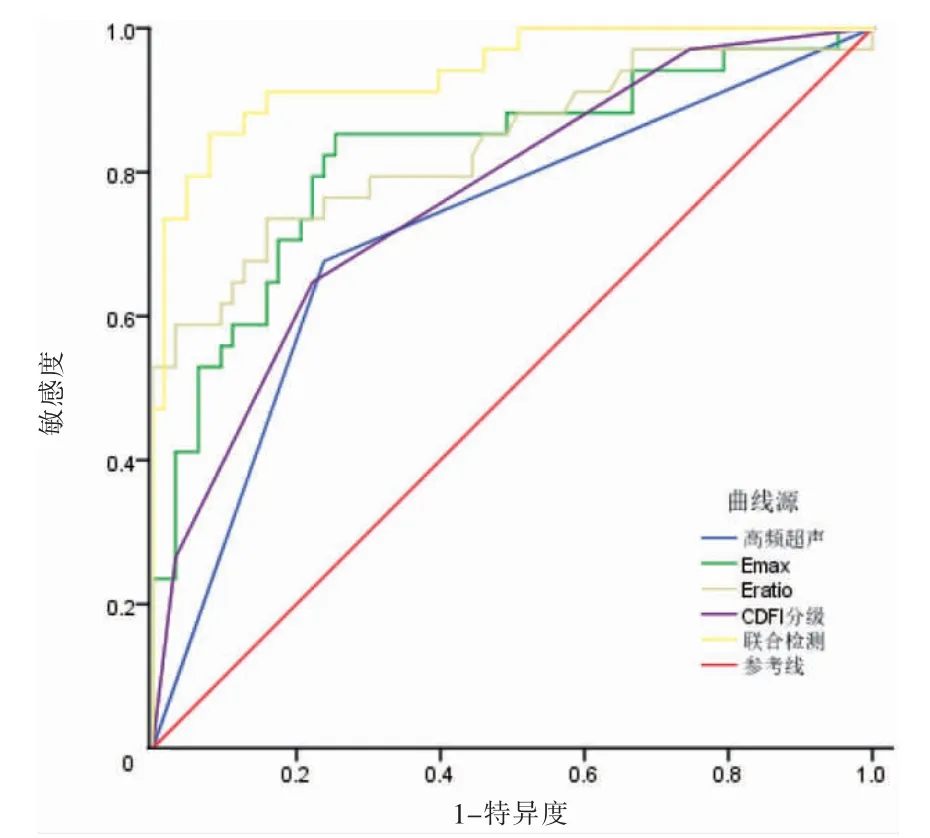
图1 受试者操作特征曲线
3 讨论
高频超声能够较为清晰地显示乳腺肿块的位置、大小、形态、边界、钙化、回声情况等形态学信息[5]。BIRADS 分类根据乳腺肿块的各种形态学信息对其进行分类,能够对乳腺肿块的良恶性作出初步评价和诊断[6~7]。BI-RADS 4 类乳腺肿块的恶性率跨度较大,而此类乳腺肿块在常规超声表现上又存在重叠性。因此,临床上寻求一种准确鉴别诊断BI-RADS 4 类乳腺肿块的检查方式比较迫切[8-11]。
CDFI 能够对乳腺肿块内部的血流情况进行定性、定量评价,能够清晰反映肿块内部的血液供应情况,血流信号越强代表肿块内部的血液灌注水平越高[12-15]。本研究发现,恶性肿块的血流信号明显增多,良性肿块则多为无血流信号或有少量血流信号,CDFI在诊断恶性乳腺肿块的AUC 为0.765,提示CDFI 在诊断乳腺肿块上具有一定的临床价值。然而,良恶性乳腺肿块的血流信号存在交叉或重叠现象,且CDFI无法对病灶硬度进行评价,因此在乳腺肿块的定性诊断中具有一定局限性[16-19]。
SWE 是利用超声换能器发射多种声波激励乳腺肿块和周围组织,使其内部产生以横波形式传播的剪切波[20],之后利用相关算法获得弹性值[21-23]。SWE 在鉴别诊断乳腺肿块上能够发挥重要作用。本研究结果显示,恶性乳腺肿块的Emax、Emean、Eratio 和Esd 值明显高于良性肿块。据报道,SWE 在诊断乳腺肿块的诊断效率高于常规超声,敏感度一般在70%~95%,特异度略高,一般在80%左右[24]。本研究结果显示,Emax、Eratio 在诊断恶性乳腺肿块的敏感度、特异度分别为85.29%、74.60%和73.53%、84.13%,除Emax的特异度略低以外,其余结果与相关报道基本一致。
高频超声和BI-RADS 分类主要依靠肿块的形态学表现对乳腺肿块的性质进行判断和评估,SWE、CDFI 能够从剪切波传播速度、血流分布对乳腺肿块的性质进行评估[25-26]。本研究从SWE 参数中选择最具代表性的Emax、Eratio,同时结合高频超声和CDFI 进行综合性评价,结果显示,联合检查在诊断恶性乳腺肿块的AUC 为0.969,敏感度、特异度分别为91.18%、84.13%,高于单独检测。
综上所述,高频超声、SWE、CDFI 能够从多个角度为乳腺肿块的鉴别诊断提供参考,三者联合能够比较准确地对BI-RADS 4 类乳腺肿块进行鉴别诊断,与病理学结果具有较好的一致性,具有较高的临床应用价值。
