IGF1 基因慢病毒转染骨髓间充质干细胞治疗骨性关节炎的实验研究
2022-11-17向文远邓迎杰
向文远 邓迎杰 廖 军 方 锐
1.新疆医科大学第四临床医学院,新疆乌鲁木齐 830000;2.新疆医科大学附属中医医院骨科,新疆乌鲁木齐 830000
骨性关节炎(osteoarthritis,OA)是老年人致残的主要原因[1-2]。因此寻找OA 的有效治疗手段是骨科学领域研究的重点内容。以往已有研究[3-4]证实髓间充质干细胞(bone marrow mesenchyml stem cells,BMSCs)能通过多途径对骨组织损伤起到修复作用[5],但是其成骨能力较弱,而IGF1 基因是一种能诱导BMSCs 向成软骨细胞和成骨细胞分化、成熟的关键转录因子,在骨修复与重建中发挥重要作用[6]。本研究将通过构建IGF1 基因慢病毒载体,并将其转染BMSCs 后对大鼠OA 模型进行治疗,以期为OA 的临床治疗奠定实验基础。
1 材料与方法
1.1 实验动物
SPF 级Wistar 大鼠40 只,10~12 周龄,体重280~320 g,雄性,购自新疆医科大学实验动物中心,生产许可证号:SCXK(新)2018-0002,使用许可证号:SYXK(新)2018-0003,饲养条件:恒温20~25℃、恒湿(50±5)%。实验经新疆医科大学附属中医医院伦理委员会批准(2019102283)。
1.2 主要试剂及仪器
Lenti-IGF 1-EGFP 慢病毒(上海吉凯基因化学技术有限公司,批号:H40582);Ⅰ型胶原C 端肽(C-terminal peptide of type Ⅰcollagen,CTX-Ⅰ)试剂盒(elabscience,批号:E-EL-R1456c);CTX-Ⅱ试剂盒(elab science,批号:E-EL-R2554c);白介素(interleukin,IL)-1α 试剂盒(elabscience,批号:E-EL-R0011c);IL-6 试剂盒(elabscience,批号:E-EL-R0015c);Trizol(Aidlab,批 号:Lot:252250AX);HiScript Reverse Transcriptase(RNase H)(VAZYME,批号:R101-01/02);SYBR Green Master Mix(RNase H)(VAZYME,批号:Q111-02);SYBR Green Master Mix(RNase H)(VAZYME,批号:ET105-01);兔多抗GAPDH(杭州贤至生物有限公司,批号:AB-P-R 001);鼠单抗糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)(Abcam,批号:ab93926);兔单抗β-catenin(Abcam,批 号:ab32572);兔多抗Wnt1(Abcam,批号:ab85060)。高速离心机(上海卢湘仪离心机仪器有限公司,型号:LB-516);电热恒温培养箱(上海培因实验仪器有限公司,型号:TM-442);全自动多功能酶标仪(上海百千生物科技有限公司,型号:MSL602);实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪(ABI,型号:QuantStudio 6);水平电泳仪(北京君意东方电泳设备有限公司,型号:JY300);酶标仪(Thermo,型号:mμlISKANMK3);电热恒温鼓风干燥箱(上海精宏实验设备有限公司,型号:DHG 9203A)。
1.3 BMSCs 的分离
10 只Wistar 大鼠处死,取出双侧股骨,用10 ml注射器吸出干骺端红骨髓,加入含20 μg/ml 肝素的IMDM 培养液中。充分重悬后置入离心管,1 500 r/min条件下离心10 min(离心半径10 cm),将脂肪及上清液弃去。加DMEM 培养液混匀稀释至10 ml,重悬后过90 目滤网,接种。获得8×105/ml 密度的细胞悬液,于5%CO2与37℃培养箱中进行培养。
1.4 BMSCs 的培养及鉴定
将第3 代BMSCs(1×105个/cm2)接种于盖玻片上,待贴壁细胞密度70%时取出盖玻片。一抗兔抗鼠CD44 单克隆抗体(1∶25)4℃湿盒孵育过夜,使用PBS进行3 次漂洗。二抗山羊抗兔IgG(1∶50)室温避光孵育2 h,使用PBS 进行3 次漂洗。避光条件下加DAB显色剂20 min,苏木精染色10 min,水洗,95%甘油封片,倒置显微镜下观察实验结果并拍照记录。第三代的BMSCs(1×106个)4 份分别与FITC 标记的CD29、CD34、CD45、CD105,37℃孵育30 min,使用PBS 进行2 次漂洗,上机检测。
1.5 IGF1 基因慢病毒转染BMSCs
取第3 代BMSCs 接种于6 孔板,待细胞密度长至60%时,用感染复数为50 的Lenti-IGF 1-EGFP 慢病毒转染细胞,转染48 h 后,在荧光显微镜下观察细胞绿色荧光蛋白的表达情况,先在白光视野下计数细胞总数,再在荧光视野下计数表达荧光的细胞数目,转染效率=(荧光表达细胞数目/白光视野细胞总数)×100%,取10 个视野,计算平均值。取转染后的BMSCs接种于6 孔板,加入不同质量浓度(0、1、2、3、4、5 mg/ml)嘌呤霉素,选择在10~14 d 内让全部细胞死亡的最低浓度作为最佳筛选浓度。另取转染后的BMSCs 接种于6 孔板,孵育24 h 后加入最佳筛选浓度的嘌呤霉素,每隔2 d 更换新的含最佳筛选浓度嘌呤霉素的培养液,连续培养10 d。收集抗性细胞,获得稳定转染细胞株。
1.6 OA 大鼠模型制备及分组
取30 只Wistar 大鼠,采用膝关节前交叉韧带切断法建立OA 模型:麻醉后,剃净手术区域,从内侧切开膝关节腔,外翻膑骨,将前交叉韧带进行剪断。造模成功标准:对关节软骨组织进行病理学检查,软骨表面粗糙变薄,部分细胞核固缩、坏死,细胞排列紊乱表示造模成功[7]。建模成功2 周后按照随机数字表法分为BMSCs+IGF1 组、BMSCs 组、模型组,每组10 只。BMSCs+IGF1 组大鼠膝关节腔内注射0.1 ml IGF1 基因慢病毒转染BMSCs(1×107个),BMSCs 组大鼠膝关节腔内注射0.1 ml BMSCs(1×107个);模型组大鼠膝关节腔内注射0.1 ml 生理盐水。
1.7 HE 染色观察大鼠膝关节软骨组织病理学变化
分离膝关节软骨组织,经10%多聚甲醛固定,将固定的软骨组织,经脱钙、水合、透明、石蜡包埋后切片,切片厚度5 μm,采用HE 染色,梯度酒精脱水,中性树胶封固,镜检观察膝关节软骨组织病理学变化。
1.8 ELISA 检测大鼠血清CTX-Ⅰ、CTX-Ⅱ、IL-1α、IL-6 水平
取三组大鼠血液2 ml,2 000 r/min 条件下离心10 min(离心半径10 cm)获取血清。分别设空白孔、标准孔、待测样品孔。空白孔加标准品&样品稀释液100 μl,余孔分别加标准品或待测样品100 μl。给酶标板覆膜,37℃孵育90 min。弃去孔内液体,甩干,不用洗板,每孔中加入生物素化抗体工作液100 μl,给酶标板加上覆膜,37℃温育1 h。弃去液体,洗板3 次,每次浸泡30 s,大约350 μl/每孔,甩干并在吸水纸上轻拍将孔内液体拍干。每孔加酶结合物工作液100 μl,加上覆膜,37℃温育30 min。弃去孔内液体,甩干,洗板5 次。每孔加显色剂90 μl,酶标板加上覆膜37℃避光孵育15 min。每孔加终止液50 μl,终止反应,此时蓝色立转黄色。立即用酶标仪在450 nm 波长测量各孔光密度。
1.9 实时荧光定量PCR 大鼠膝关节软骨组织中骨钙素(osteocalcin,OC)、GSK-3β、碱性磷酸酶(alkaline phosphatase,ALP)、Runt 相关转录因子2(Runt-associated transcription factor 2,Runx2)的mRNA 表达水平
取三组大鼠膝关节软骨组织100 mg,加入1 ml Trizol 试剂,用匀浆器研磨成浆,移至无RNase 的1.5 ml EP 管中,裂解10 min。加入200 μl 氯仿,剧烈颠倒混匀数次,室温放置5 min。4℃,12 000 r/min,离心15 min(离心半径10 cm),可见分成上(RNA)中(蛋白)下(DNA)三相。转移上层水相(约400 μl)于另一新1.5 ml EP 管中,加入400 μl 异丙醇,混匀后室温静置10 min。4℃,12 000 r/min,离心10 min(离心半径10 cm),管底可见白色的RNA 沉淀。取RNA 进行逆转录成cDNA,反应条件:25℃5 min,50℃15 min,85℃5 min,4℃10 min;cDNA 做N 倍稀释,反应条件:50°C 2 min,95°C 10 min;95°C 30 s,60°C 30 s,循环40 次,以GAPDH 为内参,绘制溶解曲线,最终数据以2-△△Ct进行分析。引物序列见表1。
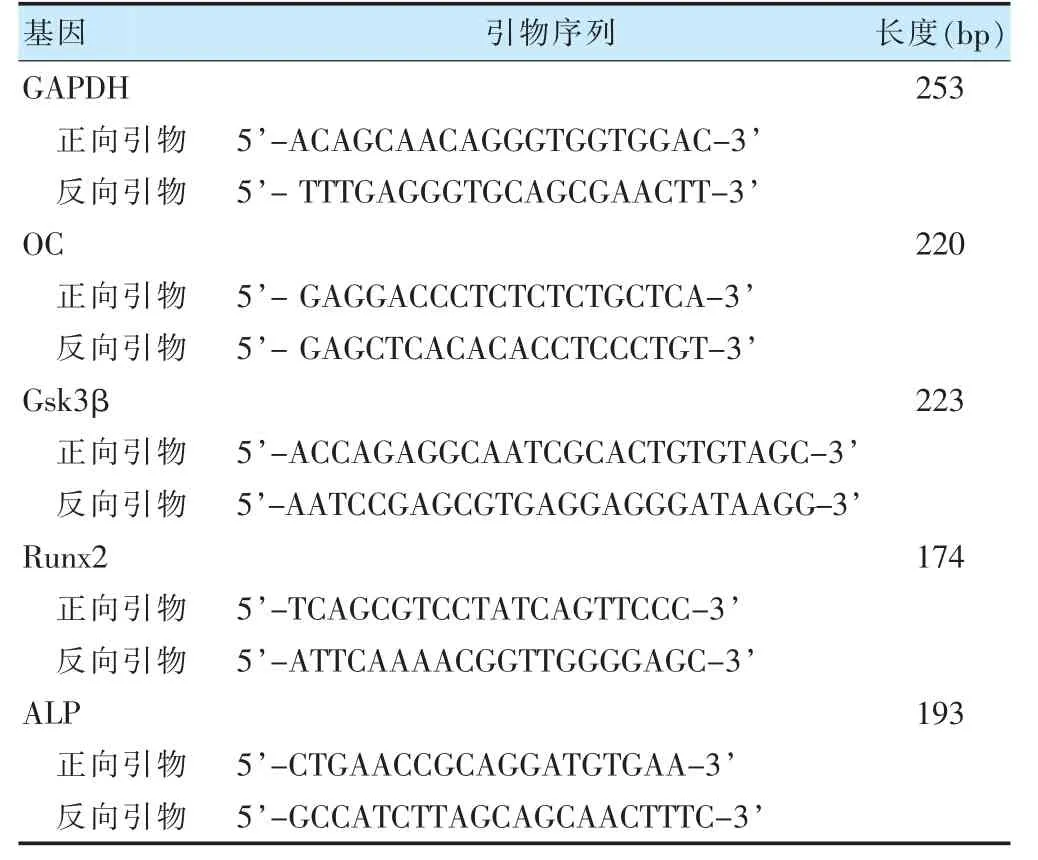
表1 引物序列
1.10 Western blot 检测测大鼠膝关节软骨组织中βcatenin、Wnt1、GSK-3β 的蛋白表达水平
取三组大鼠膝关节软骨组织100 mg,置于2 ml EP 管中,每管加200 μl 单去污剂裂解液裂解(含2 μl PMSF、2 μl 磷酸酶抑制剂),置于自动匀浆机中匀浆,匀浆完成后将EP 管置于冰上30 min 充分裂解。裂解30 min 后,即可用移液器将裂解液移至1.5 ml 离心管中,然后在4℃下12 000 r/min 离心5 min(离心半径10 cm),取上清为总蛋白,二喹啉甲酸法测定蛋白浓度。等量总蛋白上样,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,转至聚偏氟乙烯膜。TBST 漂洗,5%脱脂奶粉室温封闭1 h,加入兔抗鼠一抗工作液(1∶100 0),4℃孵育过夜。TBST 漂洗,加入辣根过氧化物酶标记的山羊抗兔二抗工作液(1∶100 0),37℃孵育1 h。TBST漂洗,暗室内二氨基联苯胺显色、曝光。Bio-Rad 分析系统扫描分析,目的蛋白表达量=目的蛋白吸光度值/GAPDH 吸光度值。
1.11 统计学方法
采用SPSS 22.0 软件对所得数据进行统计学分析。计量资料采用均数±标准差()表示,比较采用t检验;计数资料采用例数表示,比较采用χ2检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 BMSCs 的鉴定
细胞形态观察显示细胞排列紧密,逐渐融合成片,且细胞形态均一,呈梭形生长,生长旺盛。流式细胞仪检测结果显示,培养后的BMSCs 均表达CD29、CD34、CD45、CD105。见图1。
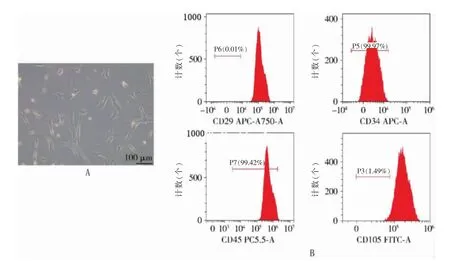
图1 BMSCs 的鉴定
2.2 IGF1 基因慢病毒转染BMSCs 的效果
转染48 h 后,IGF1 基因慢病毒对BMSCs 的转染效率为(90.36±2.18)%,并经最佳浓度(10 mg/ml)的嘌呤霉素筛选得到了稳定转染细胞株。见图2。
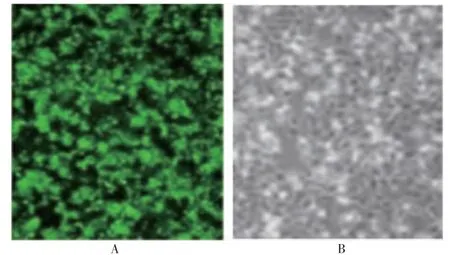
图2 IGF1 基因慢病毒转染BMSCs 的效果(200×,标尺长100 μm)
2.3 三组大鼠膝关节软骨组织病理学情况
模型组关节软骨面不平整,表层变薄,部分细胞核固缩、坏死,细胞排列紊乱。BMSCs 组小鼠膝关软骨退变程度较模型组轻微,尚未发现缺损迹象,关节面较平整。BMSCs+IGF1 组软骨完整,未见明显退化,关节面平整。见图3。
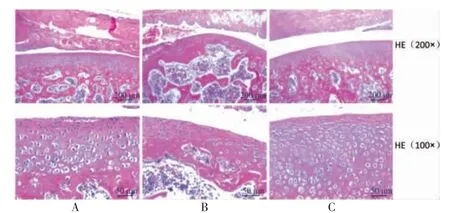
图3 三组大鼠膝关节软骨组织病理学情况
2.4 三组大鼠血清CTX-Ⅰ、CTX-Ⅱ、IL-1α、IL-6 水平比较
BMSCs 组血清CTX-Ⅰ、CTX-Ⅱ、IL-1α、IL-6 水平均明显低于模型组(P <0.05),BMSCs+IGF1 组明显低于BMSCs 组(P <0.05)。见表2。
表2 三组大鼠血清CTX-Ⅰ、CTX-Ⅱ、IL-1α、IL-6 水平的比较()
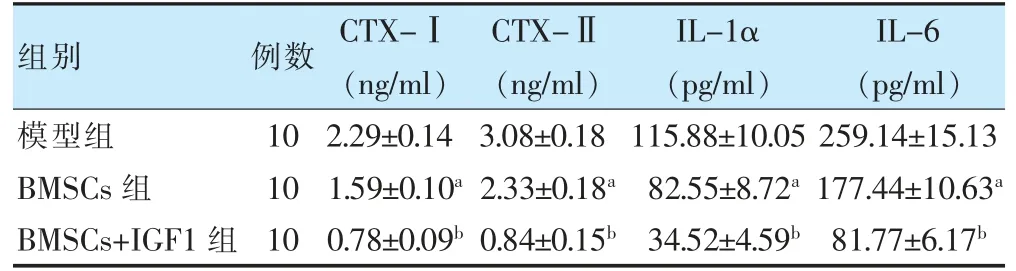
表2 三组大鼠血清CTX-Ⅰ、CTX-Ⅱ、IL-1α、IL-6 水平的比较()
注 与模型组比较,aP <0.05;与BMSCs 组比较,bP <0.05。BMSCs:骨髓间充质干细胞;CTX-Ⅰ:Ⅰ型胶原C 端肽;IL:白介素
2.5 三组OC、GSK-3β、ALP、Runx2mRNA 表达水平比较
BMSCs 组OC、GSK-3β、ALP、Runx2 mRNA 表达水平均明显低于模型组(P <0.05),BMSCs+IGF1 组明显低于BMSCs 组(P <0.05)。见表3。
表3 三组大鼠OC、GSK-3β、ALP、Runx2 mRNA表达水平的比较()
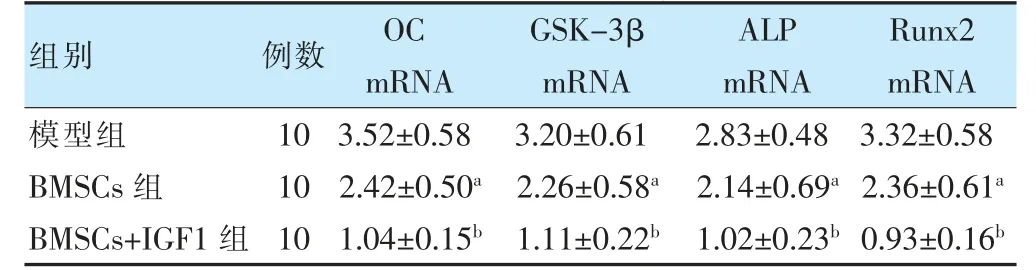
表3 三组大鼠OC、GSK-3β、ALP、Runx2 mRNA表达水平的比较()
注 与模型组比较,aP <0.05;与BMSCs 组比较,bP <0.05。BMSCs:骨髓间充质干细胞;OC:骨钙素;GSK-3β:糖原合成酶激酶-3β;ALP:碱性磷酸酶;Runx2:Runt 相关转录因子2
2.6 三组β-catenin、Wnt1、GSK-3β 蛋白表达水平的比较
BMSCs 组β-catenin、Wnt1、GSK-3β 蛋白表达水平均明显低于模型组(P <0.05),BMSCs+IGF1 组明显低于BMSCs 组(P <0.05)。见表4、图5。
表4 三组大鼠β-catenin、Wnt1、GSK-3β 蛋白表达水平的比较()
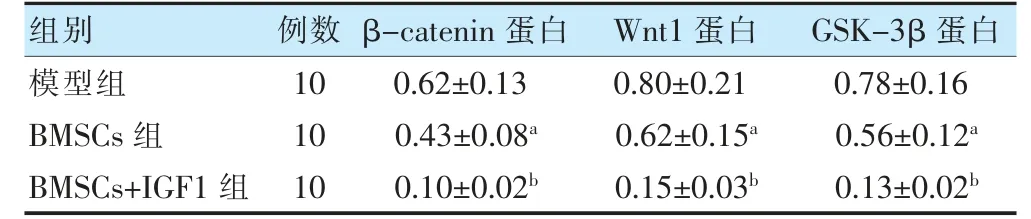
表4 三组大鼠β-catenin、Wnt1、GSK-3β 蛋白表达水平的比较()
注 与模型组比较,aP <0.05;与BMSCs 组比较,bP <0.05。BMSCs:骨髓间充质干细胞;GSK-3β:糖原合成酶激酶-3β
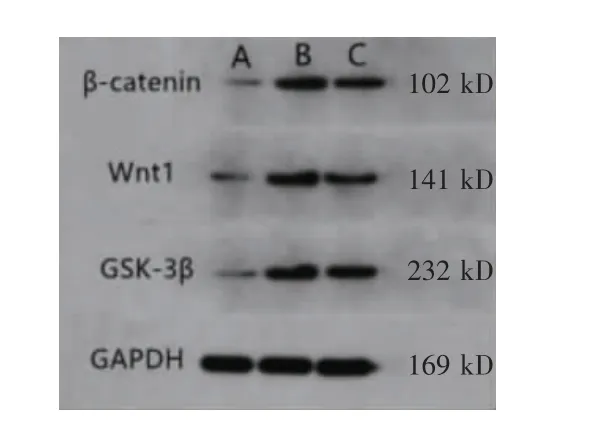
图5 三组β-catenin、Wnt1、GSK-3β 蛋白的条带图
3 讨论
近年来,BMSCs 成为骨组织工程学领域一个热点研究内容,给OA 的治疗带来了更大的希望。BMSCs成骨能力较弱,必须进行体外诱导后才能应用于组织工程的修复[8]。有研究[9]显示,慢病毒携带骨形态发生蛋白2 和转化生长因子β2 的重组质粒过表达具有协同促进大鼠BMSCs 成骨分化的作用。
IGF1 是一个由人类基因IGF1 编码的蛋白质。以往有研究[10]显示,IGF1 促进软骨损伤愈合的机制为:①对软骨细胞的分裂与增殖进行刺激;②增加细胞外基质的含量;③对软骨细胞表型稳定进行维持;④对软骨细胞的凋亡进行抑制。IGF1 能够有效促进BMSCs的增殖及软骨分化,并维持软骨胶原纤维的稳定性[11]。因此本研究选择了IGF1 基因慢病毒载体,通过慢病毒感染体外培养的BMSCs 将外源性IGF1 基因整合至细胞,IGF1 基因慢病毒对BMSCs 的转染效率为(90.36±2.18)%,并筛选得到了稳定转染细胞株。提示外源IGF1 基因已成功整合至BMSCs,并能够稳定表达IGF1 基因。为探讨IGF1 基因慢病毒转染BMSCs对OA 关节损伤的修复能力,实验构建了OA 大鼠模型,通过向膝关节腔内注射IGF1 基因慢病毒转染骨BMSCs,观察其在关节损伤修复中的作用。结果显示:BMSCs+IGF1 组大鼠膝关节软骨完整,无明显退化,关节面平整,BMSCs 组与模型组大鼠均存在不同程度软骨退变,关节面不平,提示IGF1 基因慢病毒转染BMSCs 能有效改善OA 大鼠的病理损伤。BMSCs 组的血清CTX-Ⅰ、CTX-Ⅱ、IL-1α、IL-6 水平,OC、GSK-3β、ALP、Runx2 mRNA 表达水平,β-catenin、Wnt1、GSK-3β蛋白表达水平均明显低于模型组,BMSCs+IGF1 组明显低于BMSCs 组,与段志斌[12]等研究结论基本一致。CTX-Ⅰ、CTX-Ⅱ是骨吸收生化标志物,膝关节OA 患者血清CTX-Ⅰ、CTX-Ⅱ呈过表达[13-14]。IL-1α、IL-6是炎症指标,OA 患者炎症越严重,血清IL-1α、IL-6水平越高[15-17]。此外,OC、GSK-3β、ALP、Runx2、βcatenin、Wnt1 等分子系统或信号通路对于调节破骨细胞功能起到至关重要的作用,OA 发生发展过程中伴随着以上分子系统或信号通路上调[18]。由此可以说明,BMSCs 可通过降低相关骨吸收指标、炎症因子水平及调控β-catenin/Wnt1/Runx2 信号通路,对OA 大鼠起到治疗作用,而IGF1 基因慢病毒转染BMSCs 的治疗作用更显著。
综上所述,IGF1 基因慢病毒转染BMSCs 能有效改善OA 大鼠的病理损伤,能明显促进膝关节损伤修复,可为OA 的临床治疗奠定基础。
