气体信号分子对特发性肺纤维化的作用机制研究进展
2022-11-17李傲寒王茜茜陈颖卿
李傲寒 白 羽 王茜茜 陈颖卿
大连大学医学院慢性病研究中心,辽宁大连 116622
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是以组织内肺成纤维细胞过度增殖,细胞外基质(extracellular matrix,ECM)过度积聚为病理特征的一种间质性肺疾病[1]。IPF 患者诊断后的平均生存期仅为2~4 年,5 年生存率为20%~25%,死亡率高于多数肿瘤[2]。目前国家药监局批准的IPF 治疗药物主要有糖皮质激素、吡非尼酮和尼达尼布,但这些药物治疗效果具有个体差异且毒副作用大[3],因此寻找低毒性有效治疗IPF 药物已成为研究热点。一氧化氮(nitrogen monoxide,NO)、一氧化碳(carbon monoxide,CO)和硫化氢(hydrogen sulfide,H2S)等气体信号分子是一种维持细胞稳态且半衰期较短的小分子[4],对肺纤维化的进程具有一定的干预作用,然而其分子调控机制还有待进一步探讨。本文将从以上3 种气体信号分子对IPF 的干预机制及临床应用进行综述。
1 NO 对肺纤维化疾病的调控作用
NO 是L-精氨酸氧化成瓜氨酸过程中的副产物,需三种一氧化氮合成酶(nitrogen monoxide synthase,NOS)的调控,包括神经元NOS(neuronal nitric oxide synthase,nNOS 或NOS1)、诱导型NOS(inducible nitric oxide synthase,iNOS 或NOS2)和内皮型NOS(endothelial nitric oxide synthase,eNOS 或NOS3)[5-6]。研究发现博莱霉素(Bleomycin,BLM)可激活核因子κB(nuclear factor kappa B,NF-κB)上调iNOS 和NLRP3促进肺组织内纤维化的发生,并且发现降低肺组织中iNOS 的表达可以抑制肺纤维化;而NO可通过S-亚硝基化的方式抑制NLRP3 炎症小体的组装,抑制白细胞介素(interleukin,IL)-1β 的分泌,进而改善肺纤维化[7-9]。因此,过多NO 对肺纤维化具有恶化作用,而一定量的NO 可调节相关炎症反应从而改善肺纤维化的发生。见图1。
四氢生物蝶呤(tetrahydrobiopterin,BH4)是NOS的辅助因子,低水平的BH4 会使NOS 解耦联,从而产生少量NO、超氧化物和过氧亚硝酸盐,导致血管氧化应激反应及内皮功能的障碍[10]。研究显示,IPF 患者血清中存在大量硝基酪氨酸和活性氧,提示BH4 减少可促进氧化应激反应而影响纤维化的发生与发展[10-12]。另外,BH4 的氧化产物BH2 可以竞争性地与NOS 结合,进而干扰BH4 激活NOS[13-14]。因此,BH4/BH2 的比值降低也会引起NOS 解耦联。通过口服BH4 可提高血中BH4 含量改善BLM 诱导的大鼠肺动脉高压和肺纤维化[10]。见图1。
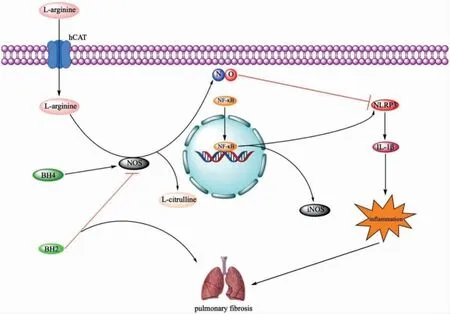
图1 一氧化氮对肺纤维化的治疗作用及其分子调控机制
综上所述,NO/NLRP3 信号轴和NOS 辅助因子BH4 可能是以后治疗肺纤维化的有效靶点,其分子作用机制还有待进一步探究。
2 CO 对肺纤维化疾病的干预及其调控作用
CO 是由血红素氧合酶(heme oxygenase,HO)降解血红素而生成[15]。CO 可通过自分泌或旁分泌与可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC)的调节亚单位血红素铁结合,使其构型发生改变而被激活,然后催化GTP 生成环磷酸鸟苷cGMP 发挥松弛平滑肌、血管扩张等有益生物学效应[16-17],这可能是治疗肺纤维化的重要机制。CO 还可以预防缺氧性肺动脉高压,对肺移植、哮喘和缺血再灌注损伤等非损伤性疾病具有保护作用[16,17]。在临床Ⅱ期研究中发现,IPF患者使用低剂量(100~200 ppm)CO 气体可有效降低基质金属蛋白酶7(matrix metalloproteinase 7,MMP7)水平,从而改善肺纤维化,但MMP7 是否可以作为CO治疗的直接靶点还有待进一步研究[18]。另外CO 可以通过增加p21Cip1 的表达或降低细胞周期调节蛋白A 和D 水平,从而抑制成纤维细胞的增殖而减缓肺纤维化[19]。见图2。

图2 一氧化碳对肺纤维化的治疗作用及其分子调控机制
3 H2S 对肺纤维化疾病的干预及其调控作用
H2S 是继NO 和CO 后发现的第三种内源性气体信号分子。H2S 主要由L-半胱氨酸在胱硫醚-β-合成酶(cystathionine β-lyase,CBE)、胱硫醚-γ-裂解酶(cystathionine γ-lyase,CSE)及3-巯基丙酮酸硫基转移酶(3-mercaptopyruvate sulfurtransferase,3-MST)降解半胱氨酸而生成[20-21]。研究显示,内源性H2S 可通过抗氧化、抗炎及抗衰老作用抑制炎症因子的释放,进而保护肺部损伤而引起的肺纤维化[22]。
3.1 H2S 通过其抗氧化机制改善肺纤维化
氧化应激反应可诱导肺泡上皮细胞凋亡和肌成纤维细胞活化导致细胞外基质的沉积进而形成纤维灶[23-25],与肺纤维化的发生与发展有密切联系。研究发现,H2S 可通过促使NF-E2 相关因子2(nuclear erythroid 2-related factor 2,Nrf2)的核转移,上调肺组织中HO-1 和硫氧还蛋白(thioredoxin,Trx-1)的蛋白表达,增强对氧化应激反应的耐受性,进而抑制肺纤维化的进程[26]。见图3。
3.2 H2S 通过抗炎作用改善肺纤维化
慢性肺部炎症及感染可促使肺成纤维细胞转化为肌成纤维细胞形成组织纤维化[27];有研究显示,磷脂酰肌醇3-激酶(phosphatidylin-ositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB)/缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)信号通路的激活可促进肺纤维化的进程,而注射NaHS 溶液给予外源性H2S 可抑制AKT 磷酸化与HIF-1α 的表达,减轻肺纤维化早期的炎症反应,从而改善肺纤维化[28]。综上所述,外源性及内源性H2S 可通过其抗炎作用改善并延缓肺纤维化的进程。见图3。
3.3 H2S 通过抑制上皮细胞-间充质转化(epithelialmesenchymal transition,EMT)改善肺纤维化
EMT 是纤维化发展中的重要机制[9]。其中TGFβ1/Smads 信号通路可诱发EMT,TGF-β 可与受体蛋白结合通过酶解或酸性微环境释放后与TGF-βR2 结合,继而激活Smads 家族蛋白调控相关基因的转录[29-30],造成胶原沉积。结缔组织生长因子(connective tissue growth factor,CTGF)是介导TGF-β 通路的重要下游基因,研究发现BLM 诱导的IPF 中,TGF-β1 及CTGF 蛋白表达均显著升高[28],但给予外源性H2S 可以显著降低TGF-β1 及CTGF 蛋白表达,还可以下调α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)及抑制Ⅰ型胶原蛋白和Ⅲ型胶原蛋白表达,从而起到抗纤维化的作用[31-33]。见图3。

图3 硫化氢对肺纤维化的治疗作用及其分子调控机制
3.4 H2S 的抗衰老作用改善肺纤维化
细胞衰老是一种不可逆的细胞周期停滞的状态,与IPF 的发病机制密切相关[34]。p53 和p21 细胞衰老的标志物,正常生理状况下可通过E3 泛素连接酶小鼠双微体2(murine double minute 2,MDM2)的作用泛素化降解[35-36],BLM 诱导的肺纤维化中,p53 与p21 两者的表达显著增加[37-38]。H2S 可通过MDM2 的介导降解p53[39],还可通过减少血管紧张素Ⅱ抑制成纤维细胞的异常增殖[38],进而抑制肺纤维化的发生。见图3。
随着对H2S 在肺纤维化中的作用及其分子调控机制的深入研究,H2S 可通过其抗炎、抗氧化及抗衰老作用防治肺纤维化的进程,其供体也有望成为临床对肺纤维化的一种新型治疗手段。
4 结论及展望
目前治疗肺纤维化的药物十分有限,迫切寻找低毒且有效治疗肺纤维化的新型药物。近年,气体疗法已成为防治IPF 的研究热点。本文针对近5 年气体信号分子对IPF 的分子干预机制进行了研究和探讨,总结后发现:不同的气体信号分子对肺纤维化的调控机制各不相同,NO 主要通过调节相关炎症反应进而改善纤维化的发生;CO 通过增加p21Cip1 的表达及降低细胞周期调节蛋白A 和D 水平,从而抑制成纤维细胞的增殖改善肺纤维化;H2S 主要通过其抗氧化、抗炎、抑制EMT 发生和细胞衰老等各种分子机制改善肺纤维化。尽管已有大量的动物实验支持气体信号分子的抗肺纤维化作用,但相应临床研究尚未展开,需要更多的临床试验去验证,并为今后利用气体疗法防治IPF 提供重要实验依据。
