Ti粉活化对碳热还原氮化法制备Ti(C,N)粉末的影响
2022-11-16谢军龙李开华叶金文
谢军龙,李开华,叶金文
(四川大学 材料科学与工程学院,成都 610065)
Ti(C,N)基金属陶瓷具有高熔点、高硬度,良好的耐腐蚀性能、优异的抗氧化性能、高耐磨性等优异性能[1-2],广泛应用于工业领域,如切削工具[3]、导电陶瓷[4]、砂轮[5]、耐磨涂层[6]和电子设备制造中的引线键合工具[7]。但是这些应用都要求Ti(C,N)粉末,具备化学成分均匀、粒径小、成本低等特点。以 TiO2作为Ti源制备Ti(C,N)粉末的碳热还原氮化法具有成本低、工艺程序简单等特点[8],适合大规模生产,在工业上广泛采用。碳热还原氮化法的反应过程一般由连续的三个反应阶段组成[9]。第一反应阶段:TiO2以逐渐增加的反应速率被还原为一系列中间体亚氧化钛(TinO2n-1),以Ti3O5的生成截止;第二反应阶段:Ti3O5与氮气、碳黑反应生成Ti(C,N,O)或 Ti(C,N),此阶段反应速率最快;第三反应阶段:Ti(C,N)中 C、N、O原子间的相互置换,反应由扩散机制控制[10],反应速率最慢。由于传统碳热还原氮化法制备Ti(C,N)粉末的反应温度较高,一般在1 800~2 000 ℃[11],致使反应产物晶粒长大严重,难以满足高性能Ti(C,N)基金属陶瓷材料的需求。为了降低反应温度,制备颗粒细小的Ti(C,N)粉末,研究者一般从上述三个反应阶段入手,如KOC等[12]通过热解C3H6使得新生碳颗粒均匀包覆在TiO2的表面,增加了反应物之间接触面积,降低了动力学势垒,加速碳热还原反应的三个阶段,从而大幅度降低反应温度,在1 600 ℃得到氧含量(质量分数)为0.57%的Ti(C,N)粉末,但该方法尚未工业化应用。
在工业电解制备钛粉过程中产生的大量颗粒细小、氧含量高的钛粉,目前在工业上尚无明确用途,被作为抛尾料废弃。为此,本文作者尝试添加电解Ti粉的抛尾料作为活化剂来加速碳热还原氮化反应,从而达到电解 Ti抛尾料再利用以及降低反应温度的目的,并研究物料体系的碳热还原反应动力学过程和物相演变规律,为在较低温度下工业化生产高品质的Ti(C,N)粉末提供支撑。
1 实验
1.1 原料与方法
实验原料:纳米锐钛矿型TiO2(<100 nm)、纳米碳黑(<100 nm)以及Ti粉。Ti粉为攀钢提供的电解Ti抛尾料,w(O)为2.044%,费氏粒度为14.35 μm。
以纳米锐钛矿型TiO2、纳米碳黑为原料,并添加15%的抛尾Ti粉,在聚氨酯球磨罐内球磨混合,然后称取600 g混合料装舟,在流动氮气中,800~1 750 ℃温度下,匀速推入石墨碳管炉保温区中保温2~4 h。
1.2 测试方法
采用DX-2700型X射线衍射仪对实验产物进行物相分析,管电压为40 kV,电流为30 mA,CuKa,扫描范围为 20°~90°。采用德国 NET公司的NETZSCH-STA-449C综合热分析仪对 TiO2-C、TiO2-C+Ti混合物进行热重分析(thermal gravity analysis)和差式扫描量热分析(differential scanning calorimetry,DSC),得到TG/DTG曲线和DSC曲线,其标样为金属Zn,热天平灵敏度为0.1 μg,升温速率为10、15、20 ℃/min,氮气流速为50 mL/min。采用日立S-450型扫描电镜观察反应产物的形貌、粒径。采用WLP-216型平均粒度测定仪表征尾料Ti粉的费氏粒度。采用 CS-744、CS-600碳硫分析仪分别测定反应产物的总碳含量和游离碳含量,采用ON-736氧氮分析仪对氧含量和氮含量进行分析。
2 结果与讨论
2.1 碳热还原氮化反应合成动力学分析
未添加以及添加抛尾 Ti粉后 TiO2-C物料的TG/DTG曲线如图1所示。图1(a) 显示未添加抛尾Ti粉的物料在第一阶段质量损失率为8.53%,接近理论计算的质量损失率(8.41%)。由于添加的抛尾 Ti粉和N2发生反应,图1(b)的TG曲线在570~1 034 ℃温度范围内呈现上升趋势。此外,图1(b)显示添加抛尾 Ti粉的碳热还原氮化反应仍旧由连续的三个反应阶段构成。
Ti具有还原性,可将TiO2还原为中间相TinO2n-1,TinO2n-1由于含有氧空位,更易与碳黑反应,并且 Ti的氮化或碳化反应为放热反应[13-14],可为碳热还原氮化反应提供能量,因而可大幅度加速第一阶段的反应速率,降低反应温度。从图1可知,相比于未添加抛尾Ti的第一阶段(<1 205 ℃),添加抛尾Ti的第一阶段在 1 193 ℃提前结束。随着反应温度升高,碳热还原氮化反应进行到第二阶段,添加抛尾Ti粉后质量损失率由 17.12%大幅度提升至 21.45%,其具体原因由下面活化能的计算说明。当反应进行到第三阶段时,Ti已逐渐被消耗,活化作用减弱,添加抛尾Ti粉的起始温度仅略有降低。

图1 添加Ti粉前后的TG/DTG曲线Fig.1 TG/DTG curves before and after Ti addition
何旭等[15]的研究表明 1 355 ℃左右存在 Ti3O5转化为Ti(C,N)或 Ti(C,N,O)的吸热峰,对应于碳热还原氮化反应的第二阶段。为了明确Ti对碳热还原氮化反应第二阶段的活化机制,选取 DSC曲线上 1 300~1 365 ℃区域,使用Starink近似下的Kissinger-Akahira-Sunose (KAS)方法[16]对其进行动力学拟合。
图2所示为未添加以及添加抛尾Ti粉的混合物在不同升温速率下的DSC曲线(对应碳热还原氮化反应的第二阶段)。以虚线为基线,DSC曲线与虚线所围部分即为此反应的吸热峰,同样也描述了反应历程[17]。转换率的计算公式为:

图2 不同升温速率下的DSC曲线Fig.2 DSC curves under different heating rates

式中:Si为反应开始后温度T下DSC峰的面积,St为整个吸热峰的总面积。图3所示为不同升温速率下反应过程中转换率α随温度的变化曲线。
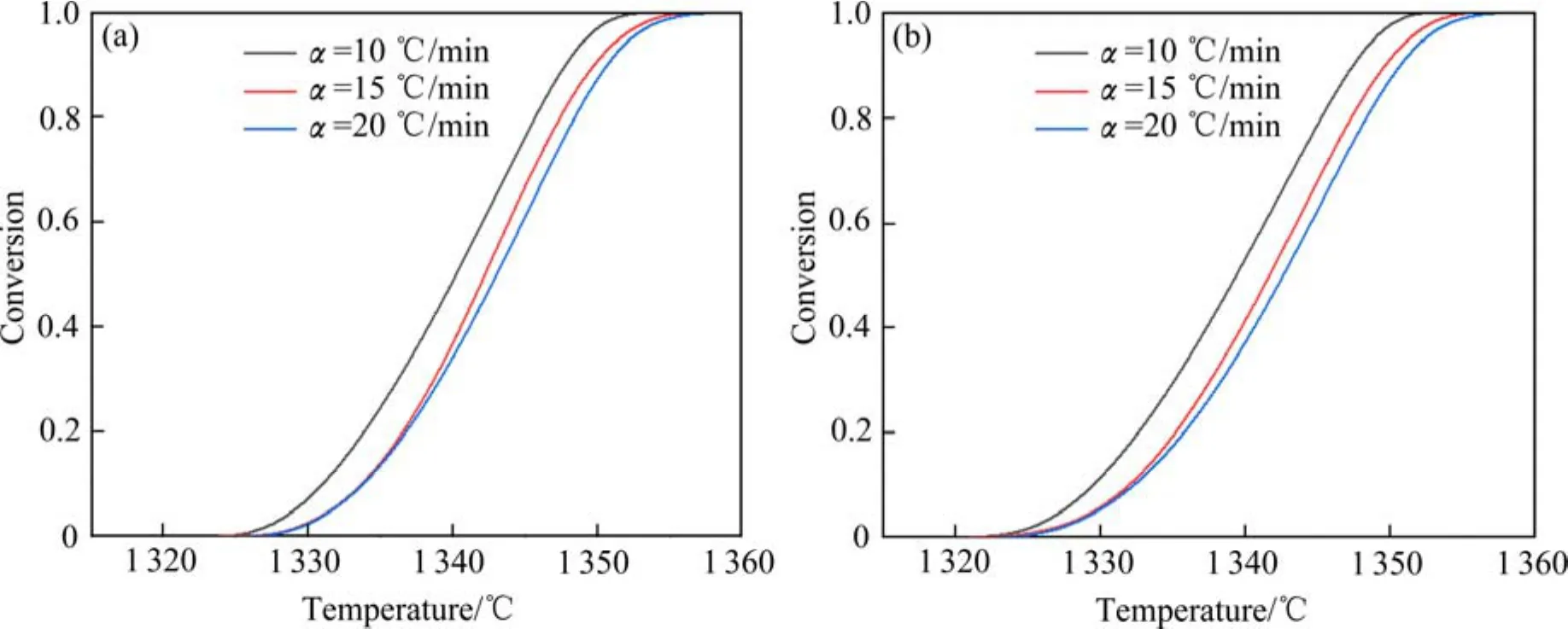
图3 不同升温速率下反应转化率的变化曲线Fig.3 Variation curves of reaction conversion with heating rates
根据 Starink近似下的 KAS表达式求解活化能Ea[18]:
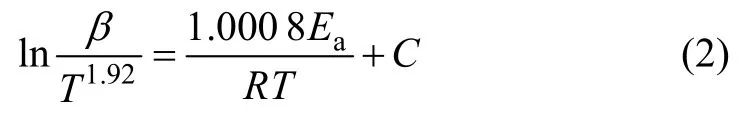
式中:β为加热速率,R为气体常数(8.314 J/mol),T为热力学温度,C为由反应动力学模型和反应步骤决定的常数,Ea为活化能。由式(2)可知,激活能Ea为ln(β/T1.92) - 1/T关系曲线的斜率。将转化率为0.2、0.3、0.4、0.5、0.6、0.7、0.8时的数据代入式(2),得到图4所示不同转化率下的散点图和拟合曲线,拟合参数列于表1。可见拟合优度(R2)均大于0.8,表明拟合相关性较好,根据式(2)和表1中的数据求得未添加与添加抛尾Ti粉条件下,Ti3O5生成Ti(C,N)的平均活化能分别为(5053.34±683.64) kJ/mol和(4485.46±687.33) kJ/mol。

表1 不同转化率下的KAS动力学拟合参数Table 1 Kinetic fitting parameters with different reaction conversion

图4 不同转化率下的ln(β/T1.92)-1 000/T拟合曲线Fig.4 ln(β/T1.92)-1 000/T fitting curves with different reaction conversion
综上所述,抛尾Ti粉的活化机制表现在以下两个方面:其一、Ti可在较低的温度下将 TiO2还原为TinO2n-1,促进碳热还原反应的进行,从而降低碳热还原氮化反应温度;其二、碳热还原氮化反应第二阶段的活化能降低,从而大幅提高反应速率,加速反应的进行。
2.2 物相演变
在开放体系下,添加15%抛尾Ti粉的TiO2-Ti-C混合物在 800~1 400 ℃,流动氮气气氛下保温0.5 h所得反应产物的物相如图5所示。其中,各反应的ΔGϴ-T的关系式是采用实用无机化合物热力学数据手册[19]中的数据,通过物质吉布斯自由能函数法计算得到。
由图5可知800 ℃时反应产物的物相为锐钛矿型TiO2、金红石型 TiO2、Ti4O7以及金属 Ti。该温度下存在 Ti4O7相可能是由于活化剂金属 Ti的良好还原性,与TiO2发生反应生成Ti4O7,反应方程式和吉布斯自由能ΔG计算公式分别如式(3)和式(4)所示。未检测到 TiO2与碳逐级还原而产生的 TinO2n-1(n>4)的物相,说明添加Ti有利于促进中间相的转变。

图5 800~1 400 ℃保温0.5 h所得反应产物的XRD图(a)和1 300 ℃、1 400 ℃下产物的衍射峰在61°~63°范围内的放大图(b)Fig.5 XRD patterns of reaction products obtained by holding at 800~1 400 ℃ for 0.5 h (a) and an enlargement of the diffraction peak of the products at 1 300 ℃ and 1 400 ℃ in the range of 61°~63° (b)
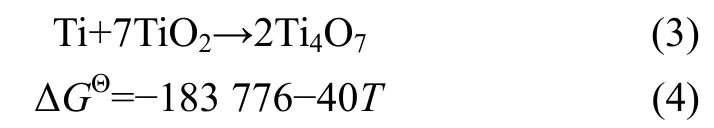
900 ℃时反应产物主要由金红石型TiO2、锐钛矿型TiO2、Ti4O7和Ti组成。1 000 ℃时反应产物的物相主要有金红石型TiO2、Ti4O7和Ti,而锐钛矿型TiO2的衍射峰消失,说明此温度下TiO2的晶型转变已经完成;另外,反应产物中检测到微量的TiN,说明 1 000 ℃下氮气开始参与反应,根据热力学计算,推测应该是抛尾Ti粉与N2发生反应生成TiN,如式(5)所示。

温度升高至 1 100 ℃,产物的物相主要由 Ti4O7和TiN构成(见图5),而金红石型TiO2的衍射峰完全消失,说明TiO2被完全还原为Ti4O7,如式(7)所示。XRD未能检测到Ti的衍射峰,意味着此时金属Ti微量存在或已消耗完。

在 1 200 ℃时,产物主要由 Ti4O7、Ti3O5和 TiN组成。前文合成动力学表明添加抛尾Ti活化后反应仍旧遵循碳热还原氮化反应的规律,结合热力学分析可能有式(9)和(11)所示反应发生:

在1 300 ℃时产物主要由Ti3O5和TiN组成。随着反应温度升高,碳热还原反应更加完全,Ti4O7对应的衍射峰消失。
最后,当反应温度为 1 400 ℃时,反应产物为单一的Ti(C,N)相。如图5在61°~63°的局部放大图所示,较之1 300 ℃反应产物中TiN的衍射峰,峰位整体向低角度偏移,根据布拉格方程可知产物的晶格常数增大[20]。由式(14)计算出式(13)所示合成TiC的理论温度为1 335 ℃,因而在升温、保温过程中,Ti3O5与碳黑反应生成TiC。TiC的晶格常数(aTiCN=0.424 0 nm)大于TiN的晶格常数(aTiCN=0.432 0 nm)[21],根据Vegard定律aTiCN=(1-x)aTiC+xaTiN可知,发生式(15)所示反应固溶合成Ti(C,N)的晶格常数也大于TiN,结合前面峰位的偏移推断出1 400 ℃下产物的物相为Ti(C,N),总反应式如式(16)所示。与传统碳热还原氮化反应于1 600 ℃合成单相Ti(C,N)[22]相比,添加活化剂Ti后单相的合成温度降低200 ℃。
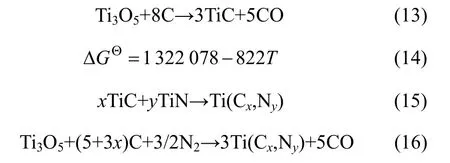
综上所述,在添加活性剂Ti条件下碳热还原氮化合成Ti(C,N)粉末时,1 400 ℃保温0.5 h所得反应产物的氧含量w(O)、游离碳含量w(游离C)分别高达2.22%和 5.78%,说明碳热还原反应仍未进行完全,需进一步提高温度或延长保温时间,使C原子充分置换N、O原子。
图6所示为1 750 ℃保温4 h得到产物的XRD谱和SEM图。由图6(a)可知,反应产物为单相Ti(C,N),并且峰位与标准 PDF卡片(#03-065-9875)对应良好。结合碳和氮氧等元素含量分析知,w(O)为0.34%,w(游离碳)为0.33%,w(N)为11.16%,w(总碳)为9.67%,C与N的原子比为1:1,即合成产物为Ti(C0.5,N0.5)固溶体粉末。结合图6(b)形貌可知,Ti(C0.5,N0.5)固溶体粉的粒径为1~2 μm,颗粒尺寸均匀,部分颗粒出现烧结现象。

图6 1 750 ℃保温4 h后反应产物的XRD谱(a)和SEM图(b)Fig.6 XRD pattern (a) and SEM image (b) of reaction products after holding for 4 h at 1 750 ℃
3 结论
1) 抛尾Ti粉能有效活化碳热还原氮化反应进程,表现在一方面抛尾Ti粉能在第一阶段将TiO2转化为Ti4O7,加速反应进程;另一方面,Ti的添加使得第二阶段的活化能从(5 053.34±683.64) kJ/mol降低至(4 485.46± 687.33) kJ/mol,降低了反应温度。
2) 抛尾 Ti粉活化的碳热还原氮化反应过程中物相演变顺序为锐钛矿型 TiO2→金红石型 TiO2→Ti4O7→Ti3O5→TiN→Ti(C,N),其中部分活化剂 Ti与TiO2反应生成Ti4O7,越过了TinO2n-1(n>4)的中间相转变;而未与TiO2反应的Ti则在高温下形成TiN,最终形成Ti(C,N)。
3) 基于抛尾Ti粉活化的物料在1 750 ℃保温4 h下,成功制备了w(O)为0.34%、w(游离C)含量为0.33%,粒径1~2 μm的高品质Ti(C0.5,N0.5)粉末。
