Mg-Fe-LDH涂层改性AZ91D合金的耐蚀性、体外降解及成骨性能
2022-11-16景绍慧周吉祥赵大鹏吴宏
景绍慧,周吉祥,赵大鹏,吴宏
(1.中南大学 粉末冶金国家重点实验室,长沙 410083;2.中南大学 湘雅医院,长沙 410083;3.湖南大学 生物学院,长沙 410083)
新时代背景下,镁合金作为绿色化生物金属材料的代表,以其高比强度、高强韧性和生物可降解等优点受到广泛关注[1]。因具有与人体骨骼相近的弹性模量(41~45 GPa)和密度(1.74~1.84g/cm2),镁合金成为骨科植入材料的理想候选者,被广泛应用于可降解心血管支架、骨固定材料和骨组织工程多孔支架材料等医疗器械[2-3]。然而,镁的标准电极电位较低(约-2.37 V),化学活性较为活泼,当镁合金与腐蚀介质接触后,会迅速发生电化学反应并形成疏松多孔的腐蚀层膜,使用寿命大打折扣[4]。如何提高镁合金的耐腐蚀性是镁基金属植入物在生物医学领域继续发展亟需解决的问题。
表面改性是目前提高镁合金耐腐蚀性最为有效的方法,包括微弧氧化处理、溶胶-凝胶法和化学转化涂层等改性方法[5]。主要是通过在镁基体表面构建阻碍镁基金属植入物与腐蚀环境直接接触的涂层,从而降低镁合金被腐蚀的概率,达到缓蚀效果[6-7]。LDH(layered double hydroxide)是一种具有典型二维层状结构的生物材料,主要由二价、三价金属阳离子、层间阴离子和结合水构成[8]。结构的特殊性和优异的离子交换性,使得 LDH在与腐蚀介质接触后,侵蚀性离子被捕获到 LDH的中间层,与层间阴离子进行交换,从而降低腐蚀液浓度,实现缓蚀作用[9]。CHEN等[10]采用原位生长法在 AZ31镁合金上制备了Mg-Al-LDH薄膜,对不同变形工艺处理后AZ31的微观结构和晶粒尺寸以及腐蚀行为进行分析发现,镁合金经轧制处理后形成的 LDH涂层更厚且更紧凑,缓腐效果最佳。DING[11]团队采用原位生长法在 AZ31B镁合金表面优先构建了 LDH转化膜,使用月桂酸盐对其进行改性,得到了脲交联聚二甲基硅氧烷疏水聚合物层。与未改性的 LDH涂层相比,超疏水复合涂层具有较长的保护作用和较快的自愈合效果,对扩大镁合金的潜在应用具有重要意义。大多数研究者将目光聚焦在解决镁合金耐腐蚀性问题,往往忽略了镁合金作为骨科植入物在实际应用过程中,植入物与骨组织间结合不理想、骨修复能力较差和调节成骨作用不显著等问题导致植入失败,并给患者带来严重的术后风险和巨大的经济压力[12]。
构成 LDH结构的层间金属阳离子有着优异的生物学性能,如Mg2+作为细胞代谢和生长的辅酶因子,在改善材料的生物活性、促进骨重建和增强成骨分化等过程都扮演着重要角色[13];Fe3+作为人体不可或缺的元素,在红细胞成熟过程中,与细胞代谢和促骨分化等过程息息相关[14]。实验以具有良好机械和物理性能,但耐腐蚀性较差的医用 AZ91D镁合金材料作为研究对象,对其进行Fe-LDH涂层改性,一方面有效提高镁合金耐腐蚀性能,另一方面改善成骨效果,为解决镁基骨科植入物因调节成骨效果差等导致植入失败这一问题提供理论依据。
1 实验
1.1 材料
AZ91D镁合金购自东莞市捷金金属材料有限公司,主要成分及含量见表1。六水氯化镁(MgCl2·6H2O)、六水氯化铁(FeCl3·6H2O)和氢氧化钠(NaOH)均购自上海化工有限公司。

表1 AZ91D镁合金的化学成分Table 1 Chemical composition of AZ91D Mg alloy (mass fraction, %)
1.2 合金预处理
将AZ91D镁合金切成小圆片(直径为10 mm,厚度为2 mm),使用SiC砂纸逐级打磨,依次用丙酮、无水乙醇和超纯水在超声波清洗机中对试样进行洗涤,在室温下风干后备用。
1.3 Fe-LDH/AZ91D的制备
按n(Mg2+):n(Fe3+)=2:1称量0.467 9 g MgCl2·6H2O和0.270 3 g FeCl3·6H2O,倒入10 mL去离子水中搅拌混匀。使用质量浓度为0.04 g/mL的NaOH溶液调节上述溶液pH值至10.0,充分搅拌后,将上述溶液倒入20 mL反应釜中,并放入镁片。将反应釜拧紧后放入100 ℃烘箱中水热12 h,之后取出镁片,用去离子水冲洗、干燥,最终得到Fe-LDH/AZ91D样品,样品的制备示意图如图1所示。
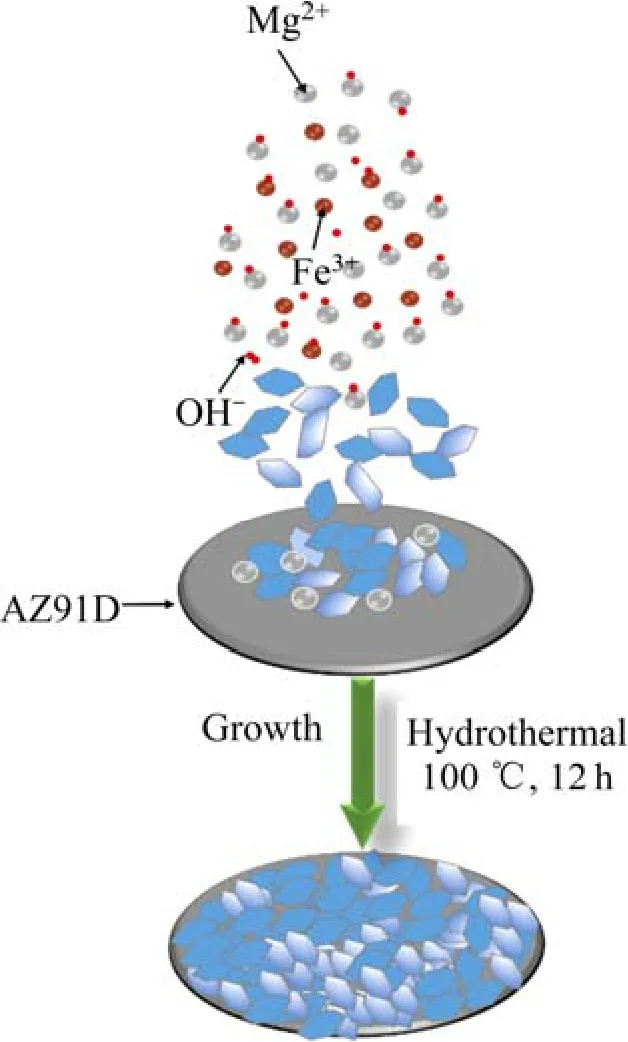
图1 Fe-LDH/AZ91D样品制备示意图Fig.1 Schematic diagram of Fe-LDH/AZ91D sample preparation
1.4 微观结构表征
使用配有能谱仪(EDS)的场发射扫描电子显微镜(SEM,QuantaFEG250,FEI,USA),透射电子显微镜(TEM,JEM-2100F,JEOL,Japan)和动态光散射装置(DLS,Zeta sizer Nano ZS, Malvern Panalytical, UK)对涂层形貌、成分及尺寸进行分析。通过X射线衍射仪(XRD,Rigaku D/MAX-2250,Bruck,GmbH,Switzerland)分析晶体结构,以Cu靶(λ=0.154 06 nm)为辐射源,扫描速率为2 (°)/min, 2θ=5°~90°。使用DA-300M 海绵密度测试仪对样品的密度进行测试。
1.5 涂层体外降解实验
1.5.1 电化学测试
采用带有三电极腐蚀电池的电化学工作站(Multilab M204,瑞士)在体积分数为0.9% 的NaCl电解质中进行电化学实验,待测样品(暴露面积 1 cm2)为工作电极,饱和甘汞电极为参比电极,铂电极为对电极。在开路电位(open circuit potential,OCP)下进行EIS(electrochemical impedance spectroscopy)测试,扰动振幅为10 mV,频率范围为10 MHz~100 kHz;塔菲尔(Tafel)极化曲线以开路电位作为参考,在-0.5~1.5 V电压范围内,以1 mV/s的扫描速率进行测试,最终通过C-view软件对测试结果进行分析。
1.5.2 析氢实验
将暴露面积为1 cm2的AZ91D和Fe-LDH/AZ91D浸入250 mL磷酸盐缓冲盐水(phosphate buffer saline,PBS)溶液中,使用滴定管和倒锥形组成的析氢装置收集产生的氢气,每24 h记录氢气释放量,共计14天。对试样浸泡过程中每天的质量变化进行监测,并通过下式分别计算质量损失率及腐蚀速率:
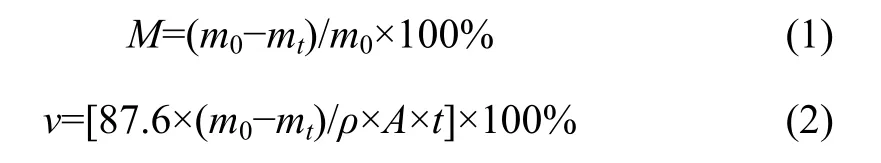
式中:M为质量损失率;%;m0为样品初始质量,g;mt为样品浸泡后的质量,g;v为腐蚀速率,mm/a;ρ为样品密度,g/cm3;A为样品暴露面积,cm2;t为浸泡时间,h。
1.6 细胞培养模式
1.6.1 细胞增殖
选择人成骨肉瘤细胞(SaOS-2细胞)进行培养,使用McCoy完全培养基(由体积分数为84%McCoy培养基(Gibco,美国)、15%胎牛血清(FBS;Gibco,美国)和 1%青霉素-链霉素(PS;Gibco,美国)组成)培养细胞。通常使用样品浸提液对细胞进行培养,将Fe-LDH/AZ91D在紫外照射灭菌1天后,以0.5 cm2/mL的表面积/体积比在McCoy培养基中浸提1天,再将浸提液用 McCoy完全培养基分别稀释至体积分数为 30%、60%和90%的样品培养基(sample medium,SM),最后将SaOS-2细胞以5 000个/孔的密度接种在48孔板中,放入细胞培养箱中培养,每2天更换一次培养基。
1.6.2 细胞活性测试
待 SaoS-2细胞与样品培养基在 CO2培养箱中培养1、3、5天后进行CCK-8测定以评估细胞活性,使用酶标仪在460 nm处测量细胞工作溶液的吸光度。
1.7 SaOS-2细胞的体外介导成骨作用
1.7.1 碱性磷酸酶(alkaline phosphatase, ALP)活性
SaOS-2细胞以5 000个/孔的密度种植在48 孔板中,在细胞培养箱中进行培养,当培养至第4、6天时进行ALP定性测试:细胞经PBS清洗3次后,使用体积分数为4%的多聚甲醛(paraformaldehyde, PFA)在室温下固定15 min,再次用PBS清洗3次,每孔加入100 μL ALP染色试剂(Jiancheng bio-engineering research institute of Nanjing, China) 染色20 min,吸去染色剂并用PBS清洗3次以终止染色,使用荧光显微镜 (DSY-L140, chang heng rong chuang technology) 对细胞进行拍照。ALP定量测试:待细胞培养至 4、6天时,对细胞进行清洗后,每孔加入 200 μL RIPA(radio immunoprecipitation assay)裂解液,在冰上进行15 min裂解,将裂解液转移至1.5 mL 离心管中,以12 000 r/min的转速离心10 min,对上清液的ALP 活性进行测定,采用 BCA(bicinchoninic acid)试剂盒(beyotime, China) 对上清液的蛋白浓度进行测定,通过蛋白浓度对ALP 活性进行标准化处理。
1.7.2 胶原蛋白分泌(collagen,COL)
将SaOS-2 细胞以5 000个/孔的密度种植在48孔板中,在细胞培养箱中进行培养,待培养至6、8天时吸去旧培养基并清洗细胞,使用体积分数为4%的PFA对细胞进行固定15 min,再次清洗细胞,每孔加入200 μL 体积分数为 0.1%的天狼猩红染色剂(sigma, USA)在室温下避光孵育6 h,吸去染色剂并用PBS 清洗3次以终止染色,在荧光显微镜下对细胞进行拍照。拍照完毕后,每孔加入 150 μL 洗脱液(φ(乙醇):φ(0.2 mol/L NaOH) =1:1)洗脱 30 min,每孔取 100 μL 洗脱液转至 96 孔板,在酶标仪上检测波长在520 nm处的吸光度。
1.7.3 细胞外基质(extracellular matrix,ECM)矿化
将 SaOS-2 细胞以5, 000个/孔的密度接种在48孔板,细胞贴附生长1天后,改用不同体积分数的样品培养基进行培养,另外加入β-磷酸甘油钠(10 mM)、维生素 C(50 μg/mL)和地塞米松(100 nM)加速成骨细胞分化,每2天更换一次培养基。培养至10、12天后,吸去培养基,使用PBS 洗涤细胞3次,然后使用体积分数为4%PFA固定细胞 30 min,之后使用体积分数0.2%的茜素红染液(alizarin)在 37 ℃下对 SaOS-2 细胞分泌的钙结节进行染色30 min,使用光学显微镜拍摄图像。拍照结束后将染液溶解在体积分数为10%的氯化十六烷基吡啶溶液中进行定量分析,使用酶标仪对570 nm处的吸光度进行检测。
1.8 数据统计分析
最终的实验数据从至少3次平行实验中得到,并用平均值±标准差来表示。采用最小显著性差法(least significant difference,LSD)进行统计学分析。p<0.05被认为具有显著性差异。
2 结果与讨论
2.1 涂层的理化性能表征
图2为Fe-LDH/AZ91D的相关理化性能表征。如图2(a)所示,Fe-LDH在AZ91D表面层层交错且竖立生长,形成均匀且致密的涂层薄膜,EDS结果表明涂层主要包括Mg、Fe、C和O元素,说明Fe3+已成功引入至 LDH层间结构中。将涂层从基体刮下并进行TEM表征,可以看到Fe-LDH颗粒具有规则的正六边形片状结构,这一形状特征符合前述文献对 LDH纳米颗粒的描述[15],见图2(b)。结合DLS结果,得到涂层颗粒的平均直径约为 120 nm,分散系数(polymer dispersity index,PDI)为0.182,见图2(c)。根据XRD结果(图2(d)),2θ=5°~90°范围内镁基体衍射峰位太强,Fe-LDH 涂层的特征峰不明显,将 2θ=5°~25°范围的 XRD 图进行放大,可以看出在 11.35°(003)和21.68°(006)处有LDH结构的特征峰,说明Fe-LDH涂层具有典型的层状晶体结构,即Fe-LDH已成功覆盖在 AZ91D 表面。
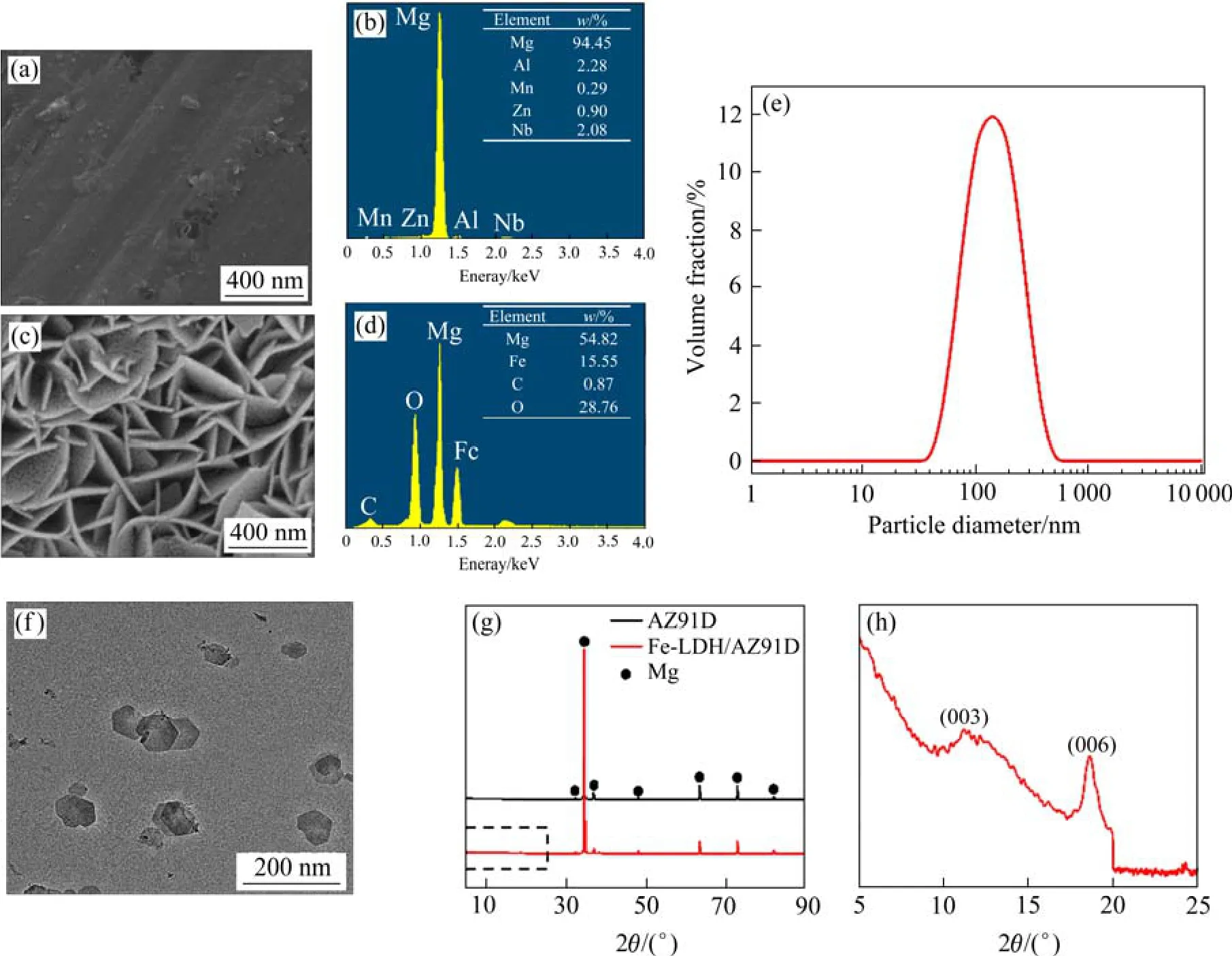
图2 涂层样品的微观结构Fig.2 Microstructure of the Fe-LDH coating sample
2.2 电化学性能
在质量分数为0.9%的NaCl溶液中,对不同样品的动电位极化曲线进行测试,通过C-view软件对结果涉及到的相关电化学参数进行拟合,见图3。结合相关文献[11],极化曲线上腐蚀电流密度越低,样品腐蚀速率越小,耐腐蚀性能越好。从图3可以看出,AZ91D的自腐蚀电位Ecorr和自腐蚀电流密度Jcorr分别为-1.504 V和6.04×10-4A/cm2;相比之下,Fe-LDH/AZ91D的Ecorr为-1.259 V,比镁基体高出0.245 V,Jcorr为 4.37×10-5A/cm2,比基板低 5.60×10-4A/cm2,充分说明经Fe-LDH涂层改性后的AZ91D耐腐蚀性能大幅度提高。使用式(3)和式(4)对两种样品腐蚀速率和缓蚀效率进行计算[16-17],结果列于表1。
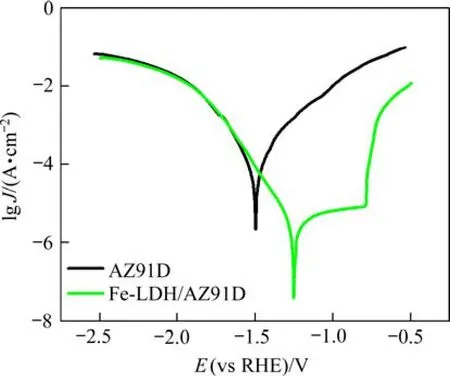
图3 不同样品在NaCl溶液(w=0.9%)中的动电位极化曲线Fig.3 Potentiodynamic polarization curves of different samples in NaCl solution (w=0.9%)

式中:vcorr为腐蚀速率,mm/a;ηp为缓蚀效率,%;J0corr和Jcorr分别为裸基板和涂层镁合金的腐蚀电流密度,A/cm2。
由表1可知,Fe-LDH/AZ91D的腐蚀速率 (9.98×10-4mm/a) 约为 AZ91D(1.38×10-2mm/a)的 7.23%,可见,Fe-LDH/AZ91D在腐蚀溶液中的腐蚀敏感度显著降低,样品的缓蚀效率ηp达到92.76%,AZ91D的耐腐蚀性能得到极大提升。

表1 不同样品的电化学参数Table 1 Electrochemical parameters of different samples
通过 EIS测量进一步研究 AZ91D和 Fe-LDH/AZ91D 在质量分数为0.9%的 NaCl 溶液中的电化学腐蚀行为,如图4所示。从图4(a)中可以看出,相比于镁合金基体,经Fe-LDH涂层改性后的AZ91D具有更大的阻抗弧半径,这说明涂层的存在使得 AZ91D具有更高的电荷转移电阻以及更强的界面钝化膜保护。结合图4(b)的Bode图可以看出,Fe-LDH/AZ91D在低频率(10-2Hz)范围内的模量较大,从负频率区到正频率区间,Bode图中的相位角也随之增加。说明致密的Fe-LDH涂层给予镁基体较好的保护作用,NaCl溶液中的腐蚀介质难以渗透到镁合金基体中,进而降低了基体的腐蚀敏感性。在 Bode图中,峰的数量反映时间常数的多少,而时间常数还与系统的电容密切相关,当体系中存在涂层或缓蚀剂时,将考虑有两个或多个时间常数存在[20]。综上所述,对各样品的等效电路图进行拟合,结果见图4(c),其中Rs表示电解质引起的溶液电阻,Rct表示溶液中电荷转移引起的电阻,CPE是由于镁合金表面不平整引起的恒定相角分量。图4(c)中,AZ91D只有一个时间常数,表明镁合金表面与 NaCl溶液直接接触,没有薄膜黏附;Fe-LDH/AZ91D的等效电路图增加了两个分量,R1代表AZ91D表面形成的Fe-LDH涂层的电阻,CPE1是指Fe-LDH薄膜的电容,Fe-LDH涂层薄膜的保护使得Fe-LDH/AZ91D的阻抗谱有两个时间常数。
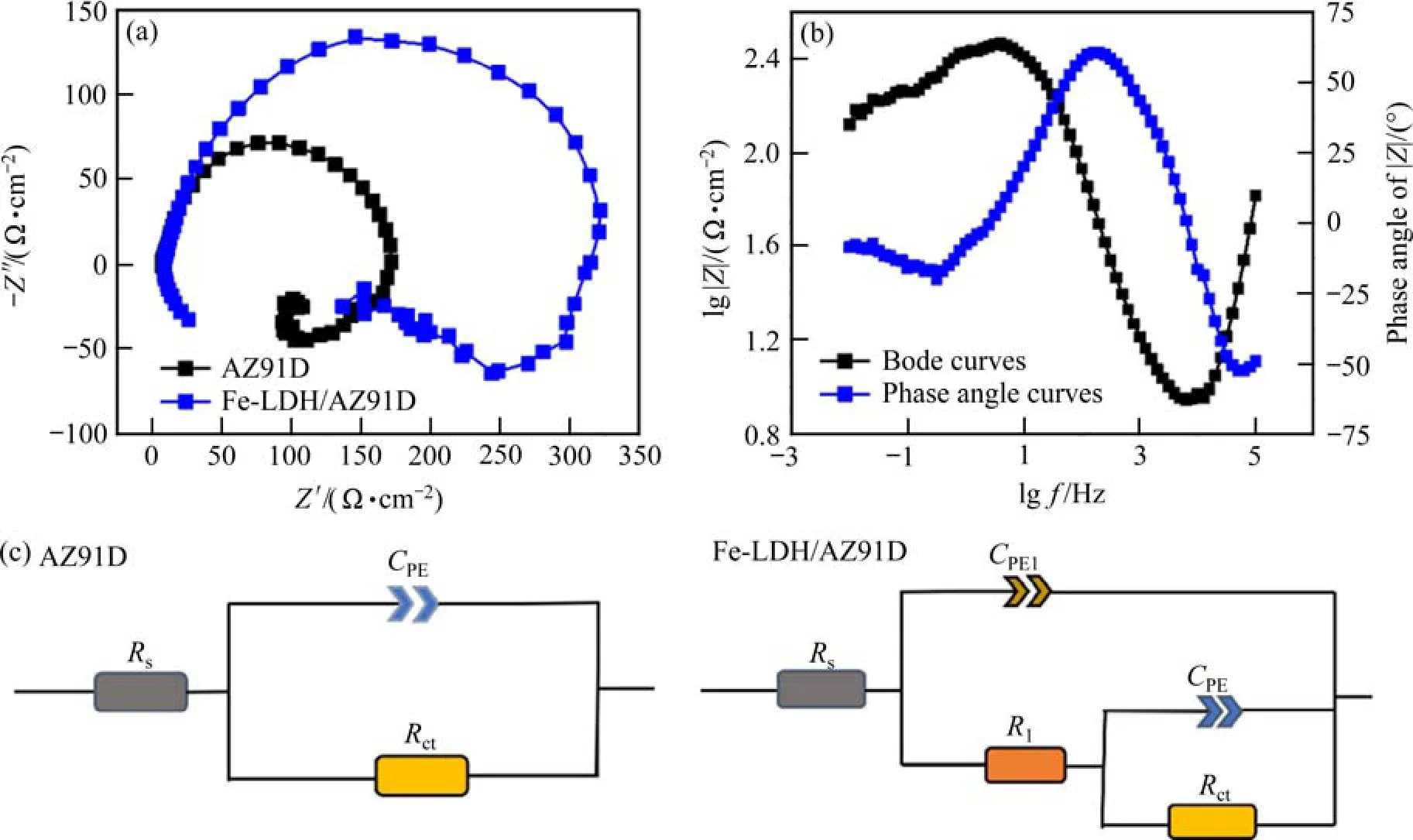
图4 室温下不同样品在NaCl溶液(w=0.9%)中的Nyquist图(a)、Fe-LDH/AZ91D的Bode图和相位图(b)、以及等效电路图(c)Fig.4 Nyquist plots of different samples in NaCl solution (w=0.9%) at room temperature (a), Bode plot and phase diagram of Fe-LDH/AZ91D (b), and equivalent circuit diagram (c)
2.3 涂层体外降解性能
图5是不同样品在PBS中长期浸泡的降解行为,每24 h记录一次释放的氢气量,共计14天。
由图5(a)可知,浸泡初期,AZ91D迅速降解,析氢量迅速上升,14天后的析氢量达到3.48 mL/cm2;而Fe-LDH/AZ91D的析氢量虽随着浸泡时间的增加而增加,但均低于1.5 mL/cm2,浸泡14天后最终的析氢量约为1.32 mL/cm2,仅为AZ91D析氢总量的38%。在析氢过程中,镁合金会发生如下电化学腐蚀反应[21-22]:
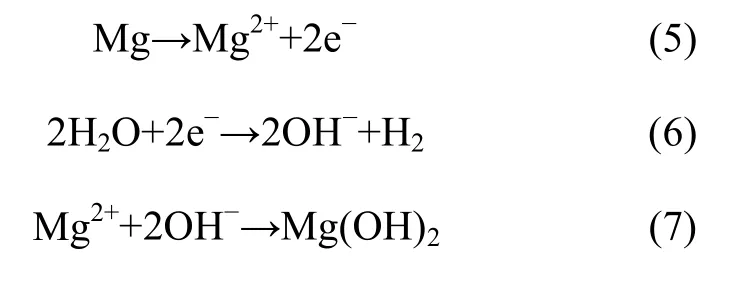
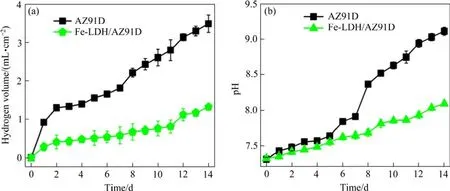
图5 AZ91D和Fe-LDH/AZ91D在PBS溶液中14天内析氢含量(a)及pH值的变化(b)Fig.5 Changes of hydrogen evolution content (a) and pH value (b) of AZ91D and Fe-LDH/AZ91D in PBS solution within 14 days
AZ91D与腐蚀溶液接触后发生电离,Mg原子失去电子变成 Mg2+,水分子得到电子生成 OH-,Mg2+与之反应生成腐蚀产物 Mg(OH)2,导致浸泡初期 pH值便迅速上升;而Mg(OH)2在含有Cl-的溶液中会进一步分解[23],如式(8):
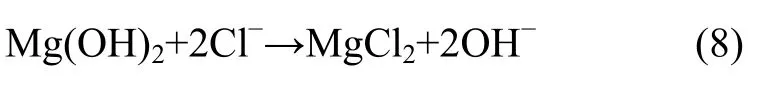
根据式(8),溶液的pH值持续升高,经监测,两者的pH值随浸泡时间的延长而上升,AZ91D浸泡14天后的pH高达9.11,Fe-LDH/AZ91D浸泡14天后的pH值达到8.09。经Fe-LDH涂层修饰后涂层阻隔了镁合金与腐蚀溶液的接触,AZ1D的pH虽有增加但较镁基体增长幅度小。
根据式(1)和(2),计算得到样品质量损失率及腐蚀速率变化柱状图,如图6所示。由图6(a)可以看出,随着浸泡时间的增加,AZ91D和Fe-LDH/AZ91D的质量损失率随之增加,14天后 AZ91D的质量损失率(40.59%)几乎是Fe-LDH/AZ91D(25.16%)的1.6倍。两者的腐蚀速率都呈现出前期缓慢后期增快的趋势,见图6(b);相比之下,Fe-LDH/AZ91D的腐蚀速率较AZ91D的慢很多,14天时的腐蚀速率(2.13 mm/a)约为AZ91D(4.14 mm/a)的 1/2。
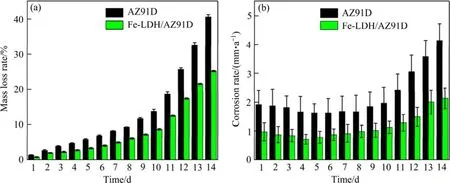
图6 不同样品的质量损失率(a)和腐蚀速率变化曲线(b)Fig.6 Mass loss rate (a) and corrosion rate change (b) of different samples
图7为各样品浸泡14天后的表面SEM形貌。可以看出 AZ91D被完全腐蚀,表面出现剥落和大量较宽的裂纹和腐蚀坑;而Fe-LDH/AZ91D表面出现微裂纹,涂层存在降解,可见,腐蚀过程仍滞留在涂层表面,对镁基体还未造成影响。

图7 PBS中浸泡14天后不同样品的表面形貌Fig.7 SEM morphologies of different samples after immersion in PBS for 14 days
基于上述结果,提出一种Fe-LDH/AZ91D的耐腐蚀机理:由于 LDH结构的层间金属离子层对腐蚀液中阴离子有着不同的亲和性,与腐蚀液接触后,腐蚀性阴离子与 LDH层间阴离子进行交换,而层间的阴离子被释放出来与镁合金中的Mg2+发生电化学反应,形成致密而稳定的沉积物以保护基体。同时,形成的沉淀物还填补了腐蚀造成的缺陷部位,以降低镁基体进一步腐蚀。Fe-LDH涂层对不同阴离子具有不同的离子交换能力[24]: C O23-> S O24->OH->F-> HPO24->Cl-> B (OH)-4>>NO-3>>ClO-4,这意味着 NaCl溶液中的 Cl-可以与 Fe-LDH 涂层之间的 OH-交换,降低Fe-LDH/AZ91D周围的 Cl-浓度。同时,OH-与 Mg2+反应生成Mg(OH)2,沉积在镁合金表面以减缓腐蚀。此外,Fe-LDH涂层体系为镁基体与腐蚀液的直接接触建立了屏障,对基体形成较为长期的耐腐蚀保护,有效降低了镁合金被腐蚀的速率。结合相关文献[25],当溶液中Cl-浓度过高时,Mg(OH)2易被Cl-侵蚀生成可溶性Mg2+,使涂层失效。因此,无论采用何种改性方法,都不可能实现对镁合金的永久保护,只能降低被腐蚀的速率。
2.4 SaOS-2细胞活性
为考察Fe-LDH/AZ91D体系的生物相容性,对不同 SM 浸提液体积分数(30%、60%、90%)下 SaOS-2细胞的活性进行比较,结果如图8所示。可以看出,各组中细胞的数量均随着培养时间的延长而增加。与空白组样品相比,不同体积分数浸提液下 AZ91D和Fe-LDH/AZ91D组别的细胞活性均较低,其中,90%体积分数下的细胞数量较少,但细胞的存活率均不低于85%,对细胞毒性较小。
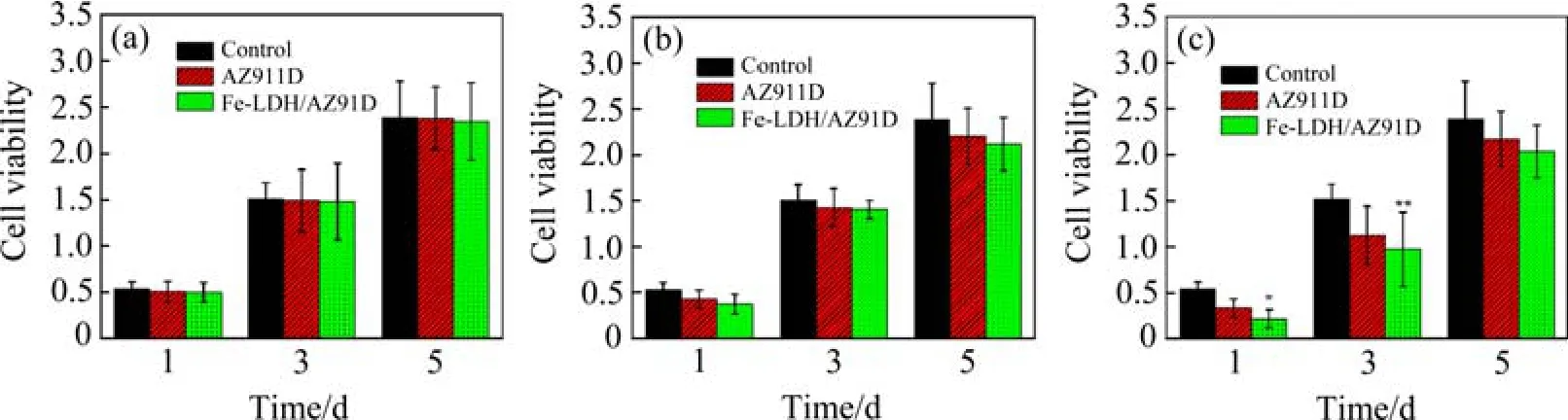
图8 不同体积分数浸提液下SaOS-2细胞活性(*p<0.05、**p<0.01分别代表与Control组相比)Fig.8 Cell viability of SaOS-2 in SM extract with different volume fractions(*p< 0.05 and **p< 0.01 compared with Control group)
2.5 SaOS-2细胞的成骨分化行为
为探究Fe3+的成骨性能,通过构建浸提液-成骨细胞共培养模型,检测不同浸提液培养基下 SaOS-2 细胞的 ALP 活性、胶原蛋白分泌和体外矿化在前、中、后期的成骨性能指标,结果见图9。
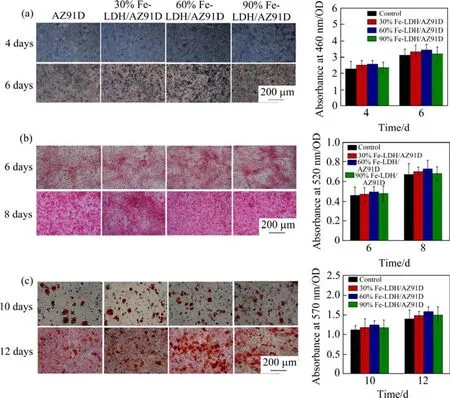
图9 不同体积分数SM浸提液下SaOS-2细胞的ALP活性(a),胶原蛋白分泌(b)和体外矿化作用(c) (*p<0.05、**p<0.01分别代表与AZ91D相比)Fig.9 ALP activity (a), collagen secretion (b) and in-vitro mineralization (c) of SaOS-2 cells in SM leaching solution with different volume fractions (*p< 0.05 and **p< 0.01 compared with AZ91D)
如图9所示,与空白组样品相比,不同体积分数浸提液SM中的SaOS-2细胞的形态饱满,呈长梭状生长,钙结节形成较为完全,有诱导细胞向深层矿化、分化的行为,略具促成骨作用,但未表现出显著差异,说明浸提液 SM 体积分数对细胞成骨活性无显著影响,各浸提液体积分数下较好地维持了细胞的成骨活性,并达到与空白组样品同样的水平。
3 结论
1) 通过水热法在x(Mg2+):x(Fe3+)=2:1、pH=10.0、T=100 ℃ 条件下于AZ91D表面成功制备均匀致密,具有六边形片状结构,平均粒径约为 120 nm的Fe-LDH涂层,获得Fe-LDH/AZ91D样品。
2) 涂层的存在隔绝了镁基体与腐蚀液的接触,缓解了镁基体的腐蚀速度。经 Fe-LDH涂层改性后的AZ91D具有比镁基体更高的自腐蚀电位Ecorr(-1.259 V)和更低的腐蚀电流密度icorr(4.37×10-5A/cm2),缓蚀率高达92.76%;在PBS浸泡14天后,Fe-LDH/AZ91D的腐蚀速率(2.13 mm/a)仅为 AZ91D(4.14 mm/a)的一半。
3) 不同体积分数浸提液SM对SaOS-2细胞毒性小,能较好地维持细胞的成骨活性,并达到与空白组样品相同的水平。
