真菌多糖及其在乳酸菌产品中的应用研究进展
2022-11-16杨扬
杨 扬
(乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司乳业研究院,上海 200436)
食用真菌属高等真菌子实体,富含蛋白质、维生素、膳食纤维、矿物质等营养成分,兼具营养价值和药用价值,有着“素中之荤”的美誉。早在东汉时期,我国史书便有关于食用真菌的记载[1],为人们熟知的有灵芝、冬虫夏草、猴头菇等。多糖是食用真菌中重要的活性物质,主要存在于食用真菌的子实体、菌丝体和发酵液中。随着研究的不断深入,发现真菌多糖具有调节人体免疫力、抗肿瘤、抗氧化、保肝、抗辐射、抗疲劳、保护人心脑血管等功效[2],广受研究者的关注和消费者的喜爱。市场上已有许多真菌多糖类食品和保健品,如猴头菇多糖固体饮料、灵芝多糖片、云芝多糖肽胶囊等。
1 真菌多糖概述
真菌多糖是从真菌子实体、菌丝体及发酵液中分离得到的一类活性物质,一般由10 个以上单糖通过糖苷键连接而成[3]。常见的真菌多糖有香菇多糖、金针菇多糖、姬松茸多糖、银耳多糖、木耳多糖、灵芝多糖、云芝多糖、虫草多糖、茯苓多糖和灰树花多糖等。研究发现,真菌多糖具有抗肿瘤、抗病毒、抗衰老、抗疲劳、抗氧化、降血糖、降血脂和提高免疫力等多种生物活性和保健功能,这与其复杂的螺旋立体构型密切相关。在国际上,真菌多糖受到广泛关注,已成为近年来研究热点,被称为“生物反应调节剂”[4]。近年来,真菌多糖已成为生命科学、医药科学、食品科学等领域研究的热点,如表1所示。
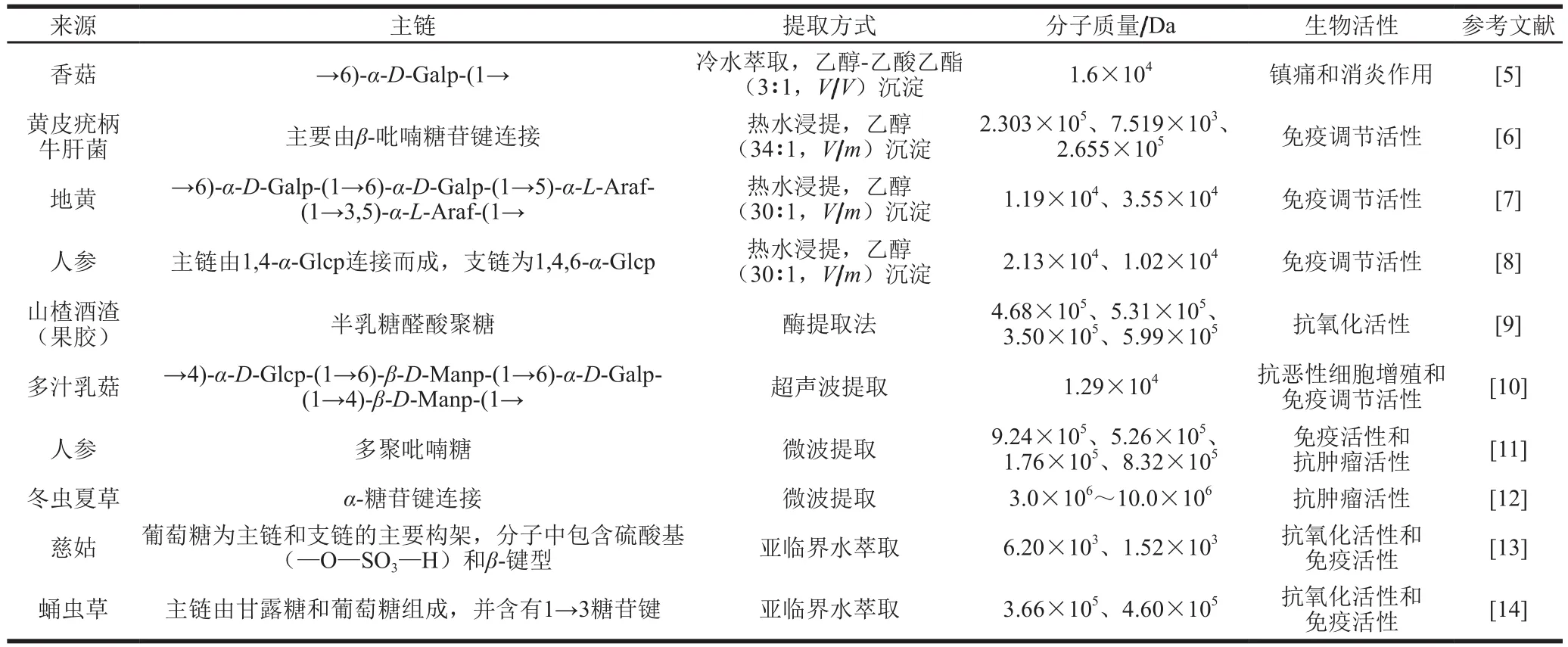
表1 真菌多糖研究进展Table 1 Research progress on fungal polysaccharides
1.1 真菌多糖化学组成和结构
1.1.1 真菌多糖的化学组成
真菌多糖基本组成单位为糖或糖醛酸,主要包括葡萄糖、岩藻糖、甘露糖、鼠李糖、半乳糖、木糖、阿拉伯糖和葡萄糖醛酸等。闫晶敏[15]从杏鲍菇、平菇、金针菇、白玉菇、蜜环菌、茶树菇、猴头菇、红松伞、亚侧耳、鸡油菌10 种食用真菌子实体中提取水溶性总多糖,经分离纯化主要得到半乳聚糖和葡聚糖2 类多糖,其中半乳聚糖的单糖组成以半乳糖为主,并存在不同含量甘露糖、岩藻糖和葡萄糖,杏鲍菇、平菇、亚侧耳和鸡油菌中还存在少量甲基半乳糖,红松伞中存在少量甲基岩藻糖;葡聚糖的单糖组成以葡萄糖为主,存在少量葡萄糖醛酸。
1.1.2 真菌多糖的分子结构
真菌多糖的分子结构分为一级结构、二级结构、三级结构和四级结构,其中二级、三级和四级结构统称为高级结构,是多糖发挥生物学活性的重要结构。真菌多糖一级结构是最基本的结构,以葡聚糖、甘露聚糖等单糖为基本组成单位,通过α-或β-糖苷键连接而成。影响一级结构的因素包括糖苷键类型、连接顺序、异头碳类型等;二级结构是多糖主链通过氢键的方式连接,使多糖一级结构形成一定的空间构型[16];三级结构为多糖在二级结构的基础上进一步卷曲、折叠,以非共价键方式使多糖残基中的羟基、氨基、羧基及其他基团之间形成有序的空间构型;四级结构是指多糖多聚链间通过非共价键结合而形成的聚合体。
1.1.3 真菌多糖的构效关系
1.1.3.1 分子质量
研究发现,真菌多糖具有不同的分子质量,其生理活性也有所不同,这可能与真菌多糖分子的高级结构有关。真菌多糖发挥其生理活性,需要其分子质量在一定范围内,例如,香菇多糖在分子质量5.0×105~1.5×106Da的范围内才可发挥其抗癌生理活性,尤其在分子质量1.49×106Da时,可杀死近半数的癌细胞[17]。龚敏等[18]从冬虫夏草分离出的分子质量1.6×104Da的多糖能促进小鼠腹腔巨噬细胞吞噬功能,而分子质量1.2×104Da的多糖对巨噬细胞无显著促进作用。经临床病例发现,多糖分子在分子质量105Da数量级时生物活性一般较高[19]。
1.1.3.2 主链连接方式
Mantovani等[20]发现,多糖主链D-葡聚糖以β-1,3-糖苷键为主连接时,其具有抗癌活性,例如,已被用作免疫药理制剂的香菇多糖和裂褶菌多糖就是以β-1,3-糖苷键为主连接的多糖。姜瑞芝等[21]从银耳中提取出3 种均一多糖TSP-2a、TSP-2b、TSP-2c,其结构都以β-1,3-糖苷键为主,3 种多糖在不同程度上促进细胞因子产生,具有显著的免疫活性。
1.1.3.3 分支度
分支度是指主链上每个糖单位具有的分支数目,不同物质发挥其生物活性的分支度都是不同的。分支度0.20~0.33的β-(1→3)-D-葡聚糖能发挥其最大的生物活性[22]。真菌多糖分支度达到2.8时生物活性最低,通过氧化还原反应将葡萄糖分支还原成羟基,使其分支度降低到1.0时,抗肿瘤率几乎翻倍[23]。
1.1.3.4 溶解性
多糖的溶解性对其生物活性的发挥也有重要影响。从茯苓菌核中提取出一种不溶于水的多糖,其基本无抗癌作用,但通过适当的处理提高其溶解性,其抗癌活性也随之表现出来[24]。多糖的水溶性是由于多糖链上存在着许多自由羟基,它们易在糖链间相互缔合,形成氢键。因此,如在水溶液中引入适宜的离子基团,以引起糖链聚合,改变其构象,最终达到改变多糖溶解性的目的。Wang Yifeng等[25]从茯苓中分离出不溶于水的β-(1→3)-D-葡聚糖未表现出抗肿瘤活性,分别对其进行硫酸化、羧甲基化、甲基化、羟乙基化及羟丙基化处理,得到3 个水溶性较好的多糖衍生物,其中硫酸化、羧甲基化多糖衍生物在水溶液中呈相对扩展的链状,链刚性较大,表现出显著的抗肿瘤活性;羟乙基化、羟丙基化多糖衍生物由于在水溶液中的聚合作用,使得多糖相对分子质量偏高,表现出的抗肿瘤活性较低,并且这些多糖衍生物的抗肿瘤活性随着水溶性的增大而增加。
2 真菌多糖国内外研究现状
2.1 真菌多糖的提取
2.1.1 热水浸提法
真菌多糖最常用的提取方法是热水浸提法,具有工艺简单、安全性高、环境污染小、易于推广等优点。热水浸提法一般是在50~100 ℃条件下浸提1.5~5.0 h,通常随着提取温度的升高,提取率也随之升高。但当温度高于150 ℃,提取15 min后,多糖的三螺旋结构将受到严重破坏[26]。热水浸提法中影响多糖提取率的因素除提取温度外,还包括料液比(m/V)、浸提时间等。贾薇等[27]通过来自姬松茸菌丝体中粗多糖提取工艺研究,得出其提取的最佳料液比1∶30、浸提时间2 h。戈延茹等[28]对桑黄多糖的提取进行研究,得出其最佳料液比1∶14、浸提时间3 h。Ma Fengwei等[29]通过热水浸提法提取出一种水溶性酸性多糖,料液比为1∶10,反复浸提3 次,每次间隔1 h,共3 h,提取温度为100 ℃。黄皮疣柄牛肝菌多糖的提取同样采用热水浸提法,提取温度不高,为51 ℃,提取时间为3.1 h,料液比为34∶1[30]。
2.1.2 酸碱提取法
酸碱提取法通常在热水浸提法之后应用,更能充分提取真菌中的多糖[31]。酸碱提取法通常使用HCl、草酸铵等酸和NaOH、KOH等碱用于多糖的提取。在酸和碱的作用下,真菌细胞壁被破坏,粗纤维结构和细胞壁蛋白质与葡聚糖之间的连接被降解,多糖被释放,将不溶于水的组分转化为溶于水的组分[32-33]。但该方法有处理时长的限制。王艺涵等[34]对比酸提取法和碱提取法对银耳多糖特性的影响,取30 g银耳粉,酸提取法条件为pH 2的柠檬酸溶液2 400 g、提取温度95 ℃、提取时间100 min;碱提取法选用pH 9的氢氧化钠溶液2 400 g、提取温度95 ℃、提取时间4 h。结果表明,酸提取法获得银耳多糖的水分和多糖含量高于碱提取多糖,但碱提取多糖的相对分子质量更高。
2.1.3 酶提取法
酶辅助提取法通过酶降解纤维素、果胶、蛋白质和其他分子之间的连接,破坏真菌细胞壁,能有效释放细胞内多糖。常用于真菌多糖提取的酶包括纤维素酶、木瓜蛋白酶、果胶酶和胰蛋白酶等[35]。酶辅助提取法具有操作简单、特异性强、环境温和、效率高等优点[36],但该方法成本高[37]、易受多种因素影响,如酶的种类、浓度、温度、pH值、反应时间、固液比等。张岚[38]对比热水浸提法和复合酶提取法提取干巴菌多糖的提取率,复合酶选用木瓜蛋白酶和纤维素酶,在复合酶质量浓度为0.47 g/100 mL、酶解64 min、料液比1∶40条件下,干巴菌多糖提取率可达17.55%,远高于热水浸提法提取率(8.18%)。另外,有研究[34]对比酸碱提取法和酶提取法对多糖理化特性的影响,结果表明,酶提取法获得的银耳多糖的乳化性、吸湿性和保湿型均优于酸碱提取法获得的多糖。
2.1.4 微波辅助提取法和超声辅助提取法
除以上的传统提取方法外,微波辅助提取法和超声辅助提取法也常常应用于多糖提取中。微波辅助提取法通过微波的产热能效应破坏细胞壁,使多糖释放[39]。超声波是通过利用溶剂中声空化的形成和非对称微气泡的崩塌所产生的空化效应,借助该过程释放的大量能量而产生的微射流、冲击波和高剪切力破坏细胞壁,增强渗透和毛细管效应,促进不互溶相之间的传质,以提高提取率[40]。杨景峰等[41]提出采用微波和超声波联用提取的方法提取真菌多糖,并认为该提取方法具有提取率高、溶剂用量少、节约能源、节约成本等优点。朱佳琳等[42]采用微波提取法,从无花果树叶中提取多糖类物质,在液料比30 mL/g、微波功率300 W、微波提取时间3 min时,多糖提取率可达11.32%,粗多糖纯度可达56.4%。赵晶丽[43]通过微波提取法获得的人参多糖提取率可达42.4%,提取条件为液料比30 mL/g、微波功率550 W、微波提取时间6 min、提取温度70 ℃。
2.1.5 亚临界水萃取法
在足够的压力(1.0~22.1 MPa)下,水处在超过沸点(100~374 ℃)的状态,此时的水称为亚临界水。亚临界水与室温常压水表现出不同的性质。随着温度升高,亚临界水极性降低,非极性增加。利用这一性质通过控制处理温度实现不同极性多糖的提取。但在130 ℃临界点上热降解会使得多糖分子减小,压力和温度超过临界点时,多糖的链构象和结构易受影响,从而多糖的生物活性也会受影响[26]。陈婧等[44]总结通过亚临界水萃取法分别从平菇、香菇、金针菇、灵芝、银耳、黑木耳和虫草共7 种真菌中提取多糖的得率,分别为13.56%、15.70%、5.21%、2.15%、34.58%、24.51%和7.13%,均高于传统热水浸提法的提取率。张继贤[45]研究发现,亚临界水萃取法的提取温度对香菇多糖的化学结构、链构象转变和生物活性均有影响。在亚临界水温度为100~160 ℃时,获得的香菇多糖均为β型葡聚糖,不含α型葡聚糖,并且随着亚临界水萃取温度的升高,多糖分子质量逐渐下降;在亚临界水温度为100~150 ℃时,获得的香菇多糖具有典型的三螺旋结构链构象,而160 ℃时不再具有三螺旋结构;在亚临界水温度为100~130 ℃时,获得的香菇多糖具有更强的体外抗氧化活性,对细胞氧化损伤具有显著的预防作用;在亚临界水温度为120~140 ℃时,获得的香菇多糖具有更强的体外免疫调节活性,能有效促进巨噬细胞的增殖、提高其吞噬能力、促进细胞因子分泌;在亚临界水温度为120~130 ℃时,获得的香菇多糖具有较好的抑制人肝癌细胞和人乳腺癌细胞增殖的作用。
2.2 真菌多糖的分离纯化
经初步提取得到真菌粗多糖,想要得到均一多糖,需要进一步的分离纯化。真菌粗多糖中一般含有蛋白质、色素、无机盐等杂质,需经过脱除蛋白质和去除色素处理。脱除蛋白质的方法包括Sevag法、三氯乙酸法、酶解法等,其中Sevag法应用最为广泛。Sevag法采用氯仿和正丁醇按体积比4∶1混合,制成Sevag试剂。在有机试剂作用下,将游离蛋白质转变为不溶性物质,经离心去除蛋白质。该方法较为温和,对多糖结构影响小,但效率较低,需反复操作多次[46]。三氯乙酸法是采用加入3 g/100 mL三氯乙酸溶液使蛋白质变性沉淀,达到去除蛋白质的目的,重复数次,可除尽蛋白质[47]。酶解法主要通过蛋白酶去除与多糖结合在一起的蛋白质,该方法专一性更强、更加温和。去除色素、小分子类等杂质,主要通过透析法、超速离心法或不同滤膜超滤。
将除杂后的多糖进一步分离成均一多糖,通常采用柱层析法。柱层析法主要分为离子交换柱层析和凝胶柱层析。离子交换柱层析是通过电荷间的相互作用,使带电的分子吸附在离子交换层析介质中,从而达到分离纯化的目的。该方法具有分辨率高、适用范围广、工作容量大、易于操作等优点。凝胶柱层析主要依据分子大小进行分离纯化。当不同分子大小的样品进入凝胶层析柱内部时,比凝胶颗粒孔穴孔径大的分子被排阻在孔外,只能从凝胶颗粒外部空间流动,而比凝胶颗粒孔穴孔径小的分子则从凝胶颗粒内部通过,流程短且流动速度快,最先流出。经过凝胶柱层析后,样品便按照分子从小到大依次流出,从而达到分离纯化的目的。该方法具有设备简单、操作方便、对分子生物活性无影响等优点。
2.3 真菌多糖的生物活性
2.3.1 抗肿瘤活性
目前,癌症来源于恶性肿瘤,其发病率和死亡率均很高,已成为全球无法解决的致命疾病之一,是世界范围内重大公共卫生挑战[48]。真菌多糖的抗肿瘤方式主要有2 种:一种为直接作用于肿瘤细胞产生细胞毒性;另一种是通过免疫系统抑制肿瘤细胞生长的调节免疫功能。Rosendahl等[49]研究发现,云芝多糖通过促进细胞周期调控因子p21(WAF)/(CiP1)和促凋亡蛋白Bax的表达,使得肿瘤细胞生长周期阻滞,诱导肿瘤细胞凋亡。花脸香菇多糖能使肿瘤细胞停留在G2/M期,通过提高Bax/Bcl-2和Caspase-3、Caspase-9表达抑制肿瘤生长[50]。
近年来,关于真菌多糖与肠道菌群的研究不断增多,研究人员提出了“多糖-肠道菌群”这一多糖发挥抗肿瘤活性的机制。研究表明,肠道菌群的失调可能是癌症发生和发展的可能机制之一[51]。肠道菌群中致病菌丰度增加会导致局部发炎、DNA受损和全身免疫紊乱等。因此,通过真菌多糖干预肠道菌群,使能促进健康的细菌和代谢物维持在稳定水平,帮助身体预防或改善较差的“癌症易感性状态”,这可能是一种潜在且有效的抗肿瘤策略。
研究表明,当多糖摄入不足时,肠道菌群失调无法被改善,导致糖酵解菌丰度降低,黏液降解菌和致病菌丰度相对增加。由肠道菌群失调引起的黏液层变薄、局部炎症和DNA损伤会导致“漏肠”,增加病原体易感性。另外,有毒代谢物的累积进一步破坏肠道屏障,影响营养物质的吸收和代谢,加剧机体的免疫-炎症紊乱,最终导致机体进入癌症高发状态。当多糖摄入充足时,糖酵解菌丰度升高,形成一层生物屏障,加强肠道的防御力。另外,多糖被消化时产生的代谢物(主要是短链脂肪酸)也有益于肠道健康[52-53]。
2.3.2 抗氧化活性
真菌多糖表面存在许多抗氧化活性基团,能够与自由基反应,提高抗氧化酶活性、抑制脂质过氧化活性,起到保护生物膜和延缓衰老的作用。目前对多糖的抗氧化活性研究常采用体外或体内模型,通过检测超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等抗氧化酶的活性,以及丙二醛、过氧化脂质等氧化反应产物的含量,计算自由基清除率,衡量多糖抗氧化活性。Yeung等[54]通过大鼠实验发现,云芝多糖能显著增强谷胱甘肽过氧化物酶的活性。云芝多糖通过降低大鼠肝内还原性谷胱甘肽含量,使得氧化型谷胱甘肽含量升高,最终使得谷胱甘肽过氧化物酶活性增加。目前对于真菌多糖抗氧化机理的研究还在不断进行,其作用机理还处在研究阶段。杨立红等[55]通过化学比色法测定黄伞菌丝体多糖的抗氧化活性,结果表明,黄伞菌丝体多糖在一定范围内的不同纯度均具有抗氧化能力,能清除超氧阴离子自由基和羟自由基,抑制丙二醛的生成,而且呈现一定量效关系。
2.3.3 降血糖活性
真菌多糖可以通过多种途径发挥降血糖功效。肠黏膜上的巨噬细胞通过β-葡聚糖受体与β-葡聚糖结合[56-57]被激活,转移回到淋巴结,释放细胞因子,使免疫激活。β-葡聚糖还能阻止食物中的胆固醇在消化道的吸收,从而降低血清胆固醇水平。另外,真菌多糖还能够降低β-细胞氧化应激、抑制胰岛细胞再生、增加葡萄糖消耗和糖原生物合成,发挥降血糖活性[58]。
真菌多糖的降血糖活性已通过一系列动物实验验证。Kiho等[59]发现,银耳多糖能显著提高糖尿病小鼠肝脏中葡萄糖激酶、己糖激酶和葡萄糖-6-磷酸脱氢酶活性,降低葡萄糖-6-磷酸酶活性,从而降低小鼠肝脏中糖原含量,达到降血糖的作用。在分子遗传水平上控制血糖的机制研究中,欧阳玉倩[60]研究发现,巴氏蘑菇多糖能够通过调节血糖指数和体内胰岛素平衡、调控肌肉和脂肪中葡萄糖运载体4、磷脂酰肌醇激酶、蛋白激酶1和蛋白激酶2的mRNA表达量,从而缓解糖尿病症状。
真菌多糖通过免疫反应发挥降血糖活性。一项相关研究[61]报道,从灰树花子实体中提取的α-葡聚糖(100、300 mg/kg)对高脂饮食小鼠的降血糖活性与改善(或干预)免疫功能和降低破坏β-胰岛细胞的因子水平有关;实质上,这种灰树花多糖降低了引起免疫紊乱的效应物水平,包括巨噬细胞产生的甘油三酯、胆固醇、游离脂肪酸和一氧化氮;灰树花多糖还能提高血清胰岛素水平,有利于脾细胞分泌在免疫应答中起关键作用的免疫细胞因子,并改善β-胰岛细胞的超微结构,这可能与灰树花多糖促进参与糖尿病发病机制的免疫反应有关。
2.3.4 免疫调节活性
真菌多糖关键生物活性之一是免疫调节活性[62]。免疫细胞主要包括T细胞、B细胞、先天淋巴细胞和单核吞噬细胞系统(如单核细胞、树突状细胞和巨噬细胞)。T细胞根据其表面表达的分子分为两大类,即CD4+T细胞和CD8+T细胞。CD4+T细胞可以辅助和控制其他免疫细胞的活动,而CD8+T细胞主要杀死感染或突变的细胞。CD4+T细胞在遇到特异性识别的抗原后转变为CD4+效应T细胞亚群,这些CD4+效应T细胞亚群包括辅助型T细胞1(helper T cell 1,Th1)、Th2、Th17和调节性T细胞(regulatory T cell,Treg),这些细胞可以表达不同的转录因子,并特异性分泌各种细胞因子。B细胞主要分泌免疫球蛋白,参与中和入侵的病原体。巨噬细胞受微环境分子刺激,进一步转化为M1(经典激活)表型和M2(交替激活)表型[63]。激活的M1型巨噬细胞可产生促炎细胞因子,而M2型巨噬细胞主要产生抗炎细胞因子白细胞介素10(interleukin 10,IL-10)。先天性淋巴细胞(innate lymphocytes,ILCs)根据其表达的转录因子和产生的细胞因子可分为3 个主要亚群,包括ILC1、ILC2和ILC3[64-65]。
真菌多糖已被证明具有免疫调节活性,包括免疫增强和免疫抑制作用[66]。真菌多糖的免疫增强作用可改善免疫反应以抵御病原体,而真菌多糖的免疫抑制作用可抑制过度的免疫反应,以抑制过敏或炎症反应。香菇多糖可通过诱导RAW264.7细胞中肿瘤坏死因子-α和IL-6 2 种细胞因子表达的上调来发挥免疫调节作用[67]。Perera等[68]发现,黑木耳多糖通过关键受体Toll样受体4激活巨噬细胞,使巨噬细胞分泌促炎细胞因子。黑木耳多糖的分子模型数据和化学修饰表明,黑木耳多糖的羧基和乙酰基与Toll样受体4结合,在发挥体外免疫刺激活性方面同样重要。体内实验证明了多糖的免疫增强活性。猴头菌多糖能通过增强吞噬细胞的吞噬能力、自然杀伤细胞活性、分泌型免疫球蛋白A以及激活MAPK信号通路和Akt信号通路来提高小鼠的细胞和体液免疫能力[69]。
同时,对真菌多糖的增强记忆力[70]、防辐射[71]、保护肝脏[72-73]以及促进器官和胎儿发育[73-74]的研究也在不断进行中。
3 真菌多糖在乳酸菌产品中的应用
3.1 乳酸菌产品
乳酸菌是微生物家族重要成员之一,被应用到许多食品生产中。乳酸菌相关产品种类繁多,包括酸乳、干酪、乳酸菌饮料、香肠、火腿、泡菜及酸菜等。例如,干酪以鲜牛乳为原料,经乳酸菌发酵、凝乳、排乳清,最终制成富含蛋白质、脂肪和多种微量元素的干酪,有“乳品之王”的美誉[75]。
乳酸菌饮料是指乳酸菌以饮料中糖类为能量来源,经过发酵产生乳酸、醋酸等有机酸,使饮料风味更加柔和。乳酸菌发酵过程中产生的醇、醛等物质与有机酸相互作用,形成新风味成分。除此之外,乳酸菌的添加也能增加饮料中的营养素。将双歧杆菌添加到苹果、胡萝卜和柑橘混合果汁中,经发酵后混合果汁中VC和β-胡萝卜素的含量增加[76]。VC具有抑制氧自由基产生、调节炎症因子产生、改善微炎症状态等作用[77]。β-胡萝卜素具有补充VA、抗氧化、增强免疫力等作用[78]。
乳酸菌也常应用于果蔬制品发酵中,如泡菜、酸菜等。乳酸菌参与泡菜发酵并产生乳酸、醋酸、丙酸等有机酸,赋予泡菜酸味;产生的庚酮、壬酮可增加泡菜爽口、清香的口感;产生的双乙酰赋予泡菜奶油香气,这些代谢产物使泡菜风味更加美味、可口[79]。人们也将乳酸菌作为腌制剂,添加到香肠、火腿等发酵肉制品中,以改善肉制品的口感、抑制腐败菌生长、延长货架期等[80]。乳酸菌也能起到软化和酸化啤酒中麦芽的作用,使啤酒口感更加柔和,具有杀口感[81]。将乳酸菌添加到葡萄酒中,能降低葡萄酒的酸涩和粗糙感,果香和酒香更加浓郁[82]。
3.2 真菌多糖与乳酸菌发酵产品
将真菌多糖与乳酸菌结合,研制新型功能性乳酸菌发酵产品,不仅具有普通乳酸菌发酵产品的风味,而且结合了二者特有的调节健康功能特性,打破了传统乳酸菌发酵产品壁垒,拓宽乳酸菌发酵产品多样性。
目前,许多研究人员研制了添加真菌多糖的乳酸菌发酵产品。张岩等[83]研制松茸多糖酸乳,松茸多糖不仅促进乳酸菌的生长,而且改善酸乳的质地、黏度、色泽和口感,提高了酸乳的品质。同样地,李海平等[84]研制滑菇多糖酸乳,比较1.2%、1.6%和2.4%滑菇多糖添加量下酸乳的品质,最终得到稳定性好、口感良好的滑菇多糖酸乳。徐艳玲[85]将杏鲍菇多糖添加到酸乳中,在杏鲍菇多糖质量浓度0.12 g/100 mL、发酵时间5.5 h、白砂糖添加量7%的条件下,酸乳活菌数达到最高,拥有良好的持水性、硬度和胶黏性;另外,杏鲍菇多糖酸乳在21 d贮藏期内风味与常规酸乳无显著差异。除此之外,还有研究将多糖添加到合生元酸乳中。除此之外,崔利敏等[86]将菊粉添加到益生菌酸乳中,不仅能加速酸乳的发酵速率、显著增加料液黏度及膨胀率(P<0.05),而且能改善酸乳的细腻度、顺滑度及冰感。
除了研制发酵乳制品外,也有研究人员研制添加食用真菌的乳酸菌发酵饮料,该乳酸菌发酵饮料以双孢菇为主要原料,通过对菌种进行筛选和梯度驯化,以复合乳酸菌(嗜酸乳杆菌∶植物乳杆菌=1∶1)发酵双孢菇发酵液的方式,研制出具有独特风味的双孢菇乳酸饮料,该饮料保持了双孢菇的营养和功能成分,是老少咸宜的保健饮料[87]。另外,吴琼等[88]以人参多糖和发酵乳为原料,研制人参多糖发酵乳饮料,结果显示,当发酵乳添加量40%、人参多糖添加量16%、白砂糖添加量5%、柠檬酸添加量0.05%、羧甲基纤维素钠添加量0.2%时,发酵乳饮料稠度为194.31 g·s,黏度为5.67 g,组织状态良好,质地细腻,乳香味与人参苦味和谐。
4 结 语
真菌多糖具有多种生物活性,有益于人类健康。在过去的几十年里,大量的真菌多糖作为药用化合物和治疗佐剂或保健食品补充剂。采用热水浸提法、酸碱提取法、微波辅助提取法、超声辅助提取法、亚临界水萃取法等方法从真菌中提取粗多糖,通过Sevag法、三氯乙酸法、酶解法、透析法、柱层析法等对粗多糖进一步分离纯化,得到多个较为纯净的多糖组分。近年来,关于多糖生物活性及机制的相关研究逐年增加,研究多集中在真菌多糖的抗肿瘤活性、抗氧化活性、降血糖活性和免疫调节活性及其机制探究。另外,关于真菌多糖的其他生物活性也在不断探索,如增强记忆力、防辐射、保护肝脏、促进胎儿发育等。目前,人们摄取真菌多糖的主要方式是从日常食用的蘑菇中获得,如果能将真菌多糖添加到其他食品中,不仅为食品增加了风味,而且也能发挥维护人体健康的作用。乳酸菌产品是一种消费群体广泛的食品,并且其中的乳酸菌也能促进机体健康,如果能将真菌多糖与其结合,也能为真菌多糖实现工业化生产提供方向。