1-甲基萘加氢饱和反应热力学平衡分析及实验研究
2022-11-16葛泮珠王丽新刘清河习远兵
张 锐, 葛泮珠, 任 亮, 王丽新, 刘清河, 习远兵, 聂 红
(中国石化 石油化工科学研究院,北京 100083)
占到中国柴油池三分之一的催化裂化轻循环油(LCO)是催化裂化生成油中453~643 K的馏分,其硫、氮含量高,特别是其中的芳烃质量分数高达60%以上,并以双环芳烃为主,占到总芳烃含量的70%以上。LCO既使采用高苛刻条件的加氢精制过程也难以直接满足日趋严格的清洁柴油的标准要求,将LCO中大量的多环芳烃催化转化为苯、甲苯和二甲苯(BTX),是提升LCO品质的途径之一,也是压减柴油产量的途径之一。近些年,中国化工行业对BTX的需求量激增,市场上呈现供不应求的局面。考虑到LCO中富含芳烃,将其催化转化生产BTX,可以解决中国柴油产能过剩和BTX短缺的问题,具有非常高的工业应用潜力[1]。目前工业上利用LCO生产BTX的工艺流程主要分为2部分[2-3]:首先是将LCO进行加氢处理去除油品中的硫、氮杂质,并将多环芳烃选择性加氢饱和为单环芳烃;然后再将油品进行加氢裂化或催化裂化处理,得到C6~C8中富含BTX的高辛烷值汽油组分。
由于催化裂化反应很难将多环芳烃进行开环,因此需要首先将多环芳烃进行部分加氢饱和,再将生成四氢萘类的单环芳烃在分子筛催化剂上进行裂化生成BTX。也就是说,对于双环芳烃无论是通过加氢裂化的途径还是催化裂化的途径[4-5],都不可避免地需要对双环芳烃中其中之一的芳香环进行加氢饱和生成含有环烷环的四氢萘类单环芳烃,从而实现将环烷环开环并进行断侧链的目的。以1-甲基萘(1-MN)为含甲基的双环芳烃模型化合物来描述上述LCO催化转化生成BTX的过程,结果见图1。从图1可以看出,萘类首先加氢饱和生成四氢萘类单环芳烃,四氢萘类的单环芳烃再经过催化转化生成BTX类单环芳烃。

图1 双环芳烃催化转化为BTX的反应网络示意图Fig.1 Reaction network diagram for the catalytic conversion of bicyclic aromatic hydrocarbons to BTX
芳烃加氢是可逆、强放热、体积减小的反应[6],芳烃加氢的反应热介于63~71 kJ/mol。根据化学平衡原理,对于放热反应,反应平衡常数随反应温度的升高而降低,芳烃的平衡浓度随反应温度的升高而升高,因而较低的反应温度有利于加氢。在选择芳烃加氢饱和反应温度时,必须从动力学和热力学2方面考虑,既能有适当的反应速率,又能使芳烃达到较高的转化率。对芳烃类加氢反应的研究由来已久,并且在反应热力学、动力学及微观机理等方面都取得了一些成果[7]。但由于受实验条件、模型化合物不易获取等因素的限制,特别针对于双环芳烃定向转化为单环芳烃过程的热力学研究相对较少[8]。
以1-MN为模型化合物,通过理论计算得到其反应网络中各步反应的标准平衡常数(K),分析K随温度的变化规律,并在此基础上,通过计算讨论氢分压、反应温度和氢/烃摩尔比对单步反应体系的平衡转化率、连续反应体系的平衡浓度分布的影响;同时结合热力学平衡计算结果,以Ni-Mo/γ-Al2O3为催化剂,采用高压加氢微型反应实验装置,考察了反应温度、反应压力对l-MN加氢饱和反应路径的影响。
1 实验部分
1.1 原料、试剂和催化剂
原料和试剂:1-甲基萘(1-MN),纯度98%,美国Alfa公司产品;环己烷,化学纯,国药集团公司产品。配制1-MN质量分数为10%的环己烷溶液。
催化剂: Ni-Mo/γ-Al2O3加氢精制催化剂,由中国石化石油化工科学研究院提供,其中MoO3质量分数为23.5%,NiO质量分数为4.0%,比表面积为140 m2/g,孔体积为0.28 mL/g。
1.2 1-MN加氢饱和实验装置和分析方法
以1-MN作为模型反应物,采用固定床加氢微型反应器进行实验研究。催化剂装填量0.5 g,催化剂颗粒40~60目,氢气流量300 mL/min,温度523~653 K(250~380 ℃),H2分压3.0~5.0 MPa。正式反应前,在温度573 K、H2分压4.0 MPa下,通入CS2质量分数5%的环己烷溶液,对催化剂进行硫化反应处理4 h,硫化油进料量0.3 mL/min。硫化结束后切换成1-MN进料,进油量0.2 mL/min,连续进料反应3 h,待催化剂活性稳定后取样分析。
采用美国安捷伦公司生产的7890型气相色谱仪分析产物的烃类详细组成。1-MN的平衡转化率 (y1-MN,%),1-甲基四氢萘(1-MTL)和5-甲基四氢萘(5-MTL)的单环芳烃选择性(s1-MTL和s5-MTL,%),1-甲基十氢萘(1-MD)的加氢饱和选择性(s1-MD,%)分别由式(1)~式(4)计算。
(1)
(2)
(3)
(4)
式(1)~式(4)中:xf和xp分别为原料和产物中1-MN的摩尔分数,%;x1-MTL、x5-MTL及x1-MD分别为产物中1-MTL、5-MTL及1-MD的摩尔分数,%。
2 1-甲基萘加氢饱和热力学分析
从热力学角度,对1-甲基萘的加氢饱和反应网络进行系统分析,首先通过理论计算得到其反应网络中各步反应的标准平衡常数(Ki),分析Ki随温度的变化规律,并在此基础上进一步讨论氢分压、反应温度和物质结构对单步反应体系的平衡转化率、连续反应体系的平衡浓度分布及氢含量增加的影响。
2.1 反应网络建立与分析
LCO中含有40%~60%的双环芳烃,碳数为10~14,也就是表明双环芳烃还有1~4个支链碳。目前对具有甲基取代基的双环芳烃的加氢饱和反应网络研究比较透彻,如图2所示为1-MN加氢饱和反应网络[9];但是对带侧链多环芳烃的热力学计算研究较少。因此,计算带侧链双环芳烃加氢的反应热力学对于指导LCO的加氢饱和具有重要意义。
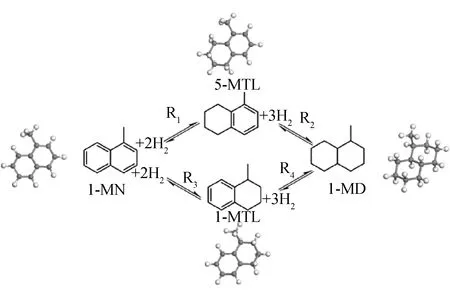
1-MN—1-Methylnaphthalene; 1-MTL—1-Methyltetralin;5-MTL—5-Methyltetralin; 1-MD—1-Methyldecalin;R1—Hydrogenation of 1-MN to 5-MTL;R2—Hydrogenation of 5-MTL to 1-MD;R3—Hydrogenation of 1-MN to 1-MTL;R4—Hydrogenation of 1-MTL to 1-MD图2 1-MN加氢饱和反应网络Fig.2 Network of 1-MN hydrogenation saturation reaction
图2中涉及的芳烃加氢饱和反应主要有:双环芳烃加氢成单环芳烃的R1和R3反应路径,即1-MN加氢生成5-甲基四氢萘(5-MTL)的R1反应路径、1-MN加氢生成1-甲基四氢萘(1-MTL)的R3反应路径;单环芳烃加氢饱和生成环烷烃的R2和R4反应路径,即5-MTL加氢生成1-甲基十氢萘(1-MD)的R2反应路径和1-MTL加氢生成1-MD的R4反应路径。
2.2 热力学计算分析
建立热力学分析方法中的化学平衡分析基于两点假设:(1)气相反应体系;(2)理想气体混合物。这与实际的气-液-固三相四氢萘加氢裂化反应体系存在偏差,但是规避了热力学平衡难以准确描述且编程运算极其复杂的难题。对于一理想气体化学反应,当体系处于化学平衡状态时,该反应的标准平衡常数(Ki)可由式(5)来计算,并且标准平衡常数和该反应的吉布斯自由能满足Gibbs-Helmholtz方程,见式(6)。在一定温度下,化学反应的标准摩尔反应吉布斯函数(ΔrGθ)等于相同温度下参与反应的各组分标准摩尔生成吉布斯函数(ΔfGθ)与化学计量数(vB)的乘积之和,见式(7)。
Ki=Πj(pi/pθ)vij=Πj(xiptotal/pθ)vij
(5)
(6)
ΔrGθ(T)=∑BvBΔfGθ(B)
(7)
式(5)~式(7)中:Ki为处于化学平衡体系中i组分的平衡系数;pi为i组分的平衡分压,MPa;ptotal为系统总压,MPa;xi为反应体系中i组分的摩尔分数,%;pθ为标准大气压(0.101 MPa);ΔrGθ(T)为反应温度T下的标准反应吉布斯自由能,kJ/mol;R为理想气体常数,8.314 J/(mol·K);T为反应温度,K;ΔfGθ为标准摩尔生成吉布斯函数,kJ/mol;vB为化学计量数。
按照式(5)~式(7),则反应平衡常数与反应吉布斯自由能之间存在以下关系式:
ΔrG1=ΔfG5-MTL-ΔfG1-MN-2ΔfGH2=-RTlnK1
(8)
ΔrG2=ΔfG1-MD-ΔfG5-MTL-3ΔfGH2=-RTlnK2
(9)
ΔrG3=ΔfG1-MTL-ΔfG1-MN-2ΔfGH2=-RTlnK3
(10)
ΔrG4=ΔfG1-MD-ΔfG1-MTL-3ΔfGH2=-RTlnK4
(11)
式(8)~式(11)中:ΔrG1、ΔrG2、ΔrG3、ΔrG4分别为R1、R2、R3、R4这4条反应路径的反应吉布斯自由能,kJ/mol;ΔfG1-MN、ΔfG5-MTL、ΔfG1-MTL、ΔfG1-MD分别为1-MN、5-MTL、1- MTL和1-MD的生成吉布斯自由能,kJ/mol;K1、K2、K3、K4分别为R1、R2、R3、R4这4条反应路径所对应的平衡常数,K1~K4的计算公式如下:
(12)
(13)
(14)
(15)
式(12)~式(15)中:p1-MN、p1-MTL、p5-MTL、p1-MD、pH2分别为1-MN、1-MTL、5-MTL、1-MD和H2的分压,MPa;x1-MN、x1-MTL、x5-MTL、x1-MD分别为1-MN、1-MTL、5-MTL、1-MD的摩尔分数,%。
利用Material studio软件,基于密度泛函的量子力学Dmol3方法来计算上述反应网络中对应的R1~R4路径各步反应的自由能。主要计算步骤如下:首先计算温度为0 K下1-MN、1-MTL、5-MTL 及1-MD 4种分子的活化能量Ei;其次获得不同温度下自由能的校正值(Gi)以及对应的f(T)函数,并以此来计算不同温度下各自分子的吉布斯反应自由能,即Gi(T)=Ei+Gi,f(T);最后计算不同温度下各个反应的吉布斯反应自由能。将获得各步反应在不同温度下的ΔrG绘制于图3。再根据Gibbs-Helmholtz方程即可获得各反应的平衡常数Ki,并作Ki随反应温度的变化曲线,如图4所示。
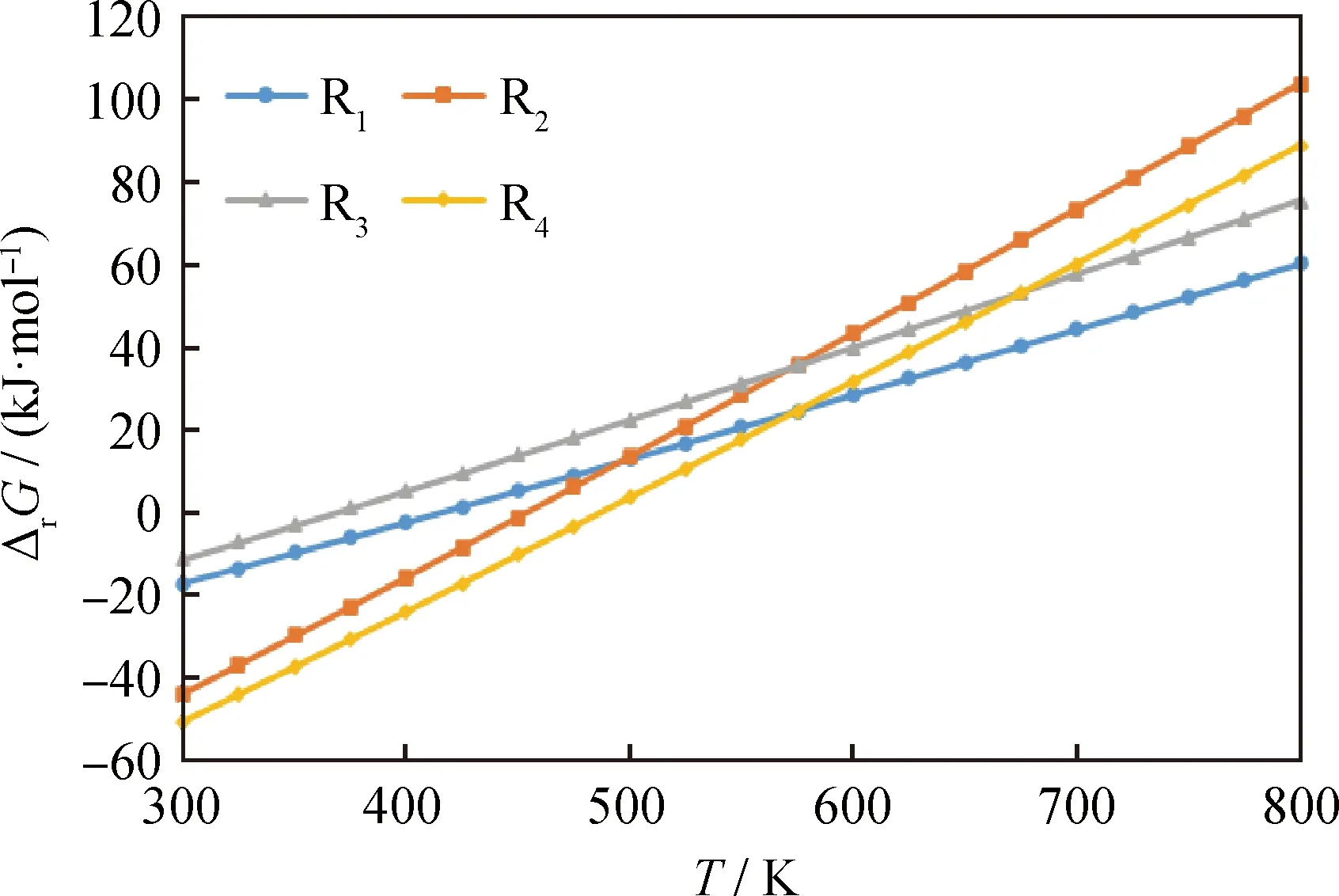
图3 不同反应温度(T)下1-MN加氢反应自由能(ΔrG)Fig.3 1-MN hydrogenation reaction free energy (ΔrG)at different reaction temperatures (T)
根据图3的结果可知,各个反应体系的共同特点是:在300~800 K内,ΔG随反应温度升高而近似线性增加;当温度低于400 K时,ΔG2和ΔG4为负值,表明这些反应在低于400 K(126.9 ℃)时为自发过程,且温度越低,ΔG越小。另外根据4个反应ΔG随反应温度的变化趋势可知,其中甲基萘加氢生成四氢萘(R1、R3)的ΔG随温度的变化率要小于四氢萘加氢生成十氢萘的变化率(R2、R4),说明四氢萘加氢生成十氢萘反应自由能的变化对温度更为敏感。

图4 不同反应温度(T)下各个反应的平衡常数(K)Fig.4 Equilibrium constants (K) of each reactionat different reaction temperatures (T)
从图4可以看出,随着反应温度的升高,平衡常数逐渐降低,表明1-MN的加氢反应为放热反应。在4个反应中,当反应温度高于500 K时,1-MN加氢生成5-MTL的平衡常数K1要高于5-MTL加氢生成1-MD平衡常数K2;但当温度低于500 K时,K1要低于K2;对于1-MN加氢生成1-MTL再加氢饱和生成1-MD,这个转变的温度为575 K。通过上述分析可知,在低于500 K的反应温度下,有利于1-MN全部加氢反应的发生;而在高于575 K的反应温度下,有利于部分加氢饱和反应。有学者采用Material studio分子模拟软件[10],对1-MN的反应路径进行模拟,发现反应温度在600 K以上,双环芳烃第一个芳环加氢较容易,由四氢萘类进一步加氢生成十氢萘类的反应自由能较高,加氢饱和较困难,是整个连串反应的控制步骤。
热力学所计算的反应体系中有1-MN、1-MTL、5-MTL、1-MD以及H2,通过给定反应体系的初始条件,再经过联立上述的式(12)~式(15),在方程求解过程中运用Fortran语言进行编程,便可得到4种反应物在不同反应条件下的平衡组成。表1为在反应温度673 K条件下采用此计算方法得到1-MN加氢各基元反应的平衡常数与文献值的比较。
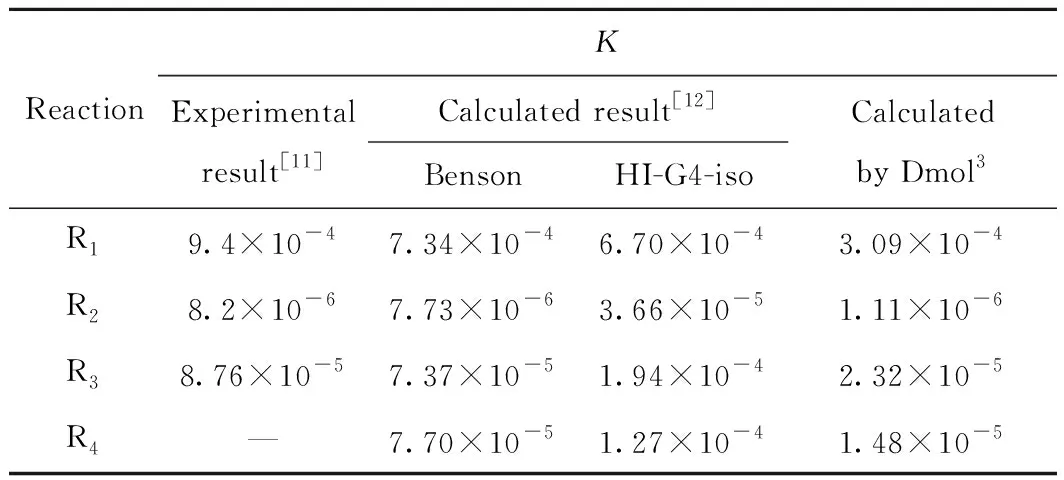
表1 量子力学Dmol3方法的平衡常数(K)计算值与文献值的比较Table 1 Comparison of calculated values of equilibriumconstants (K) by quantum mechanics Dmol3 methodand reference values in literature
从表1可以看出,文献[11-12]的计算结果与Dmol3方法的计算结果存在一定的偏差,但还是在同一个数量级水平上,表明此方法的计算结果具有一定的代表性,能够反映出真实反应的特点。
2.3 反应条件对1-MN加氢反应的影响
对于芳烃加氢饱和的工业装置来说,其属于连续加氢过程,即反应体系中存在连续的H2氛围以实现加氢饱和反应持续进行。因此以连续的加氢反应体系为研究对象,通过热力学计算出在各个反应条件下达到热力学平衡时各组分的摩尔分数,从而获得更多的转化率以及选择性数据来指导工业装置生产。以1-MN为例,假定反应初始时,连续反应体系中只有1-MN和H2,且H2分压为6.0 MPa,在一定反应温度下,当反应网络达到平衡时,其中的每步反应也应平衡,即满足式(12)~式(15)的关系。在平衡的反应体系中以x1-MN、x5-MTL、x1-MTL、x1-MD分别为平衡体系中1-MN、5-MTL、1-MTL及1-MD的摩尔分数,则有如式(16)所示的关系式:
x1-MN+x5-MTL+x1-MTL+x1-MD=1
(16)
由式(16)以及式(12)~式(15)所得出的在一定温度下的标准平衡常数Ki,即可计算出该温度下1-MN连续加氢体系中各物种的摩尔分数,再通过式(1)可以计算得出1-MN的平衡转化率。
2.3.1 反应温度对加氢饱和反应的影响
在H2分压为6.0 MPa、初始氢气/1-MN摩尔比(n(H2)/n(1-MN))为5的条件下,考察了反应温度对整个反应体系中产物摩尔分数的影响,计算结果见图5。

图5 反应温度(T)对1-MN及其加氢产物摩尔分数(x)的影响Fig.5 Effect of reaction temperature (T) on the molarfraction (x) of 1-MN and its hydrogenation productsp=6.0 MPa; n(H2)/n(1-MN)=5
根据图5可知:在反应温度为600~800 K时,随着反应温度的升高,1-MN的摩尔分数先保持不变,后快速升高,再缓慢升高;5-MTL和1-MTL的摩尔分数随着反应温度的升高先升高后降低,并且在相同反应温度下,5-MTL的摩尔分数始终高于1-MTL的摩尔分数,如在700 K时,5-MTL的摩尔分数为42.8%,而1-MTL的摩尔分数为4.4%;1-MD的摩尔分数随着反应温度的升高先快速降低后缓慢降低。根据上述分析可知,在反应温度低于600 K时,平衡体系中即可以获得较高的全加氢产物1-MD的摩尔分数;而在反应温度高于700 K时,可以获得较高的中间加氢饱和产物(5-MTL 及1-MTL)的摩尔分数,并且5-MTL的摩尔分数高于1-MTL的摩尔分数。这可能由于苯环的大π键在催化剂表面呈现平躺吸附,带甲基的芳环在催化剂表明的吸附需要占据一定的空间来容纳较大的半径,甲基对苯环加氢的空间位阻效应较明显[9],因此在加氢饱和中间产物中5-MTL摩尔分数较高。另外,结合上述的热力学计算可知,1-MN 生成5-MTL的反应吉布斯自由能变始终低于1-MN生成1-MTL的反应吉布斯自由能变,所以加氢饱和产物中5-MTL的摩尔分数高于1-MTL。
有关不同反应温度下1-MN的平衡转化率及其加氢产物选择性的变化如图6所示。
从图6可以看出,1-MN的平衡转化率在低于600 K的温度下能够保持较高的平衡转化率,当温度升高至650 K时开始显著降低,当温度超过720 K 时降低的幅度变小。对于中间加氢饱和产物5-MTL和1-MTL来说,随着反应温度的提高,两者的选择性均是逐渐增加,而在反应温度高于600 K 时,生成5-MTL的选择性要显著高于生成1-MTL的选择性。对于1-MN完全加氢饱和生成产物1-MD过程,在反应温度低于600 K时具有较高的1-MN平衡转化率,且在反应温度低于573 K时1-MN平衡转化率可达到100%,这与文献[13]的结论相一致。随着反应温度的提高,1-MD的选择性也呈现先快速降低后缓慢降低的趋势,在反应温度高于800 K时1-MD的选择性趋于0%,也就是表明甲基四氢萘类的单环芳烃在高温下受到热力学平衡的限制,很难将最后一个芳环进行加氢饱和得到双环环烷烃。
2.3.2 反应压力对加氢饱和反应的影响
在反应温度为650 K、n(H2)/n(1-MN)为5的条件下,考察了反应压力对整个反应体系的影响。图7为不同反应压力下1-MN及其加氢产物的摩尔分数。
根据图7可知:随着反应压力的升高,1-MN的摩尔分数先快速降低再缓慢降低;5-MTL和1-MTL的摩尔分数随着反应压力的升高先升高后降低;1-MD的摩尔分数随着反应压力的升高先快速升高后缓慢升高。根据上述分析可知,在反应压力高于6 MPa时,平衡体系中全加氢产物1-MD的摩尔分数可以达到高于67.6%;而在反应压力为4 MPa时,中间加氢饱和产物(5-MTL及1-MTL)的摩尔分数之和可以达到最高为42.2%。结果表明,当反应压力为2~6 MPa时,反应体系中的中间加氢饱和产物含量较高。
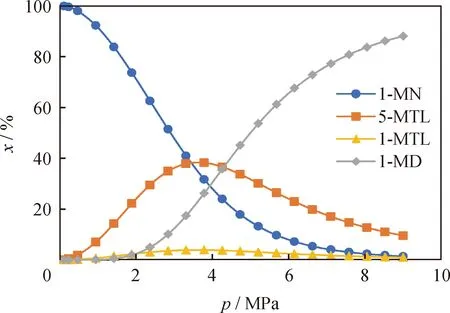
图7 反应压力(p)对1-MN及其加氢产物摩尔分数(x)的影响Fig.7 Effect of reaction pressure (p) on the molarfraction (x) of 1-MN and its hydrogenation productsT=650 K; n(H2)/n(1-MN)=5
不同反应压力下1-MN平衡转化率及其加氢产物选择性如图8所示。
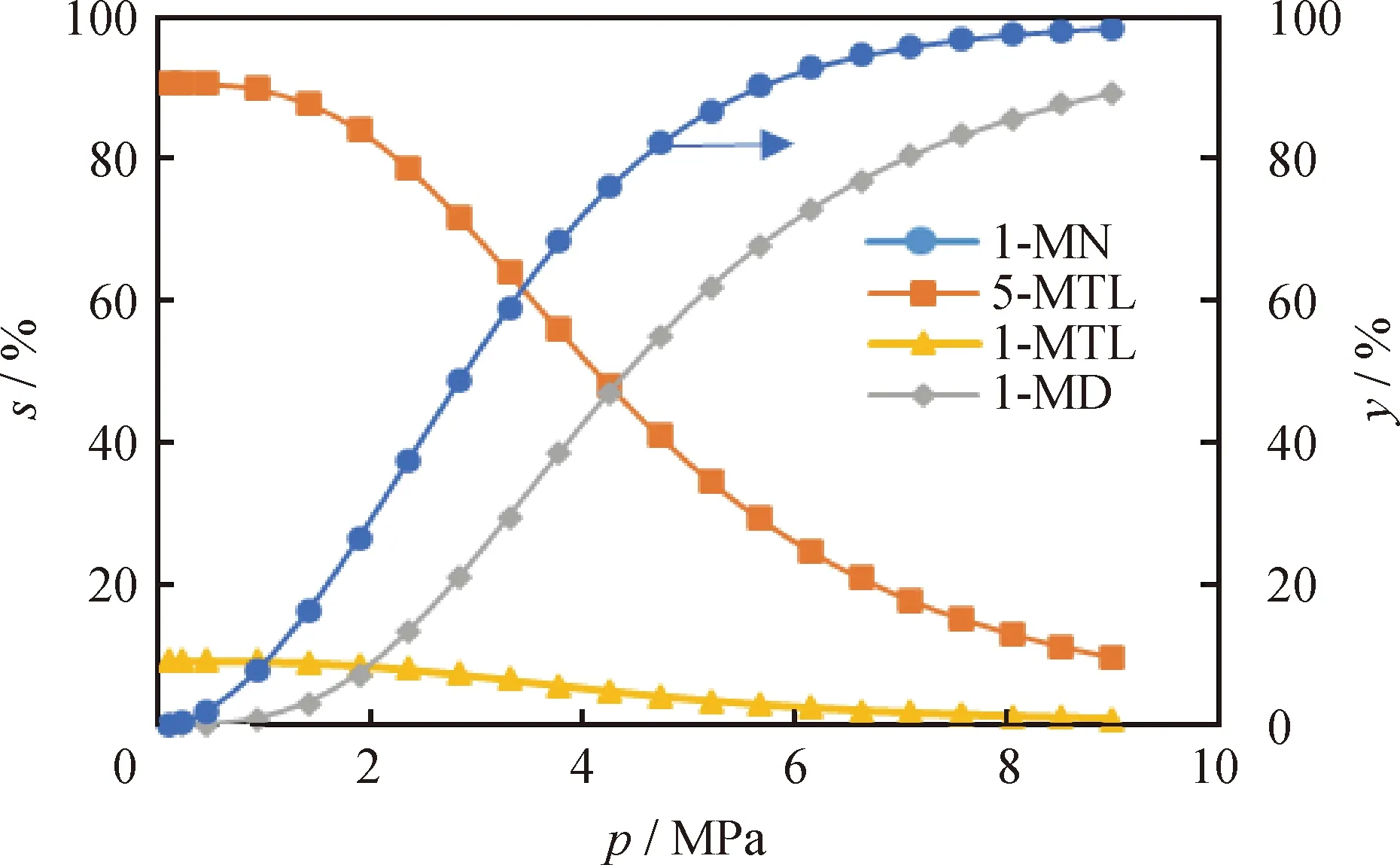
图8 反应压力(p)对1-MN平衡转化率(y)及其加氢产物选择性(s)的影响Fig.8 Effect of reaction pressure (p) on the equilibriumconversion rate (y) of 1-MN and selectivity (s)of its hydrogenation productsT=650 K; n(H2)/n(1-MN)=5
从图8可以看出,随着反应压力的升高,1-MN的平衡转化率先快速升高而后缓慢升高,当反应压力升至6 MPa时即可获得超过90%的转化率。对于中间加氢饱和产物5-MTL和1-MTL来说,随着反应压力的提高,两者的选择性均是逐渐下降的;而在反应压力低于4.0 MPa时,5-MTL选择性远高于1-MTL选择性。在高于4.0 MPa的反应压力下,1-MN生成1-MD的选择性要显著高于生成中间加氢饱和产物5-MTL和1-MTL的选择性。根据上述分析可知,为了获得较高的1-MN平衡转化率需要较高的反应压力,而较高的反应压力会进一步促使1-MN经由中间加氢饱和产物(5-MTL和1-MTL)向1-MD的转化,从而提高了双环芳烃加氢饱和生成双环环烷烃。
2.3.3 氢/烃摩尔比对加氢饱和反应的影响
在反应温度为650K 、反应压力为6.0 MPa的条件下,考察了n(H2)/n(1-MN)的变化对整个反应体系的影响。图9为在不同n(H2)/n(1-MN)对1-MN及其加氢产物摩尔分数的影响。
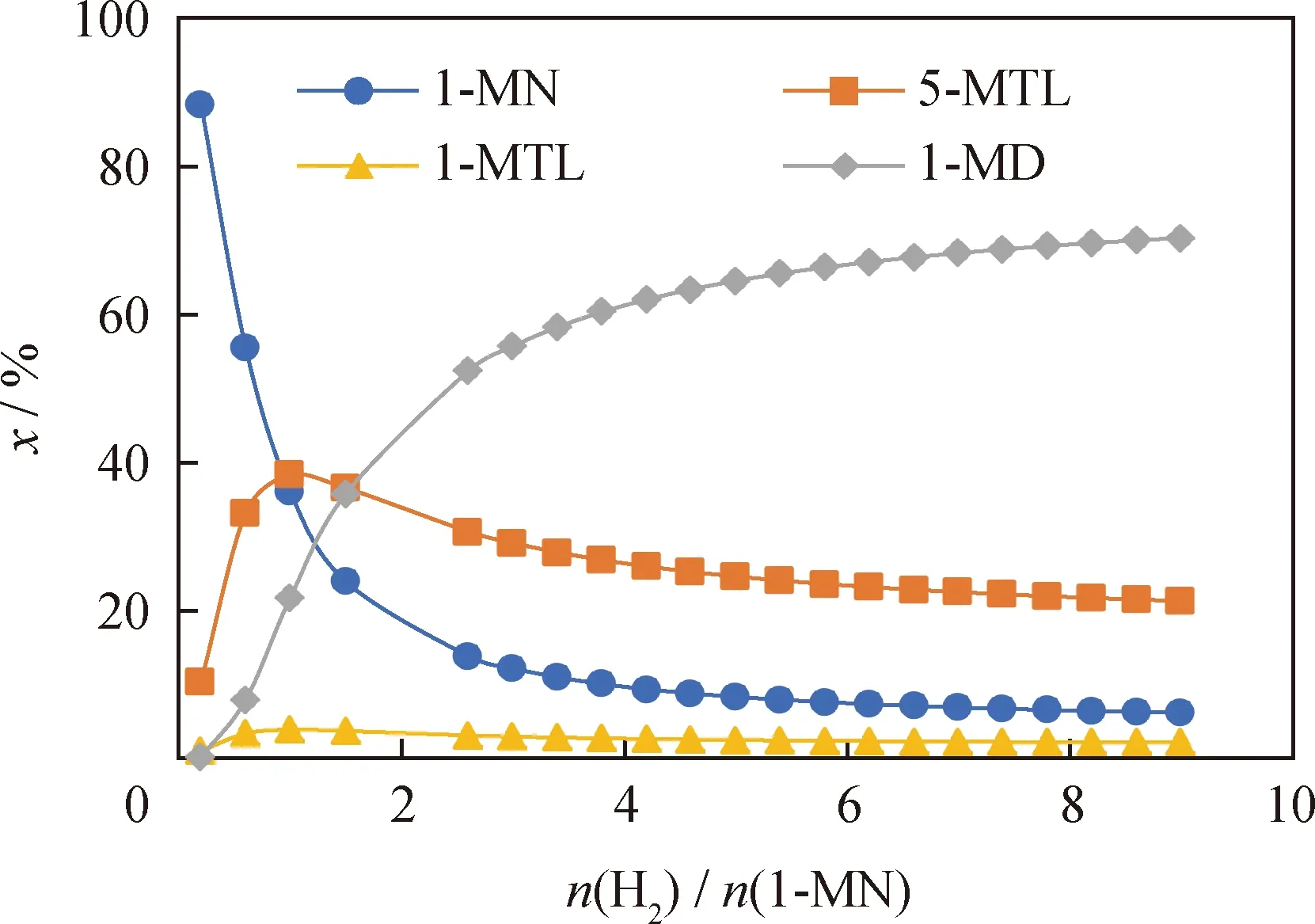
图9 氢/烃摩尔比(n(H2)/n(1-MN))对1-MN及其加氢产物摩尔分数(x)的影响Fig.9 Effect of hydrogen/hydrocarbon molar ratio(n(H2)/n(1-MN)) on the molar fraction (x) of1-MN and its hydrogenation productsT=650 K; p=6.0 MPa
从图9可以看出:随着n(H2)/n(1-MN)增大,1-MN的摩尔分数先快速降低再缓慢降低;5-MTL和1-MTL的摩尔分数随着n(H2)/n(1-MN)的增大先升高后降低,在n(H2)/n(1-MN)为1时达到极大值;1-MD的摩尔分数随着n(H2)/n(1-MN)的增大先快速升高而后缓慢升高。根据上述分析可知,在n(H2)/n(1-MN)为1时,平衡体系中的中间加氢产物(5-MTL和1-MTL)摩尔分数之和可以达到最高值42.2%;而在n(H2)/n(1-MN)高于4的条件下,全加氢产物1-MD摩尔分数大于62.0%。
不同n(H2)/n(1-MN)下1-MN的平衡转化率和及其加氢产物选择性的变化如图10所示。
从图10可以看出:随着n(H2)/n(1-MN)增大,1-MN的平衡转化率先快速升高而后缓慢升高,当n(H2)/n(1-MN)高于4时,1-MN的平衡转化率可达到90%以上;对于中间加氢饱和产物5-MTL和1-MTL来说,随着n(H2)/n(1-MN)增大,两者的选择性均是呈现逐渐下降的趋势,而在n(H2)/n(1-MN)低于 4时,5-MTL选择性要远高于1-MTL选择性。而当n(H2)/n(1-MN)高于4时,生成1-MD的选择性要显著高于生成中间加氢饱和产物5-MTL和1-MTL 的选择性。表明在较高的1-MN平衡转化率下会进一步促使经由中间加氢饱和产物(5-MTL和1-MTL)向1-MD的转化,从而提高了双环芳烃加氢饱和生成双环环烷烃。就n(H2)/n(1-MN)而言,当反应压力恒定时,提高n(H2)/n(1-MN)相当于提高H2分压,这对于芳烃加氢饱和是有利的。因此,n(H2)/n(1-MN)对1-MN加氢饱和生成中间加氢饱和产物(5-MTL和1-MTL)以及全加氢饱和产物(1-MD)的影响与反应总压对各反应路径的影响规律一致。

图10 氢/烃摩尔比(n(H2)/n(1-MN))对1-MN平衡转化率(y)及其加氢产物选择性(s)的影响Fig.10 Effect of hydrogen/hydrocarbon molar ratio(n(H2)/n(1-MN)) on the equilibrium conversion rate (y)of 1-MN and selectivity (s) of its hydrogenation productsT=650 K; p=4.0 MPa
2.3.4 热力学平衡分析模拟结果
根据上述热力学计算,将1-MN的平衡转化率和平衡体系中的中间加氢饱和产物四氢萘类含量以及选择性绘制于图11。
从图11可以看出,随着1-MN平衡转化率的提高,全部甲基四氢萘类(MTLs,即5-MTL和1-MTL 之总和)的摩尔分数先增加后降低,当1-MN平衡转化率为65%时,在反应体系中MTLs摩尔分数最高为47.2%;随着1-MN平衡转化率的升高,MTLs的选择性逐渐降低,而完全加氢饱和产物1-MD选择性逐渐升高。计算结果表明,对于工业装置运行来说,为了获得较高的单环芳烃(MTLs)含量,则需要选择控制双环芳烃(甲基萘类)转化率在65%左右。

图11 1-MN平衡转化率(y)与四氢萘类、十氢萘类选择性(s)及四氢萘类摩尔分数(x)的关系Fig.11 Relationship between the equilibrium conversionrate (y) of 1-MN and the selectivity (s) oftetrahydronaphthalenes and decahydronaphthalenesand the molar fraction (x) of tetrahydronaphthalenesT=650 K; p=6.0 MPa; n(H2)/n(1-MN)=5
3 1-MN加氢饱和实验结果
采用微型固定床加氢反应器,考察了反应温度、H2分压对1-MN加氢饱和反应规律的影响。在芳烃加氢饱和工业装置中,反应条件的变化对芳烃加氢饱和过程及产物选择性产生重要的影响[14-15],在热力学计算的基础上通过实验结果进一步说明反应条件的影响。
3.1 反应温度对产物分布及MTLs选择性的影响
1-MN加氢饱和反应随反应温度的变化如图12和图13所示。
从图12可以看出:反应温度由523 K提高至583 K时,1-MN摩尔分数略有降低, MTLs摩尔分数显著降低;反应温度由583 K提高至653 K,1-MN摩尔分数逐渐升高,MTLs摩尔分数继续降低。说明在反应温度523~583 K范围内,1-MN加氢饱和尚未达到热力学平衡,还在反应动力学控制区,提高反应温度能进一步促进1-MN的转化;在反应温度583~653 K范围内,1-MN加氢饱和达到了热力学平衡,提高反应温度导致1-MN摩尔分数升高。同理分析MTLs与1-MD之间的转化可知,在反应温度523~623 K范围内该反应受到动力学的控制,1-MD摩尔分数随反应温度的升高而逐渐升高;在反应温度623~653 K范围内则受到热力学的控制,1-MD摩尔分数随反应温度的升高而逐渐降低。

图12 反应温度(T)对1-MN加氢产物摩尔分数(x)的影响Fig.12 Effect of reaction temperature (T) on the molarfraction (x) of 1-MN hydrogenation productsp=4.0 MPa; n(H2)/n(1-MN)=10; LSHV=2.4 h-1

图13 反应温度(T)对1-MN平衡转化率(y)及其加氢产物选择性(s)的影响Fig.13 Effect of reaction temperature (T) on the equilibriumconversion rate (y) of 1-MN and selectivity (s)of its hydrogenation productsp=4.0 MPa; n(H2)/n(1-MN)=10; LSHV=2.4 h-1
根据图13可知:在所考察的反应温度范围(523~653 K)内,1-MN的平衡转化率保持在85.9%以上,当反应温度由523 K提高至553 K时,1-MN的平衡转化率略有升高;当反应温度由553 K提高至653 K时,1-MN的平衡转化率逐渐降低,从变化趋势上可以看出1-MN达到热力学平衡的反应温度为553 K。当反应温度由523 K提高至623 K,MTLs选择性逐渐下降,而1-MD选择性逐渐上升,说明在反应温度523~623 K范围内,1-MN 加氢饱和生成MTLs已经达到热力学平衡,而MTLs加氢饱和生成1-MD尚未达到热力学平衡,还在反应动力学控制区,提高反应温度能进一步促进MTLs转化为1-MD。当反应温度超过623 K时,MTLs加氢饱和生成1-MD进入了热力学控制区,提高反应温度抑制了MTLs转化为1-MD,也就导致反应体系中1-MD选择性降低,不利于1-MD的生成。上述结果表明,在LCO加氢装置进行工业生产时,为了避免多环芳烃的过度加氢饱和,不易在较低的反应温度下进行,需要提高反应温度至623 K以上,以实现多环芳烃转化为单环芳烃。
3.2 H2分压对平衡转化率及MTLs选择性的影响
1-MN加氢饱和反应随H2分压的变化规律如表2 所示。

表2 H2分压对1-MN平衡转化率及MTLs选择性的影响Table 2 Effect of H2 partial pressure on the equilibriumconversion rate of 1-MN and selectivity of MTLs
由表2可见,随着H2分压的升高, 1-MN的平衡转化率呈现逐渐升高的趋势。当H2分压由3.0 MPa 提高至5.0 MPa时,1-MN平衡转化率增加了17.1百分点。随着H2分压升高,MTLs的选择性降低。提高H2分压有利芳烃加氢饱和平衡反应向右移动,即促使1-MN继续进行加氢饱和。结合表2中结果可知,在反应温度623 K时1-MN平衡转化率已经很高,MTLs的选择性也较高,当进一步提升H2分压时,反而促使MTLs再进一步加氢饱和生成1-MD类,从而导致了MTLs选择性的降低。综合考虑,采用Ni-Mo/γ-Al2O3催化剂时,选择适宜的H2分压为4.0 MPa,此时可以在保持较高1-MN平衡转化率的情况下获得较高的MTLs选择性。
4 结 论
(1)1-MN加氢饱和反应网络中4个反应的平衡常数均随反应温度的升高而减小,其中MTLs加氢生成1-MD反应自由能的变化对温度更为敏感。
(2)1-MN在连续加氢反应体系中各反应物的摩尔分数随反应条件的变化结果表明,反应温度、系统总压力和氢/烃摩尔比对1-MN加氢饱和产物分布具有重要影响,反应温度高于600 K和反应压力低于6.0 MPa的反应条件有利于提高反应体系中MTLs摩尔分数,当反应温度为650 K、反应压力为6.0 MPa以及氢/烃摩尔比为5时MTLs摩尔分数可以达到47.2%。
(3)采用Ni-Mo/γ-Al2O3催化剂的加氢饱和反应实验结果验证了1-MN的加氢饱和反应网络,反应温度对生成MTLs的单环芳烃加氢生成饱和烃的反应更为敏感,当反应温度超过623 K时能够抑制MTLs进一步加氢饱和生成1-MD;提高H2分压有利于芳烃加氢饱和平衡反应向右移动,可以提高1-MN 的转化率,却使MTLs选择性降低,综合考虑1-MN加氢饱和生成MTLs的适宜H2分压为4.0 MPa。
