miR-410-3p对骨肉瘤细胞增殖、凋亡的影响及机制*
2022-11-16孟桢桢赵伟赵昂黄晖廉凯曹园
孟桢桢, 赵伟, 赵昂, 黄晖, 廉凯, 曹园**
(1.国药葛洲坝中心医院 骨外科, 湖北 宜昌 443002; 2.湖北文理学院附属医院 & 襄阳市中心医院 骨科, 湖北 襄阳 441021)
骨肉瘤(osteosarcoma,OS)是一种进展迅速,转移性高和预后不良的原发恶性肿瘤[1-2]。现阶段OS的诊断和治疗均有了较大改善,但由于手术切除后肿瘤转移频繁和肿瘤复发,OS的治愈率仍不乐观[3-4]。因此,阐明OS发生发展的分子机制,寻找新的生物标志物势在必行。微小RNA(microRNA,miRNA/miR)是一类高度保守的内源性非编码RNA,也是OS等多种肿瘤发生的关键调节因子[5-6]。既往研究表明,miR-410通过Wnt /β-连环蛋白(β-catenin)信号通路,并靶向dickkopf相关蛋白1,在结直肠癌细胞中作为癌基因发挥作用[7];miR-410-3p还可通过调控第10号染色体同源缺失性磷酸酶-张力蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路促进前列腺癌进展[8];miR-410在结直肠癌中高表达,促进结直肠癌的迁移、侵袭和上皮-间质转化过程,来促进癌症进展[9]。资料显示,趋化素样因子超家族成员3(CKLF like MARVEL transmembrane domain containing 3,CMTM3)能抑制肿瘤的发生与侵袭,是一种肿瘤抑制因子[10]。CMTM3在胃癌组织中下调表达[11],miR-135b-5p通过靶向CMTM3促进胃癌进展[12]。然而miR-410-3p和CMTM3在OS中的表达与作用,以及miR-410-3p是否通过靶向CMTM3调控OS细胞增殖和诱导凋亡,这方面的研究尚不多见。因此,本研究分析miR-410-3p和CMTM3与64例OS患者临床病理特征的关系,并通过体外培养OS细胞分析miR-410-3p的表达情况,利用噻唑蓝溴化四唑(thiazolyl blue tetrazolium bromide,MTT)、流式细胞术等技术检测miR-410-3p对OS细胞增殖和凋亡的影响,分析其对CMTM3的调控,探索miR-410-3p作用的分子机制。
1 材料与方法
1.1 实验材料
1.1.1临床组织样本 选取2017年1月—2018年12月收治的64例OS患者的OS组织及瘤旁组织标本,要求患者均无其他恶性肿瘤、放疗或化疗病史,向所有患者或<18岁患者的法定监护人提供书面知情同意书。所有活检标本立即放入液氮中,-80 ℃贮存。
1.1.2细胞来源 OS细胞系MG63、U2-OS、OS187及健康人成骨细胞hFOB1.19购自美国典型培养物保藏中心。
1.1.3主要试剂与仪器miR-410-3p、anti-miR-410-3p、空载体(pcDNA)、pcDNA-CMTM3、si-NC、CMTM3抑制物(si-CMTM3,广州锐博生物),TRIzol、Lipofectamine 2000及逆转录试剂盒(美国Invitrogen),实时定量PCR(quantitative real-time polymerase chain reaction,qPCR)试剂盒(美国ThermoFisher),MTT及放射免疫沉淀法(radio-immunoprecipitation assay,RIPA)裂解液(美国Sigma),Annexin V-FITC/PI 细胞凋亡检测试剂盒(江苏凯基生物),CMTM3蛋白抗体(美国Abcam),细胞周期蛋白D1(cyclinD1)、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)及β肌动蛋白(β-actin)蛋白抗体(美国Cellular Signaling Technology);BD FACSCalibur流式细胞仪(美国Beckman);Spectra Max M5酶标仪(德国QIAGEN)。
1.2 实验方法
1.2.1细胞培养与处理 MG63、U2-OS、OS187及hFOB1.19细胞培养于杜氏改良依格尔(duchenne's modified eagle's medium,DMEM)高糖培养基(含10%胎牛血清)、37 ℃的5%CO2培养箱。实验分为anti-miR-410-3p组(转染anti-miR-410-3p)、anti-miR-con组(转染anti-miR-con)、未转染组 (空白培养细胞,NC)、pcDNA-CMTM3组(转染pcDNA-CMTM3)、pcDNA组(转染pcDNA)、anti-miR-410-3p+si-con组(共转染anti-miR-410-3p与si-con)、anti-miR-410-3p+si-CMTM3组(共转染anti-miR-410-3p与si-CMTM3)。MG63细胞转染时,于6孔板中接种1×104个细胞。根据Lipofectamine 2000试剂操作规程,将anti-miR-410-3p、pcDNA-CMTM3、si-CMTM3及各自阴性对照转染入70%融合的MG63细胞,培养48 h备用。
1.2.2qPCR检测miR-410-3p和CMTM3 mRNA表达 为检测miR-410-3p和CMTM3 mRNA表达,使用TRIzol试剂提取OS组织、瘤旁组织与hFOB1.19、MG63、U2-OS、OS187细胞及各组MG63细胞总RNA,并逆转录为cDNA,U6为参照,20 μL反应体系为cDNA 2 μL、SYBR Green Mix 10 μL、上下游引物各0.5 μL,无菌水补足;反应条件为95 ℃ 5 min,95 ℃ 15 s、60 ℃ 30 s,40个循环后,进行qPCR反应。miR-410-3p正向引物序列5′-GGTTGTCTGTGATGAGTTCGC-3′,反向引物序列5′- CTGAAAACAGGCCATCTGTGT-3′;CMTM3正向引物序列5′-TGGCCAAGAAAGTCGCAAGA-3′,反向引物序列5′- GAAACCCGGGTCGCTGTCTC-3′。收集Ct值,根据2-ΔΔCt法计算miR-410-3p和CMTM3 mRNA表达量。
1.2.3双萤光素酶活性检测 利用starBase(http://starbase.sysu.edu.cn/)软件预测出miR-410-3p与CMTM3 3′UTR部分碱基可以互补配对。分别构建含有miR-410-3p结合位点的野生型(wild type,WT)CMTM3(WT-CMTM3)和突变型(mutant type,MUT)CMTM3(MUT-CMTM3)的报告基因载体(由广州锐博生物构建),与miR-410-3p或anti-miR-410-3p共转染,48 h后测定双萤光素酶活性。
1.2.4MTT法检测细胞增殖 按1.2.1项下对数期生长的anti-miR-410-3p组、anti-miR-con组、NC组、pcDNA-CMTM3组、pcDNA组、anti-miR-410-3p+si-con组、anti-miR-410-3p+si-CMTM3组细胞,于96孔板中接种MG63细胞1×104个,培养至24 h、48 h、72 h时,于37 ℃将细胞与5 g/L MTT溶液100 μL反应4 h,37 ℃与二甲基亚砜200 μL于摇床反应10 min,酶标仪读取各孔细胞490 nm波长处的吸光度值(optical density,OD490 nm)值。
1.2.5流式细胞术检测细胞凋亡 按1.2.1项下对数期生长的anti-miR-410-3p组、anti-miR-con组、NC组、pcDNA-CMTM3组、pcDNA组、anti-miR-410-3p+si-con组、anti-miR-410-3p+si-CMTM3组细胞,根据Annexin V-FITC细胞凋亡检测试剂盒操作规程,将1×103个/L MG63细胞悬浮于缓冲液500 μL,分别于室温避光条件下与Annexin V-FITC 5 μL、碘化丙啶(propidiumIodide,PI)5 μL染色液混匀;15 min后于流式细胞仪测量MG63细胞凋亡。
1.2.6Western blot检测目的蛋白表达 取OS组织、瘤旁组织hFOB1.19、MG63、U2-OS、OS187细胞及各组MG63细胞anti-miR-410-3p组、anti-miR-con组、NC组、pcDNA-CMTM3组、pcDNA组、anti-miR-410-3p+si-con组、anti-miR-410-3p+si-CMTM3组细胞,MG63细胞中总蛋白用RIPA裂解液提取,10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)和转聚偏二氟乙烯膜、5%脱脂奶粉中封闭,4 ℃与CMTM3、CyclinD1、Bcl-2、Bax及内参β-actin抗体(1 ∶1 000稀释)等一抗孵育12 h;次日用Tris-HCl-Tween缓冲液洗膜10 min,洗3次;加二抗(1 ∶5 000稀释),37 ℃孵育1 h;TBST洗膜10 min,洗3次;蛋白条带通过化学发光液显影。
1.3 统计学分析

2 结果
2.1 miR-410-3p和CMTM3的表达
qPCR和Western blot检测结果表明,与瘤旁组织比较,OS组织内miR-410-3p表达量升高,CMTM3 mRNA和蛋白表达量降低(P<0.05),见图1。

注:A、B分别为miR-410-3p、CMTM3 mRNA的表达,C、D分别为CMTM3蛋白的Western blot检测结果和相对表达结果;(1)与瘤旁组织比较,P<0.05。
2.2 miR-410-3p、CMTM3表达与OS患者临床病理指标的关系
结果表明,miR-410-3p和CMTM3与OS患者的肿瘤Enneking分期和淋巴结转移密切相关(P<0.01),但均与患者的性别、年龄、肿瘤大小无相关性(P>0.05)。见表1。

表1 miR-410-3p和CMTM3表达与OS患者临床病理指标的关系
2.3 MG63、U2-OS、OS187及hFOB1.19细胞中miR-410-3p和CMTM3的表达
qPCR检测miR-410-3p表达结果显示,与健康人成骨细胞hFOB1.19比较,OS细胞系MG63、U2-OS、OS187中miR-410-3p表达升高(P<0.05);选择差异最显著的MG63细胞展开后续研究,qPCR和Western blot检测结果表明,与hFOB1.19细胞比较,MG63、U2-OS、OS187细胞内CMTM3 mRNA和蛋白表达量降低(P<0.05)。见图2。

注:A、B分别为miR-410-3p、CMTM3 mRNA的相对表达结果,C、D分别为CMTM3蛋白的Western blot检测结果和相对表达结果;(1)与hFOB1.19组比较,P<0.05。
2.4 miR-410-3p靶向调控CMTM3的表达
生物信息学预测miR-410-3p的靶基因CMTM3(图3A)。双萤光素酶报告实验结果显示(图3B),与miR-con组相比,miR-410-3p组内WT-CMTM3萤光素酶相对活性降低(P<0.05),但对MUT-CMTM3萤光素酶相对活性无影响(P>0.05);Western blot检测CMTM3蛋白表达结果表明(图3C和3D),与miR-con组相比,miR-410-3p组内CMTM3蛋白表达量降低(P<0.05);与anti-miR-con组相比,anti-miR-410-3p组内CMTM3蛋白表达量升高(P<0.05)。
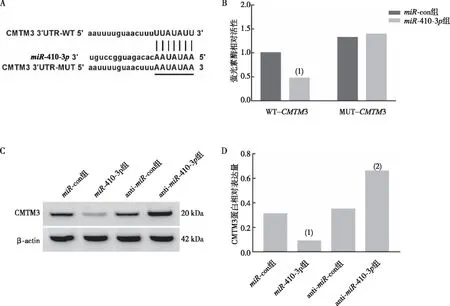
注:A为miR-410-3p与CMTM3的3′UTR靶向结合,B为miR-410-3p与CMTM3的双萤光素酶报告实验,C、D为CMTM3蛋白的Western blot检测结果和相对表达结果;(1)与miR-con组比较,P<0.05;(2)与anti-miR-con组比较,P<0.05。
2.5 抑制miR-410-3p表达对OS MG63细胞增殖和细胞凋亡的影响
与anti-miR-con组相比,miR-410-3p组内miR-410-3p表达量、48 h和72 h细胞活性、Cyclin D1、Bcl-2蛋白表达量降低(P<0.05),细胞凋亡率、Bax蛋白表达量升高(P<0.05)。见图4。

注:A为miR-410-3p相对表达量,B为抑制miR-410-3p表达对MG63细胞增殖的影响,C为流式细胞术检测抑制miR-410-3p表达的MG63细胞凋亡情况,D为抑制miR-410-3p表达对MG63细胞凋亡率的影响,E、F分别为MG63细胞中Cyclin D1、Bcl-2、Bax蛋白的Western blot检测结果和相对表达结果;(1)与anti-miR-con组比较,P<0.05。
2.6 CMTM3过表达对OS MG63细胞增殖、凋亡的影响
与pcDNA组相比,pcDNA-CMTM3组内CMTM3、Bax蛋白表达量、细胞凋亡率增加(P<0.05),48 h和72 h的细胞活性、Cyclin D1、Bcl-2蛋白表达量降低(P<0.05)。见图5。

注:A、B分别为CMTM3、Cyclin D1、Bcl-2及Bax蛋白的Western blot检测结果和相对表达结果,C、D分别为细胞增殖和细胞凋亡;(1)与pcDNA组比较,P<0.05。
2.7 抑制CMTM3表达逆转了抑制miR-410-3p表达对OS MG63细胞增殖、凋亡的作用
与anti-miR-con组相比,miR-410-3p组内CMTM3、Bax蛋白表达量、细胞凋亡率增加(P<0.05),48 h和72 h的细胞活性、Cyclin D1及Bcl-2蛋白表达量降低(P<0.05);与anti-miR-410-3p+si-con组相比,anti-miR-410-3p和si-CMTM3组内CMTM3、Bax蛋白表达量、细胞凋亡率降低(P<0.05),48 h和72 h的细胞活性、Cyclin D1及Bcl-2蛋白表达量增加(P<0.05)。见图6。

注:A为CMTM3、Cyclin D1、Bcl-2和Bax蛋白的Western blot检测结果和相对表达结果,C、D分别为细胞增殖和细胞凋亡;(1)与anti-miR-con组比较,P<0.05;(2)与anti-miR-410-3p+si-con组比较,P<0.05。
3 讨论
越来越多的证据表明,miRNA异常表达与各种肿瘤密切相关,包括OS[13-14]。本研究分析显示,miR-410-3p与OS Enneking分期和淋巴结转移显著相关,提示miR-410-3p可能是肿瘤发生发展中重要的调节因子;同时miR-410-3p在OS细胞系MG63、U2-OS、OS187中表达上调,进一步的功能实验表明miR-410-3p参与OS进展。有研究显示,miR-410-3p在不同肿瘤中扮演着致癌基因或抑癌基因的角色,发挥着双重作用[15-16]。在促性腺瘤细胞和促皮质激素腺瘤细胞中miR-410-3p表达上调,但在促生长腺瘤细胞中起抑癌作用[17];前列腺癌组织和细胞系中的miR-410-3p表达上调,下调的miR-410-3p抑制细胞增殖、迁移,并加速细胞凋亡,miR-410-3p具有致癌功能[8]。而miR-410-3p在鼻咽癌和非小细胞肺癌中表达下调,miR-410-3p过表达可以减弱非小细胞肺癌细胞的增殖,miR-410-3p表现出抑癌功能[18-19]。miR-410-3p在胶质瘤组织中下调,直接靶向Ras相关蛋白1A(ras-related protein 1A,RAP1A)在胶质瘤中发挥肿瘤抑制作用[18]。本研究结果与Zhang等[8]的报道相同,OS细胞MG63中抑制miR-410-3p表达具有抗增殖和促凋亡的作用,说明miR-410-3p可能充当致癌因子影响OS的发生发展过程。
CMTM3与多种肿瘤的发病机制密切相关。例如,与匹配的非肿瘤组织相比,食管鳞癌组织中CMTM3 mRNA和CMTM3蛋白表达水平分别降低82.5%和75%,并且CMTM3低表达患者的生存时间明显短于高表达患者[19]。本研究结果也表明CMTM3 mRNA和CMTM3蛋白在OS细胞中表达下调,提示CMTM3可能在OS进展中发挥重要作用。Lu等[12]报道指出,CMTM3作为胃癌的肿瘤抑制因子,CMTM3过表达时减弱胃癌SGC-7901细胞增殖能力和细胞周期进程,并促进SGC-7901细胞凋亡,起着至关重要的作用;Li等[20]研究显示,CMTM3可能是预防和/或治疗肝细胞癌侵袭、转移的潜在分子靶点,过表达CMTM3在体外明显抑制肝细胞癌的细胞增殖、侵袭和上皮间质转化(epithelial-mesenchymal transition,EMT)过程,在体内减弱Balb/c裸鼠肿瘤的生长。然而CMTM3在OS中的作用尚不清楚。本研究中CMTM3与OS Enneking分期和淋巴结转移存在明显的相关性,CMTM3过表达抑制OS细胞增殖并促进其凋亡,与之前CMTM3在其他类型癌症中作用的结果一致,为CMTM3作为抑癌基因影响肿瘤发生发展提供了新的证据。
已有证据表明,miRNA可能通过靶向调控其下游靶基因,影响癌症等疾病的发生发展过程[21-22]。例如,miR-410-3p通过靶向Smad7促进血管紧张素Ⅱ诱导的心脏肥大[23]。本研究通过starBase分析的结果,将CMTM3鉴定为miR-410-3p在OS细胞中的直接靶标,双萤光素酶测定进一步证实miR-410-3p通过直接结合CMTM3 3,UTR区域抑制CMTM3表达;抑制miR-410-3p表达对MG63细胞增殖、Cyclin D1及Bcl-2蛋白表达的抑制效果及其对MG63细胞凋亡、Bax蛋白表达的促进效果均被抑制CMTM3表达所逆转,说明miR-410-3p通过靶向调控CMTM3表达促进OS进程。
综上所述,本研究结果显示了miR-410-3p失调对OS细胞增殖、凋亡的生物学意义和影响,miR-410-3p在OS细胞中高表达,通过靶向CMTM3调控OS细胞的增殖和凋亡,为OS的临床诊断提供了潜在生物标志物和治疗靶点。
