早孕绒毛及蜕膜组织中IL-6对吲哚胺2,3-双加氧酶表达的影响*
2022-11-16陈誉尹赵淑云王瑞伍紫蕊李玉佳文兴慧瞿佳丽黄官友
陈誉尹, 赵淑云, 王瑞, 伍紫蕊, 李玉佳, 文兴慧, 瞿佳丽, 黄官友**
(1.贵州医科大学附属医院 生殖中心, 贵州 贵阳 550004; 2.毕节市中医院 妇产科, 贵州 毕节 551700)
哺乳动物的子宫是孕育胚胎的场所,可为胚胎提供充足的养分,并对胚胎进行保护;子宫又是母体与胎儿紧密接触场所,孕体中一半的基因来自父亲,发育中的胚胎和胎盘被认为是半移植物 ,胎儿容易成为免疫系统攻击的潜在目标,如果没有强有力的免疫抑制,这种半移植物很快会被识别并产生排斥。在整个妊娠期,母体的免疫系统将胎儿视为暂时的自我,而不予以攻击[1],母胎耐受是保护胎儿不被母体免疫系统攻击的主要原因[1-3]。研究表明,在母胎界面(母体和胎儿的接触面,主要包括绒毛及蜕膜组织)中辅助型T细胞2(T helper 2 cell,Th2)型细胞因子如白细胞介素6(interleukin-6,IL-6)和吲哚胺2,3-双加氧酶 (indoleamine2,3-dioxygenase,IDO) 是维持母胎耐受的两个主要因子[4-7]。目前有关IL-6在母胎耐受中机制的研究较少,既往的研究表明,IL-6可上调早孕绒毛及蜕膜组织中IDO的表达[8],本研究主要探讨母胎界面中IL-6调控IDO表达的机制。
1 材料与方法
1.1 主要试剂与器材
蛋白酶抑制剂( P8340) 和 RIPA Buffer购自Sigma公司,BCA-100 蛋白定量测定制剂盒 、一抗和二抗去除液购自碧云天公司,兔抗IDO、兔抗信号转导及转录激活子-1(signal transducerand activator of transcription 1,STAT1) 抗体、兔抗蛋白质酪氨酸磷酸酶-1(src-homology domain 2-containing protein tyrosine phosphatase-1, SHP-1)抗体、兔抗蛋白质酪氨酸磷酸酶-2(Src-homology domain 2-containing protein tyrosine phosphatase-2,SHP-2)抗体、GAPDH兔单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白(immune globulin,IgG)及10×TBST购自Cell Signaling Technology 公司,PVDF 膜及ECL 试剂盒购自 PerkinElmer 公司,5×SDS-PACE 蛋白上样缓冲液及预染蛋白相对分子质量(Mr) Marker 购自 Biosharp 公司,SDS-PACE 制备试剂盒购北京SOLARBIO公司,重组人IL-6细胞因子购自PEPROTECH公司, F- 12/DMEM及FBS购自Invitrogen 公司。保温箱为美国Thermo公司产品。
1.2 研究方法
1.2.1标本来源、收集及处理 选择行人工流产终止妊娠的37例正常早孕(孕周6~8周)妇女,妊娠期间未服用任何药物,并排除全身性疾病、稽留流产、接受过人流前处理( 如孕酮和米非司酮)的患者[8]。本研究获医院伦理委员会批准(2020伦审第023号),将研究实施目的与方法过程告知受试者,均同意表示自愿配合研究,并签署同意书。 收集所有受试者的子宫绒毛及蜕膜组织,操作过程严格遵循无菌原则,采用无菌磷酸盐缓冲液( phosphate buffer saline pH7. 2,PBS pH7. 2)对绒毛和蜕膜组织进行清洗,去除红细胞。
1.2.2组织培养 绒毛和蜕膜组织在收集后40 min内(去除红细胞)处理完毕,具体步骤:将收集的绒毛的和蜕膜组织切成小块( 湿重≤1 mg) ,用 F-12 /DMEM冲洗2次,离心5 min,在培养基中加入10% FBS 和1%青霉素,37 ℃保温箱中培养,控制环境中CO2浓度为5%。后分别用含 0、50×10-6及100×10-6mg/L IL-6的培养基孵育24 h。
1.2.3Western blot检测绒毛和蜕膜组织中IL-6、IDO 、SHP-1、SHP-2及 STAT1蛋白的表达 收集所需的绒毛和蜕膜组织,放置在液氮冷却处理的研钵中,加入液氮后研磨,成粉末状,加入蛋白酶抑制剂形成裂解效果,4 ℃、1 2000 r/min离心30 min,取上清液,用 BCA 测蛋白浓度;进而继续在其中加入上样缓冲液,加温处理煮沸变性,加入聚丙烯酰胺凝胶中的电泳、转膜,将蛋白转至PVDF 膜上;用5%的脱脂奶粉封闭PVDF 膜 ,时间控制在2 h,一抗 4 ℃ 孵育过夜,洗膜后加入二抗,孵育后加入ECL 显影,使用 Imagel J 软件处理图片,GAPDH 作为内参对照。
1.3 统计学分析
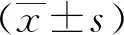
2 结果
2.1 正常早孕绒毛及蜕膜组织中 IDO和STAT1蛋白的表达
Western blot 结果表明,早孕绒毛及蜕膜组织中均有 IDO和STAT1蛋白的表达(图1A及图2A),且绒毛组织中IDO和STAT1蛋白的均高于蜕膜组织,差异均有统计学意义(P<0.05)。见图1。

注:A为Western Blot检测在正常早孕蜕膜和绒毛组织中IDO蛋白的结果,B为正常早孕蜕膜和绒毛组织中IDO蛋白表达的定量结果;(1)与蜕膜组织比较,P<0.05。
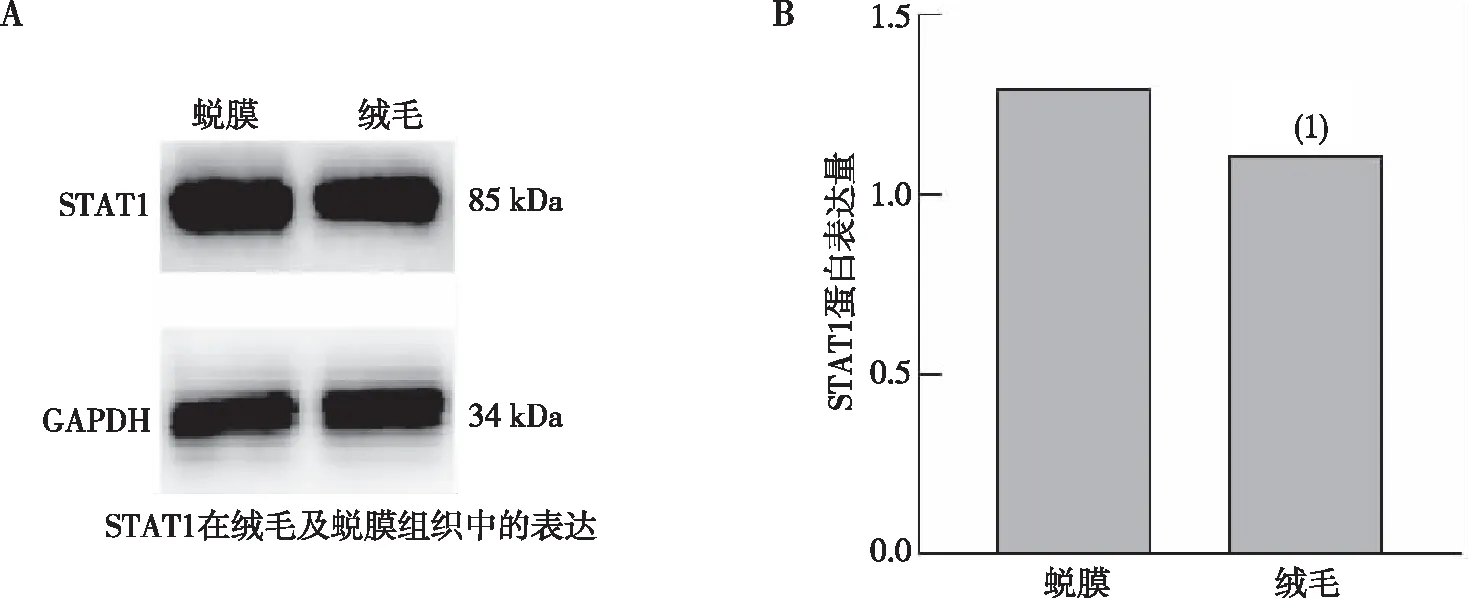
注:A为Western Blot检测在正常早孕蜕膜和绒毛组织中STAT1蛋白结果,B为正常早孕蜕膜和绒毛组织中STAT1蛋白表达的定量结果;(1)与蜕膜组织比较,P<0.05。
2.2 IL-6浓度与正常早孕绒毛和蜕膜组织中IDO、SHP-1、SHP-2及 STAT1蛋白的表达
Western blot结果显示,在不同浓度IL-6培养的早孕绒毛和蜕膜组织中, IL-6的浓度与 IDO、SHP-1、SHP-2及 STAT1蛋白的表达呈正相关(绒毛:P=0.043 3、0.021 3、0.005 5及0.011 9,r=0.995 4、0.998 9、0.999 9、0.999 7;蜕膜:P=0.045 4,0.034 5,0.045 6、0.044 6,r=0.994 9、0.997 1、0.994 9、0.995 1),IL-6上调IDO、SHP-1、SHP-2及 STAT1蛋白的表达(图3A、图3B、图3C、图4B);IDO 蛋白与SHP-1、SHP-2及 STAT1蛋白的表达呈正相关(绒毛,图3A和3C,P=0.001 1、0.046 8、0.022 6,r=0.802 2、0.735 9、0.547 5; 蜕膜,图4A和4C,P=0.001 4、<0.000 1、<0.000 1,r=0.786 3、0.944 4、0.944 1);STAT1蛋白与SHP-1、SHP-2蛋白的表达呈正相关(绒毛,图3A和3D,P=0.009 1、0.414 0,r=0.645 1、0.228 3; 蜕膜,图4A和4D,P=0.010 4、<0.000 1,r=0.632 3、0.918 7)。

注:A为Western Blot检测在不同浓度IL-6 培养下正常早孕蜕膜组织中 IDO、SHP-1、SHP-2及STAT1蛋白的结果,B为正常早孕蜕膜组织中 IDO、SHP-1、SHP-2及STAT1蛋白与加入IL-6浓度的相关性分析,C为正常早孕蜕膜组织中 IDO与SHP-1、SHP-2及STAT1蛋白相关性分析,D为正常早孕蜕膜组织中STAT1与SHP-1、SHP-2蛋白相关性分析。
3 讨论
在妊娠早期,IDO是维持母-胎免疫耐受的主要蛋白之一[5,9-11]。本课题组既往的研究表明,早孕妇女绒毛和蜕膜中的雌激素通过下调细胞因子信号转导抑制因子3(suppressors of cytokine signaling 3,SOCS3)[12]的表达和上调转化生长因子β(transforming growth factor-β,TGF-β)的表达来上调IDO的表达,进而诱导母-胎耐受[13]。然而,母-胎界面调控IDO表达的具体机制仍然不清。
早期的研究表明,IL-6可以通过上调树突状细胞中(DCs)[14]中的SOCS3(而不是SHPS)来降低IDO的表达,但最近的研究表明,使用小片段干扰核糖核酸(small interfering RNA,siRNA)抑制IL-6可以减少SKOV-3和NCI-H596细胞[15]中IDO mRNA和蛋白的表达以及犬尿氨酸的形成。有研究表明,在早孕妇女的绒毛及蜕膜中,IL-6可上调IDO的表达,但其上调IDO表达的分子机制仍需要进一步的研究[8]。
本实验对早孕妇女的绒毛及蜕膜组织进行检测,结果表明,人早孕绒毛和蜕膜组织均表达 IDO蛋白,这与以往的报道的类似[10,16-17]。 有学者发现,STAT1蛋白可在正常足月胎盘组织的滋养细胞中表达,并与该细胞的活力和侵袭力有关[18-19];本研究表明,STAT1 蛋白可在人的正常早孕绒毛和蜕膜组织表达。本研究中,在培养的正常早孕绒毛和蜕膜组织中,IL-6均能以剂量依赖性方式增加培养的绒毛和蜕膜中IDO和STAT1的表达,这与经典的IL-6信号通路显示的IL-6上调STAT1的表达一致[20-21]。人类IDO蛋白的组成成分较多,主要包括催化亚单位和非催化亚单位,分别为C 端和N 端,同时还包括一个对两者进行连接的环。IDO非催化亚单位含有两个功能性的免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motifs,ITIMs,基本结构为 I/V/L/SxYxxL/ V/F (I:Ile,V:Val,L:Leu ,S:Ser ,Y:Tyr,F:Phe)[22]。ITIM中的酪氨酸发生磷酸化后,可被含有SH2结构域的分子所结合[23];IDO通过其ITIM与SHP-1/2[22](含1个SH2结构域的蛋白质酪氨酸磷酸酶为SHP-1,含2个SH2结构域的蛋白酪氨酸磷酸酶为SHP-2)结合后,上调IDO自身的表达,SHP-1/2的表达越高,IDO的表达就越高。本研究表明,在早孕妇女的绒毛及蜕膜组织中,IL-6均能以剂量依赖性方式增加培养的绒毛和蜕膜中 SHP-1/2 的表达,且IDO的表达 与SHP-1、SHP-2及STAT1的表达呈正相关,STAT1的表达与SHP-1/2的表达呈正相关;提示IL-6同时上调IDO、SHP-1/2 和STAT1的表达,IL-6通过上调 STAT1的表达来上调的IDO的表达。基于STAT1可招募SHP-1/2并增加SHP1/2 的表达[24-25];SHP-1/2与IDO 结合后上调IDO的表达[21]; 本研究推测,在正常早孕绒毛和蜕膜组织中,IL-6可能通过上调STAT1的表达来上调SHP-1/2表达,进而上调IDO的表达。
