真菌病毒AfPV1对寄主黄曲霉抗压力耐受的影响*
2022-11-16江银辉杨碧刘翔田询禹文峰齐晓岚吴昌学
江银辉, 杨碧, 刘翔, 田询, 禹文峰, 齐晓岚, 吴昌学
(贵州医科大学 地方病与少数民族疾病教育部重点实验室 & 贵州省医学分子生物学重点实验室, 贵州 贵阳 550004)
真菌病毒是一类感染真菌的病毒,包含单分体病毒科(Totiviridae)、双分病毒科(Partitiviridae)、巨大双分核糖核酸病毒科(Megabirnaviridae)、产黄青霉病毒科(Chrysoviridae)、四分病毒科(Quadriviridae)、内源核糖核酸病毒科(Endornaviridae)及呼肠孤病毒科(Reoviridae)共7个科[1-2]。大多数真菌病毒感染寄主是隐形的、且不引起明显的症状,但是有些真菌病毒感染能够引起寄主明显的致病力减弱[3-4]。因此,这些能够引起寄主真菌致病力衰退的真菌病毒具有控制真菌引起的危害的潜力[5]。黄曲霉(Aspergillusflavus,A.flavus)是自然界中广泛存在的一种真菌,它可以感染许多农业作物,造成巨大的经济损失[6];此外,黄曲霉污染的食品含有大量的黄曲霉毒素B,可引起急性黄曲霉病或者肝细胞的癌变[7];同时黄曲霉也是一种条件致病菌,能够感染免疫缺陷病人[6]。目前,只有抗真菌药物用于治疗曲霉病,但抗真菌药物往往对人体有毒性,容易导致耐药菌株产生[8]。因此,迫切需要一种新的治疗策略来控制黄曲霉感染。真菌病毒已经用于植物病原真菌的生物防治,如Cryphonectriaparasitica、Sclerotiniasclerotiorum、Helminthosporiumvictoriae、Botrytiscinerea[9]。随着真菌病毒的报道越来越多,真菌病毒作为治疗人类真菌感染的治疗策略逐渐受到重视[10],一些能导致黄曲霉弱致病力的真菌病毒具有治疗黄曲霉感染的潜力[11]。在前期的研究中分离得到一种真菌病毒,对其进行测序分析并命名为aspergillus flavus partitivirus 1(AfPV1),能够选择性感染黄曲霉,使寄主发生表型衰退,但被真菌病毒AfPV1感染的黄曲霉对外界压力的变化尚未知[12],本研究对真菌病毒AfPV1感染对寄主黄曲霉抵抗外界压力的影响进行了系统研究。
1 材料与方法
1.1 实验材料
1.1.1菌株和细胞株 真菌病毒AfPV1(NCBI GenBank No. MK344768,No. MK344769,No. MK344770),LD-F1为脱病毒并具有嘧啶磺胺抗性标记的黄曲霉菌株,用病毒AfPV1感染黄曲霉菌株LDF1获得菌株LD-F1-b,以上黄曲霉菌株和病毒由本课题组前期获得。小鼠巨噬细胞RAW264.7,购自美国美国菌种保藏中心ATCC公司。人肺泡上皮细胞A549,为贵州医科大学分子生物学重点实验室王琴容老师惠赠。
1.1.2主要试剂和仪器 超净台购自苏州市金净净化设备科技有限公司,生化培养箱购自天津赛得利斯,冷冻高速离心机购自美国GENE公司,脂多糖(lipopolysaccharide,LPS)、Triton-X100和嘧啶磺胺均购自美国sigma公司,刚果红(congo red,CR)、氯化钠(NaCl)和过氧化氢(H2O2)均为国产分析纯,酶联免疫反应检测试剂盒(enzyme linked immunosorbent assay,ELISA)购于四正柏生物科技有限公司。
1.2 研究方法
1.2.1孢子悬液制备 将黄曲霉菌株LD-F1、LD-F1-b分别接种在马铃薯葡萄糖琼脂(potato dextrose agar,PDA;马铃薯200 g、葡萄糖20 g及琼脂粉13 g,蒸馏水定容至1 000 mL,121 ℃灭菌20 min)平板上30 ℃培养5 d,用10 mL含0.1%吐温80的磷酸盐缓冲液(phosphate buffered saline,PBS;pH为7.2~7.4)冲洗PDA平板表面,然后用灭菌的擦镜纸过滤掉菌丝,收取黄曲霉孢子,6 000 r/min离心10 min,弃上清,PBS(含0.1%吐温80)再次重悬,6 000 r/min离心,通过血细胞计数板计数,并根据实验要求调整曲霉分生孢子的浓度。
1.2.2黄曲霉对细胞壁压力、渗透压、氧化压力的测定 参考Takahashi-Nakaguchi等[13]的方法有改动。对照组为不含任何试剂的酵母葡萄糖固体培养基(yeast glucose solid medium,YGM;酵母膏1 g,葡萄糖10 g,琼脂15 g,蒸馏水定容至1 000 mL,121 ℃灭菌20 min);细胞壁压力组为含有100 mg/L、150 mg/L CR的YGM固体培养基;透压压力组为含有0.8 mol/L、1.2 mol/L、1.6 mol/L NaCl的YGM固体培养基;化压力组为含有4 mmol/L、8 mmol/L H2O2的YGM固体培养基。取新鲜的孢子悬液10 μL(浓度为1×106CFU/mL),分别接种到以上培养基的9 cm培养皿上,于30 ℃培养箱中培养5 d,每天测量菌落直径并记录。生长抑制百分率=[(对照组直径-实验组直径)/对照组直径]×100%。
1.2.3黄曲霉对紫外线耐受的测定 取30 μL黄曲霉孢子悬液(浓度为1×103CFU/mL)接种在含有沙氏固体培养基(sabouraud dextrose agar,SDA;蛋白胨10 g,葡萄糖40 g,琼脂13 g,蒸馏水定容至1 000 mL,121 ℃灭菌20 min)的9 cm培养皿上,涂布均匀,并在60 W/cm2的紫外线下照射30 s、60 s、90 s、120 s、150 s、180 s,然后置于30 ℃培养箱中,黑暗条件下培养48 h后进行菌落计数,对照组不予照射。紫外杀伤率=[(对照组菌落数-紫外对照组菌落数)/对照组菌落数]×100%。
1.2.4黄曲霉对巨噬细胞杀灭耐受的测定 参考Lau等[14]的方法有改动。将巨噬细胞RAW264.7用完全培养基(含有10%胎牛血清)重悬铺在6孔培养板(4×105个细胞/孔)、37 ℃、5%CO2细胞培养箱中培养12 h、弃培养液,用PBS洗2遍,每孔重新加入2 mL完全培养基。将制备黄曲霉分生孢子悬液加入上述6孔板中,每孔107个孢子,37 ℃、5%CO2细胞培养箱中孵育2 h、弃培养液,加PBS清洗细胞5次(清除细胞外未被黏附的分生孢子),每孔重新加入2 mL完全培养基。将6孔板放回细胞培养箱中继续培养1 h,对照组不予培养,然后以终浓度为0.2% Triton-X100室温处理20 min裂解细胞,梯度稀释后接种于SDA培养基上,30 ℃培养48 h,进行菌落计数。孢子死亡百分率=[(0 h菌落数-1 h菌落数)/0 h菌落数]×100%。
1.2.5黄曲霉分子孢子对人肺癌上皮细胞的黏附 参考Takahashi-Nakaguchi等[13]的方法有改动。将人肺癌上皮细胞A549用用完全培养基(含有10%胎牛血清)重悬铺在6孔培养板(1×105细胞/孔),37 ℃、5% CO2细胞培养箱中培养至细胞融合。将黄曲霉分生孢子悬液,于上述6孔板中加入102个孢子,37 ℃、5%CO2细胞培养箱中孵育2 h弃上清培养液,加PBS清洗细胞3次(除去细胞外未被黏附的分生孢子),每孔加5 mL SDA培养基,30 ℃培养26 h,进行菌落计数。孢子黏附百分率=(每孔菌落数/每孔加入102个孢子)×100%。
1.2.6黄曲霉对巨噬细胞一氧化氮(NO)和炎症因子产生的影响 将巨噬细胞RAW264.7重悬铺在6孔培养板(2×106细胞/孔),37 ℃、5%CO2细胞培养箱中过夜培养,每孔加入4×106个孢子与细胞共培养6 h;阳性对照为终浓度为1 mg/L的LPS处理,阴性对照为PBS处理。根据格里斯(Griess)反应,使用NO检测试剂盒检测巨噬细胞产生的NO,ELISA试剂盒测定细胞因子IL-10、IL-6、IL-1β、IFN-β、TNF-α。
1.3 统计学分析
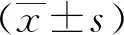
2 结果
2.1 对细胞壁压力、渗透压、氧化压力的耐受
为了观察AfPV1对寄主黄曲霉抗逆性的影响,测定了菌株LD-F1-b和LD-F1对细胞壁压力、渗透压、氧化压力的耐受。研究发现,AfPV1感染使寄主黄曲霉对氧化胁迫和渗透胁迫的敏感性增强(图1A和1B),但对细胞壁胁迫抗性(CR)没有显著影响(图1C)。

注:A~C为H2O2、Nacl、CR不同浓度的生长抑制率;(1)与菌株LD-F1比较,P<0.001。
2.2 对紫外线的耐受能力
AfPV1的感染减弱了寄主黄曲霉对紫外线的耐受。与LD-F1相比,LD-F1-b对紫外线照射极为敏感,当紫外线照射时间达到150 s时,LD-F1-b分生孢子的死亡率为100%(图2)。
注:(1)与菌株LD-F1比较,P<0.001。
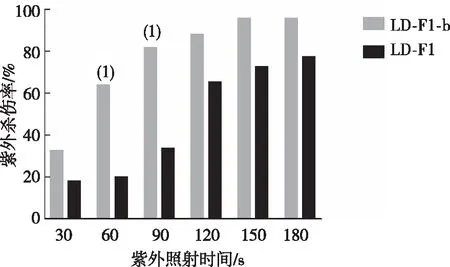
2.3 对巨噬细胞杀灭的耐受情况
巨噬细胞吞噬3 h后的黄曲霉的分生孢子死亡率均高于巨噬细胞吞噬1 h后的死亡率(图3)。在巨噬细胞吞噬1 h或3 h后,LD-F1-b分生孢子的死亡率高于LD-F1。见图3。结果表明病毒AfPV1降低了寄主黄曲霉抵抗巨噬细胞杀灭的能力。
注:(1) 与菌株LD-F1比较,P<0.05。
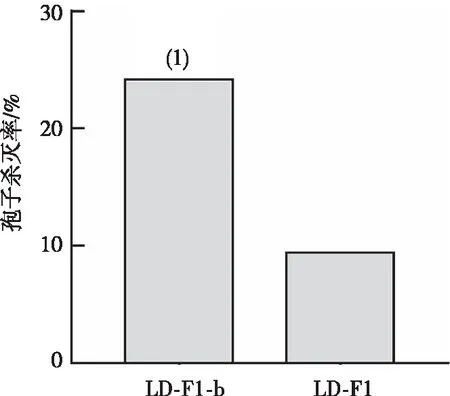
2.4 对人肺腺癌细胞的黏附能力
与LD-F1相比,LD-F1-b的分生孢子对肺上皮细胞A549的黏附能力降低(图4),提示病毒AfPV1降低了黄曲霉孢子的对肺上皮细胞的黏附能力。
注:(1)与菌株LD-F1比较,P<0.001。
2.5 对巨噬细胞产生NO和细胞因子的影响
在巨噬细胞与黄曲霉分生孢子共培养后,检测了巨噬细胞产生NO和细胞因子TNF-α、IFN-β、IL-1β、IL-6和IL-10。结果表明,阳性对照组LPS刺激巨噬细胞产生了TNF-α、IFN-β、NO、IL-1β、IL-6、IL-10,但黄曲霉不能诱导巨噬细胞产生NO和IL-6;LD-F1-b能诱导巨噬细胞产生IL-10、IFN-β,而在LD-F1处理组没有观察到IL-10、IFN-β的产生。与LD-F1相比,LD-F1-b诱导巨噬细胞产生更高浓度TNF-α。在IL-1β的检测中,LD-F1诱导细胞产生IL-1β的浓度高于LD-F1-b。见图5。
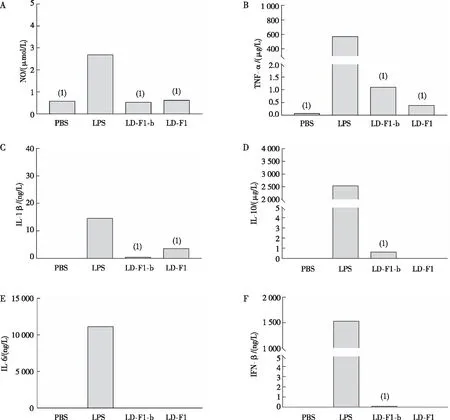
注:A~F分别为PBS、LPS、LD-F1-b、LD-F1对巨噬细胞产生NO和细胞因子TNF-α、IFN-β、IL-1β、IL-6及IL-10的影响;(1)与阳性对照LPS处理比较,P<0.001。
3 讨论
随着大量使用广谱抗生素,对肿瘤患者进行放疗化疗,以及对器官和干细胞移植的患者免疫抑制剂的使用,免疫力低下人群逐渐增多,导致曲霉病的发生率逐年升高,而黄曲霉是引起曲霉病的第二大病原菌[15]。而目前用于治疗曲霉病的抗真菌药物有限。目前,只有3类抗真菌药物用于治疗曲霉病,如多烯类(两性霉素B)、三唑类(伊曲康唑、伏立康唑和泊沙康唑)和棘白菌素类(卡泊芬净和米卡芬净)[8,16]。此外,抗真菌药物对人体有一定的毒性,而且随着黄曲霉对现有抗真菌药物产生耐药性,使其治疗效果不理想[16]。真菌病毒是一种能够选择性感染真菌的病毒,有些真菌病毒能够引起寄主致病力衰退,因此具有治疗病原真菌感染的潜力[10]。本研究前期得到一种能够引起A.flavus表型严重衰退的真菌病毒AfPV1[12]。本研究中,真菌病毒AfPV1的感染使寄主黄曲霉对渗透胁迫、氧化胁迫和紫外线胁迫压力更敏感。而这些胁迫压力也被发现与黄曲霉的毒力因子密切相关[17]。由此,本研究推测真菌病毒AfPV1也可能降低寄主黄曲霉的致病力,具有一定的治疗潜力。
免疫缺陷是曲霉感染的重要因素,而免疫系统抵抗感染主要是通过吞噬细胞来清除曲霉菌[18]。此外,真菌病毒AfPV1降低了分生孢子对宿主上皮细胞的黏附,降低了分生孢子被巨噬细胞杀灭的耐受。因此免疫细胞可能更容易清除掉真菌病毒AfPV1感染的黄曲霉孢子。在本研究中,真菌病毒AfPV1感染菌株的孢子诱导巨噬细胞产生更高浓度TNF-α的趋势,但其机制有待进一步研究。IL-6可以趋化和刺激中性粒细胞,通过自分泌和旁分泌方式刺激细胞生长、促进细胞分化,而曲霉上调IL-6 mRNA水平具有剂量效应依赖[19]。本研究中,黄曲霉孢子处理组未检测到IL-6,可能为共培养的孢子剂量偏低,刺激量不足。有研究表明,炎症因子IL-1β在烟曲霉的感染过程中,虽然没有直接参与对孢子和菌丝的清除和杀灭,但参与炎症和免疫反应相关细胞的分化中发挥着重要的作用,其中包括与抗原协同作用、促进B 细胞生长和分化、吸引中性粒细胞、引起炎症介质释放等[20]。IL-10是免疫统中抗炎的细胞因子,参与调节细胞的生长与分化,调节机体免疫平衡[21]。在过敏性支气管肺曲霉病中,IL-10可以抑制炎症反应,发挥了抗炎、抗免疫的保护性作用,防止过度的炎性损伤[22]。黄曲霉感染后,本研究只检测到低剂量的NO。在细菌感染过程中,IFN-β对宿主是有害的,其限制了产生保护性IL-17的T细胞反应的发展[23]。有结果表明,IFN的表达水平不仅受真菌活性程度的影响,而且可能与免疫反应的程度有关。在本研究中,巨噬细胞易于产生TNF-α炎症因子,但真菌病毒AfPV1感染黄曲霉会导致巨噬细胞产生更多的TNF-α。
