牛奶蛋白过敏婴儿肠道菌群动态变化特点
2022-11-16李心悦李在玲
李心悦 王 硕 张 华 李在玲
北京大学第三医院 1.儿科,2.临床流行病学研究中心(北京 100191)
牛奶蛋白过敏(cow’s milk protein allergy,CMPA)是儿童早期最常见的食物过敏之一,在3岁以下的儿童中发病率高达2%~3%[1]。CMPA影响儿童正常生长发育,加重家庭的经济和心理负担。食物过敏的发生机制是肠道黏膜无法对食物抗原建立正常的免疫耐受,可能与肠道微生态失衡密切相关[2]。研究表明,CMPA 患儿与健康儿童的肠道菌群在多样性、丰度及构成等方面均存在差异[3-4]。众所周知,肠道菌群是动态发展的,生命早期的肠道菌群变化似乎会影响食物过敏的结局[5-6]。但目前多为横断面研究,因此需要对CMPA 患儿进行长期随访。本研究通过监测CMPA 患儿对牛奶蛋白的耐受情况,分析此过程中粪便菌群的变化,为明确肠道微生物改变与CMPA 的关系提供线索,为寻找缩短CMPA病程的措施提供理论依据。
1 对象与方法
1.1 研究对象
选取2020年9月至2021年3月在北京大学第三医院儿科门诊就诊,诊断为CMPA 的患儿为研究对象,纳入标准:①年龄0~12月;②符合CMPA诊断标准[7-9]。排除标准:具备以下任意一项则排除出组,①无CMPA 相关症状;②随访过程中应用抗生素、全身性糖皮质激素、益生菌、益生元等药物;③家中饲养宠物;④患有急慢性疾病,如感染性疾病、肝肾功能不全、血液病、自身免疫性疾病、先天性疾病、遗传代谢性疾病等。选择同期健康体检的儿童作为对照组,纳入标准:①年龄0~12月;②无过敏相关临床表现。排除标准:具备以下任意一项则排除出组,①父母任意一方有过敏史;②随访过程中应用抗生素、全身性糖皮质激素、益生菌、益生元等药物;③家中饲养宠物;④家长依从性差。
在随访过程中,根据牛奶蛋白口服食物激发试验(oral food challenge,OFC)结果,将阴性的CMPA儿童归入耐受组,阳性则归入过敏组。
本研究通过北京大学第三医院伦理审查(2020伦审第332-01号),家属签署知情同意书。
1.2 方法
1.2.1 CMPA 诊断标准 采用2017、2019 年《国际牛奶蛋白过敏基层医疗指南》(International Milk Allergy in Primary Care,iMAP)[7-8]及2017年中国《食物过敏相关消化道疾病诊断与管理专家共识》[9]提出的CMPA诊断标准:①摄入牛奶或奶制品后出现以下1项或多项临床表现,包括腹泻、便血、吐奶、拒奶、皮疹、咳嗽、喘鸣、哭闹不安、睡眠不好、体质量增长缓慢;②牛奶蛋白回避后症状减轻或消失,再引入后症状加重或再次出现;③以下实验室检查有1项或多项阳性,血清过敏原特异性IgE(>0.35 kU/L),开放性口服牛奶蛋白激发试验[10],皮肤点刺试验(鲜奶或配方奶的风团直径较阴性对照≥3 mm)。
1.2.2 随访 CMPA组儿童予氨基酸奶粉喂养,并进行为期6个月的随访,分别在第0、2周及第1、3、6个月时留取粪便,粪便采集于无菌冻存管后,2 h内置-80 ℃保存备用。随访下列内容:评估临床症状,有无添加辅食,有无应用抗生素、全身性糖皮质激素、益生菌、益生元等药物。在第1、3、6个月时,若患儿症状减轻或消失则进行牛奶蛋白OFC以评估免疫耐受是否建立。对照组儿童入组时留取粪便1次。
1.2.3 肠道菌群16SrRNA高通量测序 提取研究对象粪便样本基因组DNA,使用1%的琼脂糖凝胶电泳和NanoDrop2000检测DNA的提取质量、浓度和纯度;合格后使用338F(5'-ACTCCTACGGGAGGC AGCAG-3')和806 R(5'-GGACTACHVGGGT WTCTAAT-3')对16 SrRNA 基因V 3-V 4 可变区进行 PCR 扩增,采用2%琼脂糖凝胶电泳和QuantusTMFluorometer(Promega,USA)对产物进行定量。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,美国)建库。合格后予Illumina Miseq PE 300/NovaSeq PE250测序仪测序。
1.2.4 分类学分析 采用fastp 软件对原始测序序列进行质控,使用FLASH 软件进行拼接。使用UPARSE 软件根据97%的相似度对序列进行 OTU聚类并剔除嵌合体。利用RDP分类学注释工具(RDA classifier)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库,设置比对阈值为70%。
1.2.5 生物信息学分析 Alpha 多样性分析反映微生物群落的丰富度和多样性。其中,ace、chao、shannon、shannoneven、pd等指数能够反映群落丰富度、多样性和均匀度。Beta多样性反映不同样本群落结构的相似性或差异关系。
1.3 统计学分析
采用SPSS 22.0统计软件进行数据分析。计量资料符合正态分布的以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布的以中位数(P25~P75)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher 精确概率法检验。在基线水平对两组样本进行基于Bray-Curtis距离算法的主坐标分析(principal co-ordinates analysis,PCoA),组间群落组成差异采用Anosim检验。LEfSe(linear discriminant analysis effect size)分析用于检测不同组间的物种丰度差异,获得显著差异物种后再采用线性判别分析(linear discriminant analysis,LDA)来估算每个物种丰度对差异效果影响的大小。多个相关样本非参数检验应用Friedman检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
CMPA组符合入选标准共98例,其中失访或中途退出24例,家中饲养宠物1例,应用抗生素、全身性糖皮质激素、益生菌、益生元23例,最终入组50例。对照组78例,失访或中途退出16例,其中父母有过敏史24例,应用抗生素、全身性糖皮质激素、益生菌、益生元18例,最终入组20例。
CMPA 组与对照组之间月龄、性别、出生体重、分娩方式、入组时喂养方式差异无统计学意义(P>0.05)。两组儿童基线资料具有可比性,见表1。

表1 对照组和CMPA组一般资料比较
2.2 CMPA组与对照组肠道菌群Alpha及Beta多样性分析
比较两组基线水平的肠道菌群Alpha多样性指数发现,CMPA组的Shannon指数及Shannoneven指数较对照组增高,差异有统计学意义(P<0.05)。见表2。Anosim检验结果显示两组样本间群落组成差异有统计学意义(R=0.26,P=0.001)。见图1。
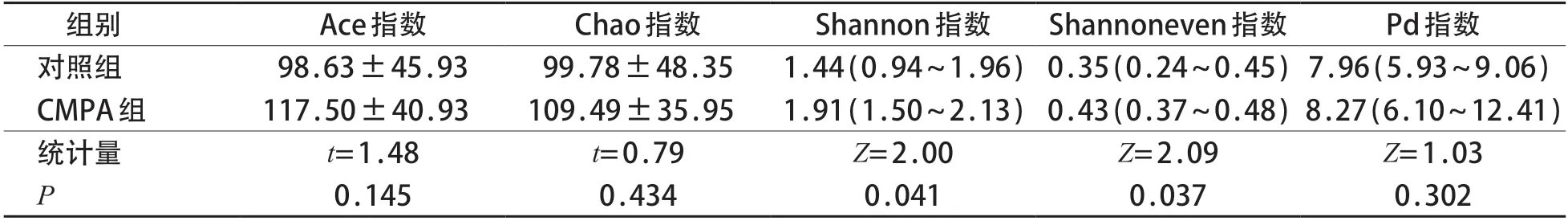
表2 两组Alpha多样性指数比较[M(P25~P75),(x±s)]

图1 两组Beta 多样性分析结果(主坐标分析)
2.3 CMPA组与对照组肠道菌群物种组成
对照组在门水平上相对丰度较高的菌群依次为放线菌门、厚壁菌门、变形菌门及拟杆菌门;CMPA组放线菌门的相对丰度明显降低,厚壁菌门的相对丰度升高。属水平上,对照组中双歧杆菌属为优势菌群,其他相对丰度较高的菌群为布劳特菌属、克雷伯菌属、肠球菌属、梭菌属、链球菌属、埃希菌属、瘤胃球菌属、乳杆菌属;而CMPA组中,双歧杆菌属不再是优势物种,除了梭菌属的相对丰度较高外,肠球菌、链球菌、克雷伯菌、埃希菌属等条件致病菌的相对丰度升高。见图2。

图2 CMPA 组与对照组物种组成分析结果
通过LEfSe多级物种差异分析及LDA线性判别分析找出两组的差异物种,结果显示,对照组中放线菌门、双歧杆菌科、巴氏杆菌科、双歧杆菌属、流感嗜血杆菌属、普氏粪植杆菌属为差异有统计学意义的物种(LDA=4.07~5.35,P<0.05),其中双歧杆菌科影响较大。CMPA 组中厚壁菌门、芽孢杆菌纲、梭菌纲、肠球菌科、消化链球菌科、肠球菌属、梭菌属、罗氏菌属(Rothia)、Intestinibacter、瘤胃球菌属为差异有统计学意义的物种(LDA=3.93~5.24,P<0.05),其中厚壁菌门、芽孢杆菌纲、梭菌纲、肠球菌科影响较大,见图3。
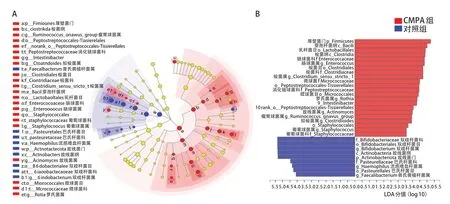
图3 CMPA 组与对照组物种差异分析结果
2.4 CMPA组儿童治疗及转归
随访至1个月时,50例患儿检测OFC,阴性12例,提示24.0 %的患儿牛奶蛋白耐受;随访至3个月时,OFC 阳性的38 例患儿再次检测OFC,转为阴性12例,共48.0%患儿建立免疫耐受;随访至6个月时,OFC仍阳性的26例复查OFC,阴性14例,共76.0%患儿建立免疫耐受,还有12例(24.0%)患儿仍然存在CMPA。
2.5 CMPA 儿童治疗过程中耐受组与过敏组肠道菌群物种差异
随访2 周及1 个月时两组间未出现差异物种。随访3 个月时两组开始出现差异物种,主要以过敏组中厚壁菌门、梭菌纲、毛螺菌科相对丰度高为特点(LDA=5.11~5.16,P<0.01)。见图4。这种差异在随访6 个月时进一步增大,过敏组中除了前述的厚壁菌门、梭菌纲、毛螺菌科外,还包括Erysipelatoclostridiaceae、瘤胃球菌属、毛霉菌属(Erysipelatoclostridium),均为存在统计学意义的物种(LDA=4.22~5.19,P<0.05);同时,耐受组中放线菌纲、双歧杆菌科、葡萄球菌科、双歧杆菌属、葡萄球菌属为差异有统计学意义的物种(LDA=4.34~5.14,P<0.05),其中放线菌纲、双歧杆菌科、双歧杆菌属相对丰度明显高于过敏组。见图5。

图4 耐受组与过敏组随访1、3 个月物种差异分析结果
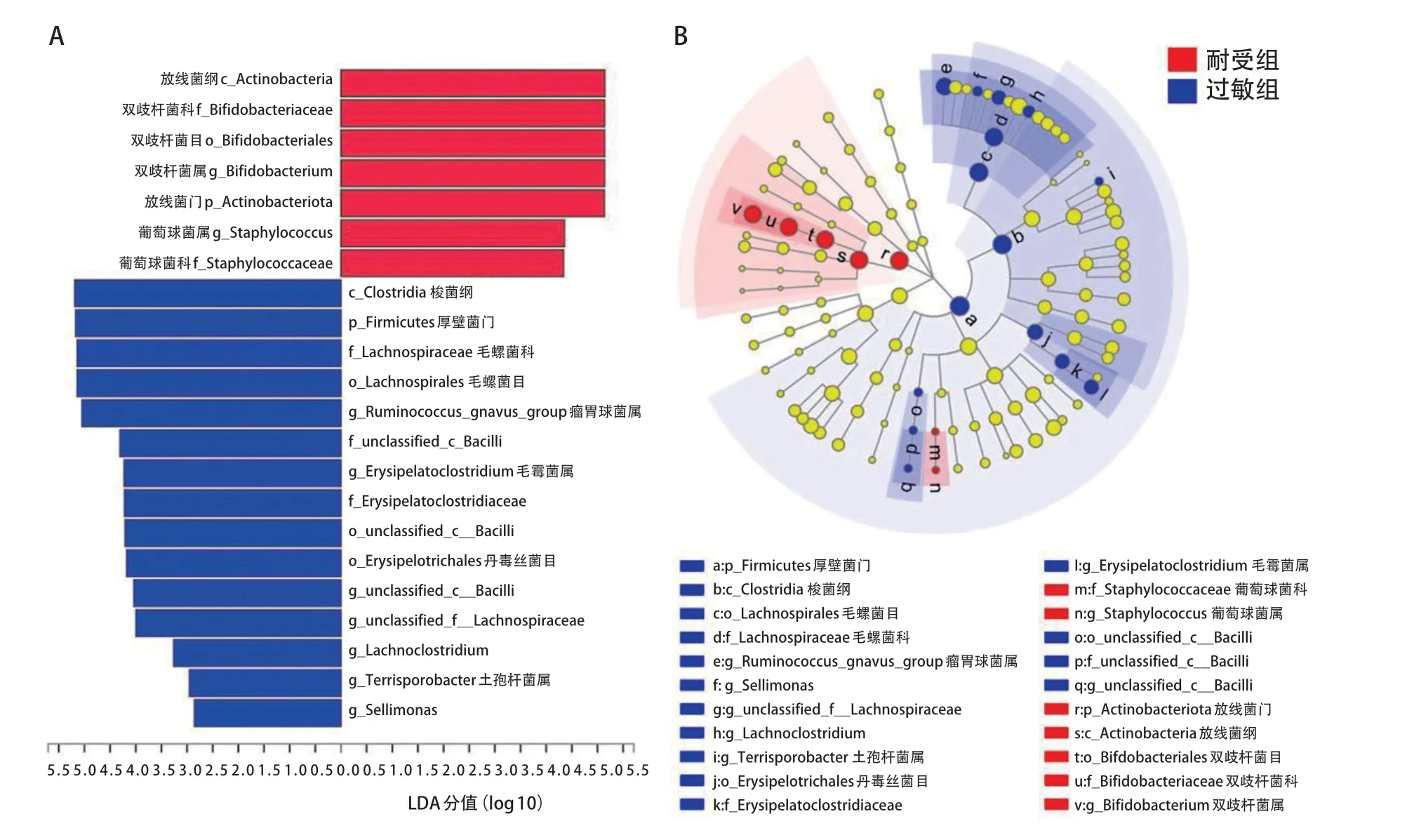
图5 耐受组与过敏组半年后物种差异分析结果
2.6 CMPA耐受组患儿肠道菌群动态变化
耐受组在属水平上随着时间延长丰度逐渐增加的物种有:双歧杆菌属(P<0.001)、瘤胃球菌属(P=0.006)、布劳特菌属(P<0.001)、普氏粪植杆菌属(P=0.002);随着随访时间延长丰度减少的物种有:肠球菌属(P<0.001)、克雷伯菌属(P<0.001)、肠杆菌属(P=0.004)。提示双歧杆菌属等益生菌的丰度增加,机会致病菌的丰度逐渐减少。见图6。
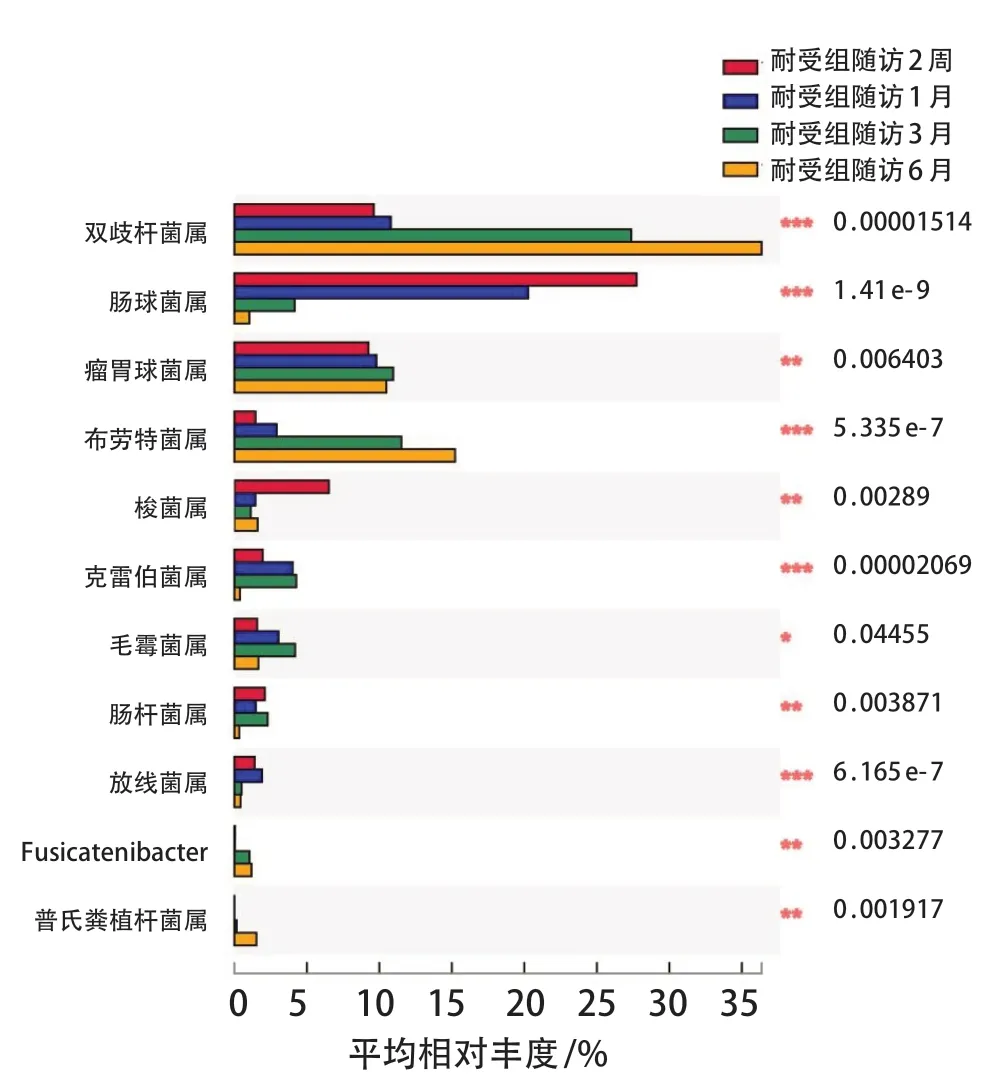
图6 耐受组随访过程中物种差异分析
3 讨论
肠道微生物群的形成发生在生命的早期,其成熟速度具有个体差异,是动态可变的[11-13]。12月龄内的婴儿是CMPA 的高发人群,肠道菌群在该年龄段的影响因素相对可控。为深入了解CMPA患儿在生命早期以及免疫耐受逐渐建立的过程中肠道菌群的动态变化特点,本研究纳入50 例12 月龄内的CMPA患儿,与同期的20例健康儿童作对照。Alpha多样性分析表明,CMPA 组肠道微生物群落的均匀度及多样性均较对照组显著增高,与既往研究结果相同[4]。提示CMPA组肠道菌群成熟度可能高于健康儿童,而肠道微生物群落提前成熟可能并不利于肠道对食物免疫耐受的早期建立。
Beta多样性分析提示两组儿童肠道微生物群落构成存在显著差异。对照组以放线菌门为主,其中双歧杆菌科占绝对优势;CMPA组放线菌门、双歧杆菌科的相对丰度明显降低,反而是厚壁菌门的相对丰度升高。其中,CMPA组中肠球菌科等机会致病菌的丰度明显增加,提示CMPA 患儿肠道微生物群落组成处于失衡状态。相关研究也观察到相似的变化,但不同的是,CMPA 组中增多的厚壁菌门主要为毛螺菌科的富集;而低双歧杆菌科/毛螺菌科比例的微生物群组成似乎与小鼠肠道免疫系统向Th2方向偏移相关[4,14]。本研究CMPA 组患儿未出现低双歧杆菌科/毛螺菌科比例的微生物组成变化,但在后续动态对比过敏组与耐受组患儿的肠道菌群差异中发现了这种微生物组成特点。
CMPA患儿过敏组与耐受组的肠道菌群组成差异随着时间延长逐渐发生。在随访3 个月时开始出现,以过敏组中厚壁菌门、梭菌纲、毛螺菌科相对丰度高于耐受组为特点;随访6个月时,这种差异进一步加大。过敏组中除了前述差异物种外,瘤胃球菌属的相对丰度也偏高;同时,耐受组中放线菌门、双歧杆菌科、双歧杆菌属相对丰度开始高于过敏组。由此可见,与耐受组相比,过敏组肠道菌群逐渐出现低双歧杆菌科/毛螺菌科的表现。
发现过敏组与耐受组的肠道微生物群落组成差异后,本研究进一步探究耐受组在建立牛奶蛋白免疫耐受的过程中肠道菌群的动态变化。在属水平上,观察到肠球菌属、克雷伯菌属、肠杆菌属等条件致病菌的相对丰度呈下降趋势。而双歧杆菌属、布劳特菌属、瘤胃球菌属、普氏粪植杆菌属等的相对丰度呈上升趋势。查阅文献,在耐受组相对丰度逐渐增加的菌种中,除了双歧杆菌为产乙酸菌外,其余3种均为产丁酸菌[15-17]。与本研究类似,相关研究发现8岁时耐受牛奶蛋白的儿童3~6个月时肠道微生物群中厚壁菌门、梭菌纲富集[6]。但是该研究并未描述属水平差异,也未追踪差异菌群动态变化。另有研究发现,治疗后的CMPA患儿肠道中布劳特菌属、罗斯菌属等产丁酸菌的相对丰度增加,认为可通过增加产丁酸菌的丰度促进免疫耐受的建立[15]。其作用机制可能为丁酸盐可促进黏蛋白表达、影响紧密连接蛋白的功能,从而加固肠道上皮屏障[18-19];可诱导Foxp3基因的表达,影响树突状细胞的功能,最终促进调节性T细胞的分化和产生[20-21]。除了报道过的布劳特菌属,本研究在耐受组中还观察到包括瘤胃球菌属、普氏粪植杆菌属在内的其他几种产丁酸菌群相对丰度逐渐增加。
值得注意的是,在过敏组中也存在产丁酸菌群的增多。本研究过敏组中瘤胃球菌属的相对丰度反而高于耐受组,这种差异出现在随访后期。瘤胃球菌是革兰阳性厌氧菌,可以代谢产生丁酸盐并且刺激黏蛋白的产生和降解,这对维持完整肠道上皮屏障至关重要,能够降低过敏性疾病发生的风险[22-23]。可见,单纯产丁酸菌群的富集无法使CMPA 患儿对牛奶蛋白产生免疫耐受,还存在其他因素与产丁酸菌群共同参与到这个复杂的过程中。值得注意的是,两组儿童都存在产丁酸菌群的富集,但仅在耐受组中观察到双歧杆菌属的显著增多。这表明双歧杆菌与产丁酸菌群可能在调节免疫耐受方面存在潜在协同作用。查阅文献发现,双歧杆菌能通过使T细胞极化向Th1和Treg倾斜来减少婴儿肠道炎症[24];能调节肠道菌群组成,增加益生菌属的比例,最终减轻婴幼儿牛奶过敏症状[25]。因此,本研究提示产丁酸菌可以诱导免疫耐受,但还需要与双歧杆菌等其他因素起协同作用,其具体机制有待阐明。
本研究借助高通量测序动态监测CMPA儿童在诊治过程中肠道菌群的变化,发现了CMPA 与肠道微生态的密切联系,并对双歧杆菌及产丁酸菌群在牛奶蛋白耐受过程中的变化趋势及潜在作用机制进行分析,为诱导牛奶蛋白耐受、缩短CMPA治疗时间提供更可靠的思路。但本实验样本量偏少,随访时间较短,今后可进行大样本及多中心研究。可通过宏基因组测序和代谢组学等方法更深入地探究肠道菌群及其代谢产物参与CMPA转归的具体作用机制。
