苯并芘促进FHIT、CDH13基因启动子区甲基化及机制研究
2022-11-15武岳张梦迪李君王冬雪白图雅吕晓丽胡玉霞高峰周树宏李京慧范兴业常福厚王光内蒙古医科大学附属医院呼和浩特0000内蒙古医科大学药学院呼和浩特000内蒙古医科大学新药安全评价研究中心呼和浩特000内蒙古自治区新药筛选工程研究中心呼和浩特000内蒙古医科大学基础医学院呼和浩特000上海中医药大学交叉科学研究院上海00
武岳,张梦迪,李君,王冬雪,白图雅,吕晓丽,胡玉霞,高峰,周树宏,李京慧,范兴业,常福厚,王光*(.内蒙古医科大学附属医院,呼和浩特 0000;.内蒙古医科大学药学院,呼和浩特 000;3.内蒙古医科大学新药安全评价研究中心,呼和浩特 000;4.内蒙古自治区新药筛选工程研究中心,呼和浩特 000;5.内蒙古医科大学基础医学院,呼和浩特 000;6.上海中医药大学交叉科学研究院,上海 00)
肝癌是世界上常见的恶性肿瘤之一,我国肝癌的发病率和病死率均居世界首位[1]。肝癌的发生也和其他肿瘤一样是环境因素和遗传因素共同作用的结果,已有研究表明肿瘤相关基因启动子异常甲基化可以作为肿瘤发生的敏感生物标志物[2-3]。
DNA 甲基化为DNA 化学修饰的一种形式,能够在不改变DNA 序列的前提下,改变遗传表现。脆性组氨酸三联体(fragile histidinetriad,FHIT)基因是一个抑癌基因[4]。T-钙黏蛋白(T-cadherin/H-cadherin,CDH13)是非典型的钙黏素家族中的一员[5]。研究表明FHIT、CDH13可能成为恶性肿瘤风险评估和监测预后的新的分子生物学标志物[6]。此外,本课题组前期研究发现FHIT、CDH13基因甲基化在肝癌患者中高表达,提示FHIT、CDH13基因甲基化可能与肝癌的发生发展关系密切[7]。
苯并芘[benzo(a)pyrene,BaP]是一种常见的环境污染物。在流行病学研究中,环境中高水平的BaP 暴露会增加肝细胞癌(human hepatocellular carcinoma,HCC)的风险,表明BaP 可能是诱发HCC 的原因之一[8]。但是关于BaP 作用于HepG2细胞对FHIT、CDH13基因启动子区甲基化的影响尚未见报道。本研究选取DNA 甲基转移酶抑制剂5-氮杂-2'-脱氧胞苷(5-Aza-2'-deoxycytidine,5-Aza-CdR)作为阳性对照,通过MSP 法检测BaP 对FHIT、CDH13基因甲基化的情况,同时采用RT-qPCR 和Western blot 法检测BaP 对FHIT、CDH13、DNMT1、Sp1 mRNA 和蛋白表达的影响并对其机制进行初步探讨,为肝癌分子标记物的筛选及致癌机制的探讨提供参考。
1 材料
BaP(美国Sigma 公司),DMEM 高糖培养基、胎牛血清(美国Gibco 公司),DNA 提取酚试剂(中国Solarbio 公司),5-Aza-CdR(中国上海源叶公司),EZ DNA Methylation-Gold 试剂盒(中国南京博尔迪生物有限公司),甲基化特异性PCR 试剂盒(中国天根生化科技有限公司),FHIT、CDH13、DNMT1、Sp1 和β-actin 兔单克隆抗体(英国Abcam 公司),RevertTra Ace qPCR RT kit、SYBR Green Realtime PCR Master Mix试剂盒(日本TOYOBO 公司)。人肝癌细胞株HepG2(北京协和基础医学研究所)。
2 方法
2.1 细胞培养及处理
人肝癌HepG2 细胞培养于含10%胎牛血清的DMEM 培养基中,置于含5% CO2的37℃培养箱中常规培养,倒置显微镜观察细胞生长情况,当细胞达到80%~90%融合时,胰蛋白酶消化制成细胞悬液后以适当的密度接种于细胞培养6 孔板中并摇匀。选取DNA 甲基转移酶抑制剂5-Aza-CdR 作为阳性对照组,实验分为对照组、阳性对照组及不同浓度BaP(0.1、1、10 μmol·L-1)组。分别用0.1、1、10 μmol·L-1BaP,5-Aza-CdR 处理细胞24 h,对照组不加任何药物处理。然后收集细胞进行下一步的检测实验。
2.2 甲基化特异性PCR(MSP)法检测FHIT、CDH13 基因甲基化情况
采用酚氯仿法提取DNA,根据DNA Methylation-Gold 试剂盒说明书对DNA 进行甲基化修饰,并进行扩增,扩增引物见表1,PCR 条件如下:变性(95 ℃,5 min),退火(94℃ 20 s、64℃ 30 s、72 ℃ 20 s,35 个循环),延伸(72 ℃10 min)。PCR 产物在2%琼脂糖凝胶中电泳分析,应用UVP 凝胶成像系统观察电泳结果。

表1 MSP 中FHIT、CDH13 基因的引物序列、产物片段大小及退火温度Tab 1 Primer sequences of FHIT and CDH13 genes in MSP,product fragment size and annealing temperature
2.3 荧光实时定量PCR(RT-qPCR)法检测FHIT、CDH13、DNMT1、Sp1 mRNA 表达情况
将细胞按“2.1”项下方法处理后,收集细胞,按RNA 提取试剂盒提取细胞总RNA,使用Nanodrop2000 测定RNA 纯度及浓度,根据反转录试剂盒说明书合成cDNA。引物序列见表2,使用RT-qPCR 法进行扩增,反应程序如下:95℃2 min,90℃ 20 s,55 ℃ 30 s,68 ℃ 50 s(40 个循环),采用2-△△CT法计算检测基因mRNA 的相对表达量,实验重复3 次。

表2 FHIT、CDH13、DNMT1 及Sp1 基因的引物序列Tab 2 Primer sequence of FHIT,CDH13,DNMT1,and Sp1 gene
2.4 Western blot 法检测FHIT、CDH13、DNMT1、Sp1 蛋白表达情况
将细胞处理24 h 后,蛋白裂解液裂解细胞提取各组细胞总蛋白,BCA 法测定蛋白质浓度,定量后进行 SDS-PAGE 垂直电泳,湿法PVDF 转膜,封闭液封闭20 min,在4℃下一抗(1∶5000)孵育过夜,TBST 清洗3 次,二抗避光孵育1 h,红外荧光扫描成像系统检测,扫描后应用Image J软件进行分析。
2.5 统计分析
采用SPSS 22.0 对数据进行统计分析,计量资料组间差异采用单因素方差分析法进行检验,数据采用均数±标准差(±s)来表示,并采用Graphpad Prism 统计分析软件作图,P<0.05 表示差异具有统计学意义。
3 结果
3.1 BaP 对FHIT、CDH13 基因甲基化的影响
FHIT基因扩增对接基因中原始序列的位置为:195—283(来自GenBank 序列号U76263),甲基化岛5 个[9]。CDH13扩增对接基因中原始序列的位置为-265—-247,甲基化岛6 个[10]。采用MSP 法检测不同浓度的BaP(0、0.1、1、10 μmol·L-1)处理24 h 后的HepG2 细胞,结果显示阳性对照组(5-Aza-CdR 组)中CDH13、FHIT基因呈现非甲基化状态,随着BaP 浓度增加,FHIT、CDH13基因甲基化条带(M 条带)亮度逐渐增强,而非甲基化条带(U 条带)亮度逐渐减弱,且均呈剂量依赖性,高剂量组呈现完全甲基化状态(见图1)。表明BaP可促进FHIT、CDH13基因启动子区域的甲基化。
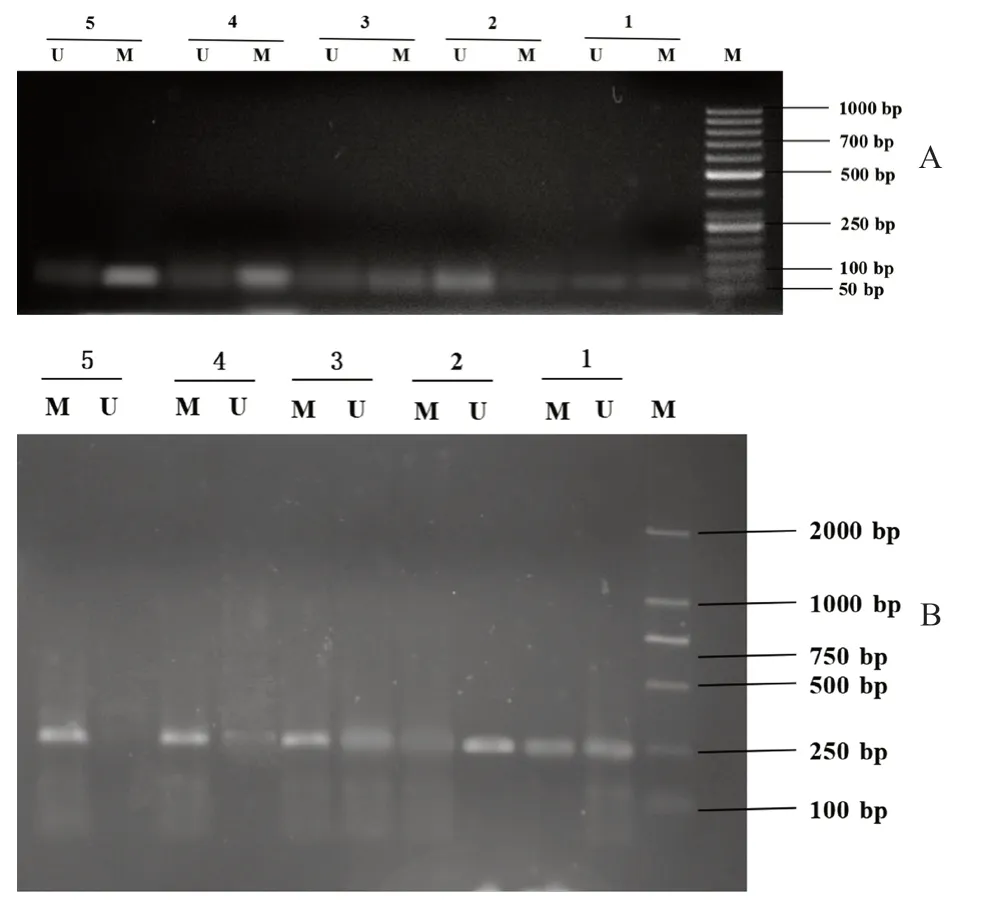
图1 FHIT 基因(A)和CDH13 基因(B)MSP 电泳图Fig 1 MSP electropherogram of FHIT genes (A) and CDH13 genes (B)
3.2 BaP 处理后FHIT、CDH13、DNMT1、Sp1 mRNA 表达情况
将对照组中FHIT、CDH13、DNMT1、Sp1mRNA 表达量设置为1,与对照组比较(见图2),阳性对照组FHIT、CDH13、DNMT1、Sp1mRNA及BaP 1 μmol·L-1和10 μmol·L-1组中FHIT、CDH13、DNMT1、Sp1的表达差异均具有统计学意义(P<0.05,P<0.001)。结果表明BaP 中、高剂量组可以显著下调FHIT、CDH13mRNA 表达量,而上调DNMT1、Sp1mRNA 表达量。
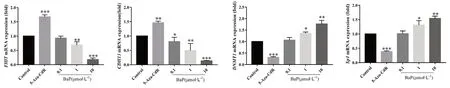
图2 不同浓度BaP 处理后FHIT、CDH13、DNMT1 及Sp1 基因mRNA 表达的情况(n =3)Fig 2 mRNA expression of FHIT,CDH13,DNMT1 and Sp1 at different concentrations of BaP(n =3)
3.3 BaP 处理后FHIT、CDH13、DNMT1、Sp1 蛋白表达情况
与对照组相比,BaP 0.1 μmol·L-1蛋白表达虽降低,但差异无统计学意义(P>0.05),阳性对照组表达显著升高(P<0.05)。BaP 1 μmol·L-1和10 μmol·L-1组较对照组FHIT、CDH13 蛋白表达显著减低,而DNMT1、Sp1 蛋白表达显著增加(见图3)(P<0.05)与RT-qPCR 结果一致。表明BaP 可能通过增加DNMT1、Sp1 蛋白表达而抑制FHIT、CDH13 蛋白表达。

图3 不同浓度BaP 处理后FHIT、CDH13、DNMT1 及Sp1 基因蛋白表达的情况(n =3)Fig 3 Protein expression of FHIT,CDH13,DNMT1 and Sp1 at different concentrations of BaP(n =3)
4 讨论
DNA 甲基化是重要的表观遗传修饰方式之一,参与调节胚胎发育、转录、染色质结构、X染色体失活、基因组印记和染色体稳定等多项生命活动[11]。近年来国内外学者对FHIT、CDH13基因甲基化与肝癌的关系进行了大量的研究,研究表明FHIT、CDH13基因甲基化与恶性肿瘤的发生发展密切相关[12]。此前,Tuoya 等[7]的实验也证实了FHIT、CDH13基因在肝癌患者中呈现高甲基化状态。BaP 是国际公认的环境污染物,被列为Ⅰ类致癌物,已有研究报道BaP 可以促进肝癌的发生和进展[13],但其具体机制尚未清晰。Jiang 等[14]研究发现,BaP 诱导的DNA 甲基化改变可能会导致与空气污染相关肺癌中异常的DNA 甲基化,这些DNA 甲基化改变可能影响肺癌的发生和进展。本实验以DNA 甲基转移酶抑制剂5-Aza-CdR 为阳性对照组,通过采用甲基化特异性PCR 法检测不同浓度BaP 作用于HepG2细胞后FHIT、CDH13基因的甲基化情况,结果表明BaP 可增强FHIT、CDH13基因甲基化水平,且具有浓度依赖性,本实验结果佐证了之前的研究内容也弥补了的BaP 对HepG2 细胞内的FHIT、CDH13甲基化水平的研究空白。
DNA 甲基化和去甲基化可通过DNA 甲基转移酶(DNMT)进行调控,两个 DNMT 家族 DNMT3和 DNMT1 分别负责甲基化的建立和维持[15]。Robert 等[16-17]研究发现DNMT1 和DNMT3b 协同作用抑制肿瘤的CpG 岛高甲基化。DNMT1 负责将己经发生变化的基因DNA 甲基化信息传递于子代细胞,使得异常DNA 甲基化模式继续发生和延续[18]。Leu 等[19]在卵巢癌的研究中,沉默DNMT1后3 个无活性TWIST、RASSF1A和HIN-1基因发生部分去甲基化,并恢复了基因的表达。本实验结果发现随着BaP 浓度的升高,DNMT1 的蛋白及mRNA 表达逐渐增加,高剂量组BaP 对DNMT1蛋白及mRNA 表达增加最为明显,但抑癌基因FHIT、CDH13无论是蛋白表达还是mRNA 表达都逐渐减少,表明BaP 可能通过显著增加甲基化转移酶DNMT1 的活性使FHIT、CDH13表达减少,从而发挥促甲基化的作用。
DNMT1 活性的改变与其表达水平和功能性激活有关,其表达水平主要受核转录因子Sp1的调控。Song 等[20]研究发现DNA 甲基转移酶DNMT1 与Sp1 结合并引起一些Sp1靶基因的抑制,同时Sp1 还可以通过与DNMT1 相互作用而促进特定位点的甲基化[21]。为了进一步探究BaP 抑制DNMT1 表达的机制,采用RT-qPCR、Western blot 法对其进行验证,结果表明BaP 暴露后,细胞中Sp1mRNA 与蛋白表达均显著增高。有研究指出对DNMT1 的表达抑制机制可能是通过抑制Sp1 的活性而实现的[22]。由于Sp1 在DNMT1 上有结合位点,所以BaP 可能通过上调Sp1 蛋白与mRNA 的表达发挥促进作用,可能最终会导致DNMT1 的活性增强,从而促进FHIT、CDH13基因甲基化作用。
综上所述,本研究发现BaP 可能会通过增强Sp1 促进DNMT1 活性,调控FHIT、CDH13基因甲基化表达,影响FHIT、CDH13基因的表达水平,从而发挥促甲基化作用。但BaP 如何调控Sp1和DNMT1 及其下游信号通路有待进一步研究。
