cGAS-STING信号通路在神经退行性疾病中的研究进展
2022-11-15张琳洁于永生上海大学医学院上海200444
张琳洁,于永生(上海大学医学院,上海 200444)
先天免疫系统是人体的第一道防线,先天免疫系统中的模式识别受体(pattern recognition receptors,PRRs)通过对微生物病原体特定的分子结构进行识别启动机体的防御系统[1]。环磷酸鸟苷-磷酸腺苷酸合成酶(cyclic adenosine-adenosine synthase,cGAS)作为一种胞内模式识别受体,通过激活干扰素基因刺激因子(stimulator of interferon gene,STING)通路,激发和影响先天免疫系统[2]。
目前已经证实,cGAS-STING 信号通路作为先天免疫传感器在许多病理和生理过程的作用日益扩大,包括防御微生物感染、抗肿瘤免疫、细胞衰老、自噬以及自身免疫等[3-4]。近年来的研究表明cGAS-STING 信号通路在神经系统疾病,尤其是神经退行性疾病方面也起到了重要作用。本文就cGAS-STING 信号通路在神经退行性疾病中的作用及其潜在治疗意义进行综述。
1 cGAS-STING 信号通路
cGAS 属于核苷酸转移酶家族成员,能够检测到胞质中的双链DNA(double-stranded DNA,dsDNA),Sun 等[5]首次通过生化分离和质谱定量分析鉴定出cGAS,也证明了cGAS 是一种触发Ⅰ型干扰素(type Ⅰ interferon,IFN-Ⅰ) 通路的胞质DNA 传感器。Civril 等[6]测定了猪的cGASMab21 晶体结构,证明cGAS 是由一个非结构化N 末端延伸和一个高度保守的Mab21 核苷酸转移酶结构域组成的。同期另一项研究中,利用鼠源cGAS-DNA 结构模型阐明了cGAS 的催化机制,当胞质DNA 出现时,就会引起cGAS 构象改变,cGAS 的活性口袋从无活性的关闭构象转变为具有活性的开放构象,促使cGAS-DNA 复合物形成,该复合物促进三磷酸鸟苷(guanosine triphosphate,GTP)和三磷酸腺苷(adenosinetriphosphate,ATP)转化为2’3’-环鸟苷酸-腺苷酸(2’3’-cyclic GMP-AMP,cGAMP)[7]。cGAS的激活依赖于DNA 结构[8]。当DNA 为>45 bp的片段时,能够有效地促进人源cGAS 活化,而鼠源cGAS 可被短至20 bp 的DNA 激活[9]。
Ishikawa 等[10]在抗病毒免疫研究中发现并首次报道了STING 对固有免疫反应至关重要。STING是主要定位于内质网的跨膜接头蛋白,广泛表达于多种细胞类型。cGAS 被细胞质DNA 激活后生成的cGAMP 与STING 相互作用,诱导STING 转移到高尔基体发生下游级联反应。STING 蛋白的羧基末端能够激活蛋白激酶IκB(protein kinase IκB,IKK)和TANK 结合激酶1(TANK binding kinase 1,TBK1),一方面激活核因子κB(nuclear factor kappa-B,NFκB),诱导白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的释放,另一方面还可启动干扰素转录因子调节因子3(interferon transcription factor regulator 3,IRF3)转录通路,诱导IFN 产生,并在表达后发挥有效的抗病毒作用[11](见图1)。
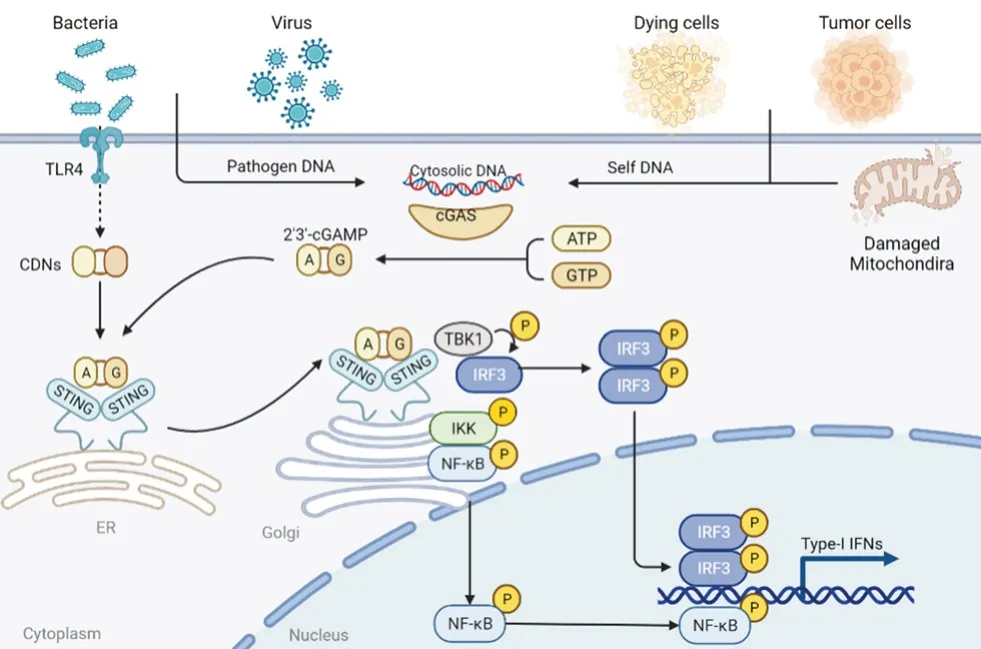
图1 cGAS-STING 信号通路机制图Fig 1 Mechanism of cGAS-STING signaling pathway
对STING 的结构进行分析后发现,跨膜连接器环中的一些残基是产生IFN-Ⅰ所必需的,这表明了跨膜结构域在STING 的激活中能够起到一定的作用[12]。STING 在与cGAMP 结合后会关闭其二聚体角,相对于跨膜结构域扭曲180°,然后释放C 端尾巴密码子(C-terminaltail,CTT),并形成稳定的聚合物。通过X 射线晶体证明,CTT 可以直接与IRF3 结合,参与STING的配体结合和磷酸化的过程,磷酸化后的STING能够募集IRF3。
cGAS-STING 信号通路的激活因素包括外源性因素和内源性因素。cGAS 可以对来自病毒、细菌的外源DNA 作出反应,启动先天免疫系统,起到防止感染的作用。例如,Ⅰ型单纯疱疹病毒(herpes simplex virus 1,HSV-1)能在野生型小鼠肺成纤维细胞和小鼠骨髓来源的巨噬细胞(bone marrow derived macrophages,BMDMs)中诱导产生IFN-β,在体内实验中,HSV-1 对STING-/-小鼠有致命的感染性[13],因此在实验中HSV-1 经常作为激活剂用于激活cGAS-STING 信号通路。某些含有dsDNA 的细菌也可以激活cGAS-STING 信号通路,如淋病奈瑟球菌(Neisseria gonorrhoeae)先由Toll 样受体-4(Toll-like receptors 4,TLR4)诱导产生IFN,进入BMDMs 胞质后再激活cGAS,并产生IFN 反应[14];单核细胞性李斯特菌(Listeria monocytogenes)可激活cGAS,引起人类骨髓细胞中的IFN 表达,此研究也证明了李斯特菌中的环二核苷酸(cyclic dinucleotides,CDN)可以直接触发STING 而不依赖于cGAS[15]。
cGAS-STING 信号通路激活的内源性原因包括自身DNA 的清除缺陷和线粒体应激。3’-核酸修复外切酶1(three prime repair exonuclease 1,TREX1),是胞质中主要的3’-5’限制性核酸外切酶,TREX1 表达的核酸酶活性对于维持先天免疫系统识别自身DNA 的免疫耐受发挥重要作用,人源TREX1基因的突变会引起一系列自身免疫性疾病的发生[16]。当细胞质中来源于细胞核泄漏或病原体的DNA 没有及时被TREX1 清除就会使cGAS-STING 信号通路激活[16]。由于线粒体是氧化呼吸的场所,线粒体DNA(mitochondrial DNA,mtDNA)很容易受到呼吸过程中由电子传递链产生的活性氧造成的损伤,所以线粒体通过相应的自噬机制来清除受损线粒体[17]。异常的线粒体自噬会导致胞质DNA 的积累,mtDNA 释放到细胞质从而激活cGAS-STING 信号通路[9]。线粒体转录因子A(transcription factor A mitochondrial,TFAM)是mtDNA 结合蛋白,能控制mtDNA 的分离、丰度和类核苷酸结构[9]。TFAM 缺乏会使线粒体基因组紊乱和线粒体应激,导致mtDNA 逃逸到细胞质中,从而通过cGAS-STING 信号通路诱导干扰素刺激基因(interferon-stimulated genes,ISGs)表达和IFN 的产生[18]。关于mtDNA 泄漏到胞质中的原因,目前认为可能是B 淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2)基因相关蛋白(BCL-2 associated X protein,BAX)诱导线粒体外膜上的孔洞形成,增加线粒体内膜的通透性,从而导致线粒体大分子(包括mtDNA)逃逸[19]。
cGAS-STING 信号通路同时也受到负性调节,当病原微生物感染导致的细胞凋亡通路被活化时,可以激活多个凋亡效应蛋白酶。活化的凋亡蛋白酶切割多条天然免疫通路中的关键蛋白(cGAS、IRF3)以及线粒体抗病毒信号蛋白(mitochondrial antiviral-signaling protein,MAVS),并使这些蛋白完全失活,避免细胞因子的过度产生[20]。提示天然免疫稳态的维持存在互相制约的精密调节。
2 cGAS-STING 信号通路在神经退行性疾病中的作用
在中枢神经系统(central nervous system,CNS)中,小胶质细胞作为最主要的中枢固有免疫细胞,其功能和状态与脑内炎症水平密切相关,而星形胶质细胞可以对炎症信号作出反应并促进炎症,参与调控生理状态和病理状态下神经系统的多个生命进程[21]。小胶质细胞、星形胶质细胞都表达cGAS,通过识别DNA 介导IFN 表达[22-23]。其中,小胶质细胞是激活cGAS-STING信号通路的主要细胞类型。小胶质细胞受到来自病毒或受损mtDNA 的激活,启动cGAS-STING信号通路,分泌IFN,作用于神经元上的干扰素A 受体(interferon A receptor,IFNARs),引发神经元抗病毒防御机制(见图2)。与此同时,星形胶质细胞也被启动,以缓解炎症。然而这一通路的过度激活却会导致神经炎症。
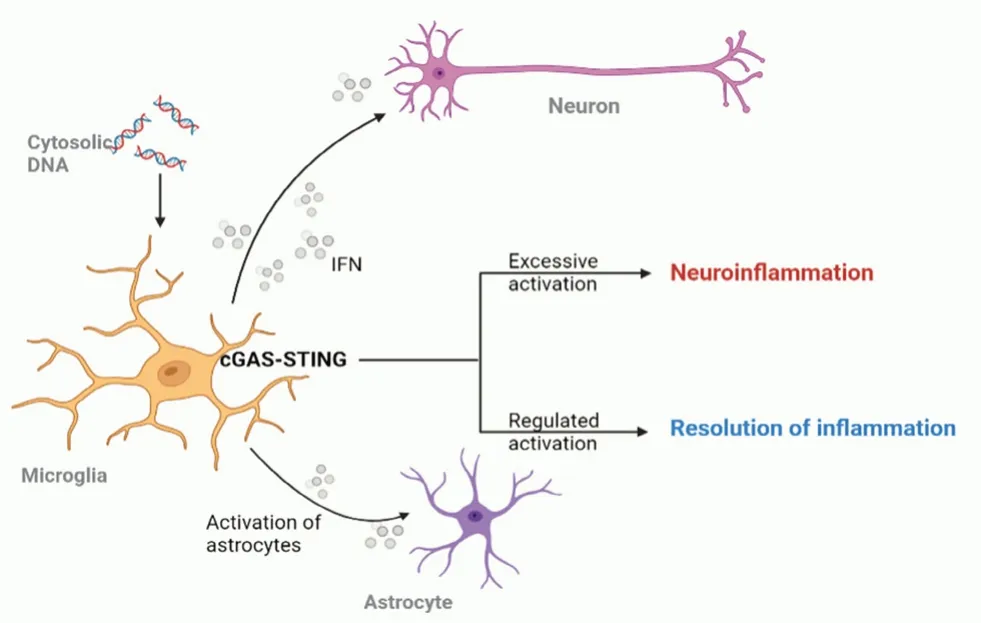
图2 小胶质细胞中的cGAS-STING 信号通路激活Fig 2 Activation of cGAS-STING signaling pathway in the microglia
虽然cGAS-STING 信号通路在神经系统中的作用近年来才逐渐被揭示,但作为治疗神经退行性疾病的新靶点,其作用和未来前景不容忽视。本文将对常见的神经退行性疾病中cGAS-STING信号通路的相关研究进展进行阐述。
2.1 毛细血管扩张性共济失调综合征
核酸的识别在防御中枢神经系统病原体中发挥着重要作用,但先天免疫机制的触发也是主要神经退行性疾病的一个重要致病因素。毛细血管扩张性共济失调综合征(ataxia telangiectasia,A-T)是一种由于缺乏DNA 损伤修复过程中的ATM(ataxia telangiectasia-mutated)激酶而引起的常染色体隐性遗传病,临床表现较为广泛,主要有意向性震颤、眼皮肤毛细血管发育不全、协调功能障碍和平衡障碍等。A-T 患者的细胞表现出放射敏感性,基因组不稳定性增加,伴有端粒磨损加剧、线粒体功能障碍和早衰[24]。Song 等[25]认为在A-T 中,DNA修复机制的缺乏导致ss/dsDNA 在胞质积累,并被先天免疫系统识别,通过STING 来诱导信号转导,引起小胶质细胞激活和神经毒性细胞因子的分泌。这种新型炎症级联可能是一种广泛适用于多种疾病的神经炎症诱导机制。Aguado 等[24]的研究中,使用人类的类脑器官精确地模拟了A-T 的神经损害表型,发现使用STING 抑制剂H-151,可有效地抑制自身DNA 诱导的衰老相关分泌表型(senescence-associated secretory phenotype,SASP)激活,并恢复了A-T 类脑器官的神经病理学特征[24],既验证了抑制cGAS-STING 信号通路可以作为A-T 神经病理学的有效治疗靶点,又表明STING 抑制剂可能用于其他与早衰和自身DNA 诱导的SASP 激活相关的神经系统疾病。
2.2 阿尔茨海默病(Alzheimer’s disease,AD)
AD 是一种表现为进行性认知衰退和记忆丧失的神经退行性疾病[26]。AD 的典型病理特征是细胞外β-淀粉样蛋白(amyloidβ-protein,Aβ)的积累导致的神经纤维缠结[27]。而Aβ源于β淀粉样前体蛋白(β-amyloid precursor protein,APP)的裂解以及高磷酸化微管相关蛋白Tau(microtubuleassociated protein tau,MAPT)的细胞内沉积[28]。淀粉样蛋白级联假说受到广泛认可,该假说认为Aβ累积是导致神经元损伤级联效应的主要原因[29]。然而,越来越多的证据表明,单靠淀粉样蛋白级联不能解释AD 的其他发病机制和病理过程,有人提出,大脑中的炎症和免疫反应可能加速AD 疾病进展并成为发病的基础,而脑内固有的小胶质细胞是参与神经元和突触损伤的关键因素[30]。
作为中枢神经系统的常驻吞噬细胞,小胶质细胞主要通过释放降解酶对Aβ进行降解[31]。据研究表明,长期持续的Aβ识别和降解导致的先天性免疫激活会引发神经炎症,从而导致神经退行性病变的进一步发展[32]。炎症是细胞衰老的标志之一,并且已在AD 小鼠模型的大脑中观察到SASP 与神经炎症高度相关[33]。有证据表明,AD 过程中小胶质细胞呈现神经退行性表型(microglial neurodegenerative phenotype,MGnD),MGnD 表型下的小胶质细胞失去传感功能[34],星形胶质细胞和小胶质细胞都呈现吞噬功能障碍、脂质代谢异常等衰老表现[33,35]。髓系细胞触发受体2(triggering receptor expressed on myloid cell,TREM2)是一种感受Aβ积累和神经元损伤的受体,能够诱导小胶质细胞从M1 表型极化为M2 表型[36],促进小胶质细胞清除Aβ积累,从而减少神经炎症。Xu 等[37]系统研究了cGAMP 激活后,通过刺激STING 依赖性免疫从而诱导TREM2 上调,TREM2 表达在蛋白质和mRNA 水平上诱导增强了BV2 小鼠小胶质细胞体外和原代小胶质细胞体外对Aβ的吞噬效率,减少了Aβ斑块和神经元死亡。也就是说,cGAMP的治疗可以在TREM2 依赖机制中增加M2 表型与M1 表型的比率,改善AD 小鼠模型中的神经炎症。因此,在AD 背景下,增强天然免疫可以减缓神经退行性疾病的进程,表明cGAMP 在AD 免疫治疗中有巨大的应用潜力。值得注意的是,虽然在此研究中,cGAMP 处理后明显上调了STING 和IRF3 的表达,证明了AD 小鼠大脑存在cGAMP-STING-IRF3 信号通路的激活,但cGAMP 激活后,增强了BV2 小鼠小胶质细胞体外对Aβ的吞噬效率,这一现象并不能证明是由cGAMP 依赖于STING 而实现的。
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+) 是AD 神经元中DNA 修复和线粒体自噬等多个过程的关键,在细胞代谢中起着核心作用[38]。许多神经退行性疾病(包括AD)的相关组织中NAD+水平较低,研究发现补充NAD+前体烟酰胺核糖(NAD+precursor nicotinamide riboside,NR)可有效增加NAD+,并对小鼠模型中的许多AD 特征产生有益影响[39]。以往的研究证实AD 存在线粒体自噬现象,自噬过程中释放到胞浆中的DNA 导致cGASSTING 信号通路异常激活[40]。Hou 等[41]将cGASSTING 信号通路与AD 联系起来,发现在APP/PS1双转基因小鼠模型中,补充NR 可使线粒体自噬过程中释放到胞质中的DNA 减少,从而减少cGAS-STING 信号通路感知DNA 后的激活;进一步的研究也证明了NR 通过抑制cGAS-STING 信号通路降低AD 小鼠大脑的神经炎症和细胞衰老,改善AD 小鼠的学习记忆和突触可塑性。
2.3 帕金森病(Parkinson disease,PD)
PD 是一种常见的神经退行性疾病,临床表现为静止性震颤、肌强直、运动功能减退和步态异常。其致病原因有环境因素和遗传因素等,PINK1或Parkin基因的突变会导致家族性帕金森病,由PINK1/Parkin介导的线粒体自噬缺陷引起的受损线粒体积累可能促进PD 的发生[42]。炎症被认为是PD 病理的关键驱动因素[43],Sliter 等[44]研究发现Parkin和PINK1可以减缓STING 诱导的炎症反应,由耗竭性运动(exhaustive exercise,EE)或mtDNA 突变诱导的线粒体应激引起的炎症可以通过STING 的敲除而得以抑制,还证明了STING 的缺失可阻止积累突变mtDNA 的小鼠的炎症、运动缺陷和神经衰退的发生。对72 名PD 患者和58 名健康对照者的全基因组数据集的meta 分析显示,PD 患者黑质区中STING 水平较高,支持了cGAS-STING 信号通路可能与PD 发病机制有关的结论[45]。近期研究显示,STING 蛋白在含有错误折叠α-突触核蛋白(α-synuclein)的小鼠小胶质细胞中高表达,而cGAS-STING 信号通路介导的一系列炎症反应会诱发小胶质细胞破坏更多的多巴胺神经元,表明cGAS-STING 信号通路或许能作为特发性帕金森病或其他人类α-突触核蛋白疾病的潜在药物靶点[46]。
2.4 肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)
约4%的家族性ALS 患者中存在TDP-43突变[47],TDP-43在细胞质中的累积是ALS 的重要标志之一,这一特征与ALS 患者的神经炎症性细胞因子表征相关联,主要表现为NF-κB 和IFN-Ⅰ通路水平的升高[48-49]。最新研究中,Yu 等[50]通过对iPSC 分化的运动神经细胞及ALS 患者样品进行系统分析发现,TDP-43 通过在线粒体的累积,诱导mtDNA 向细胞质释放后激活cGAS-STING 信号通路,引起NF-κB 通路激活和IFN-Ⅰ水平升高。相反,使用STING 抑制剂H-151 处理可以减轻炎症并改善神经退行性症状,而且敲除cGAS和STING 能够完全阻断由TDP-43基因Q331K 点突变诱导转基因ALS 模型的炎性因子表达,cGAS抑制剂RU.521 也能够达到类似效果。进一步对TDP-43A315T 点突变的ALS 模型小鼠进行分析,该模型小鼠脑内、脊髓及血清的cGAMP 水平均高于对照小鼠,敲除STING 后小鼠的运动功能也显著性改善[50]。这些结果为TDP-43突变诱导神经炎症提供了完整的机制阐述,为使用SITNG 抑制剂对ALS 患者进行干预提供了理论和实验基础。
2.5 C 型尼曼-皮克病(Niemann-Pick disease type C)
C 型尼曼-皮克病是一种罕见的神经退行性疾病,长期以来被认为是一种胆固醇代谢和分布的疾病。然而近期研究发现,C 型尼曼-皮克病与STING 相关,Chu 等[51]通过定量蛋白质组学,确定了溶酶体膜蛋白尼曼-皮克型C1(NPC1)作为STING 转运的辅助因子,NPC1 蛋白的丢失通过阻断溶酶体降解“促进”STING 信号传递。在Npc1-/-小鼠小脑中,STING基因缺失显著降低了小胶质细胞的激活,并减轻了浦肯野神经元的缺失,从而改善了运动功能。这一研究或许能够为C 型尼曼-皮克病患者提供一种有效的治疗靶点。
2.6 亨廷顿病(Huntington disease,HD)
HD 是一种常染色体显性的神经退行性疾病,由Huntingtin基因中多谷氨酰胺(polyglutamine,PolyQ)编码的CAG 重复序列的扩展引起[52]。该疾病严重影响大脑纹状体,导致肌肉萎缩、运动和认知障碍、精神障碍和神经变性[53]。突变Huntingtin基因(mutant huntingtin,mHtt) 聚集并引起广泛损伤,影响转录调控、DNA 修复和核胞质转运等细胞过程[54]。全基因组关联研究(genome-wide association studies,GWASs)显示,DNA 氧化损伤、DNA 修复和线粒体功能的相关通路与疾病的发病年龄相关[55]。HD 病理过程中的细胞质DNA 和炎症反应已经被报道,有证据表明在HD 患者死后纹状体中cGAS-STING-IRF3 信号通路被激活[56]。当cGAS 活性增强,炎症相关基因和自噬蛋白表达增加,cGAS 的缺失可降低HD 纹状体细胞的炎症和自噬反应,提示cGAS 可促进HD 的炎症反应,可能是HD 的治疗靶点[57]。近期研究发现的STING 稳态维持蛋白TOLLIP 能够在无病原菌感染状态下维持STING 蛋白的稳定,TOLLIP 敲低或者敲除可显著降低STING 的表达,从而抑制了DNA 刺激引起的cGAS-STING信号通路激活[58]。相关研究表明PolyQ 富集蛋白的积累与HD 的发生密切相关[59],当细胞过表达HTTq74(PolyQ 富集蛋白)后,它能够竞争性与TOLLIP 相互作用,从而抑制TOLLIP-STING 相互作用,导致STING 被溶酶体降解。在HD 小鼠疾病模型中(zQ175),中脑皮层中有大量PolyQ蛋白聚集,同时也发现STING 蛋白在大脑中也被显著降解[58],STING 蛋白的稳定在HD 发生中的功能或许具有研究价值。
2.7 多发性硬化(multiple sclerosis,MS)
MS 是一种以脱髓鞘为特征的神经退行性疾病,免疫系统攻击神经纤维的保护鞘髓磷脂,导致炎症和神经损伤[60]。MS 的病理特征是炎症伴脱髓鞘、星形胶质细胞增生和神经退行性改变。该疾病可进展到继发性进行性多发性硬化(secondary progressive multiple sclerosis,SPMS)阶段,其特征为持续的、不可逆的神经功能衰退、脑容量减少和轴突丢失,小部分患者为原发性进行性多发性硬化(primary progressive multiple sclerosis,PPMS)[61]。免疫调节疗法如IFN 和利妥昔单抗可预防或延缓MS 的进展[62]。Mathur等[60]研究发现抗病毒药物更昔洛韦可通过激活cGAS-STING 信号通路诱导小胶质细胞产生IFN反应,抑制炎症,在MS 模型中起到保护作用。Johnson 等[63]使用微粒包裹的cGAMP 治疗实验性变态反应性脑脊髓炎(experimentally allergic encephalomyelitis,EAE)小鼠模型,cGAMP 表现出IFN 依赖性免疫抑制作用,促进了MS 患者外周单核血细胞中的IFN 以及免疫调节因子IL-27和IL-10,这项研究揭示了cGAMP 的免疫调节作用,表明STING 激动剂可能是一种治疗MS 的新方法。
3 cGAS-STING 信号通路相关调控剂
对于大多数发展过程中涉及神经炎症水平升高和促炎细胞因子增多的神经退行性疾病,抑制cGAS-STING 信号通路或许可以作为一种干预手段。
3.1 靶向cGAS 的通路抑制剂
cGAS 作为cGAS-STING 信号通路的启动因子,抑制其活性可以阻止下游通路激活,可能对神经退行性疾病的治疗起到一定作用。相关抑制剂阻止cGAS 激活的方式主要是结合cGAS 的活性位点,与ATP 或GTP 底物或产物cGAMP竞争,或是干扰DNA 与cGAS 结合,从而干扰cGAS 的初始激活步骤。
An 等[64]筛选了一系列抗疟药物,如羟氯喹(hydroxychloroquine,HCQ) 和阿奎平(quinacrine),这些药物通过插入cGAS-dsDNA 的结合凹槽,选择性阻断cGAS-dsDNA 相互作用,抑制IFN-β的产生;基于以上研究,该团队继续合成了第二代分子X6,其在体外和体内活性都有改善,具有更好的溶解性和口服利用度。实验证明,X6 可使Trex1-/-小鼠心肌细胞中cGAMP 产生明显减少[65]。其他具有相似作用机制的化合物,如Suramin[66]和A151[67],同样作为竞争性的cGAS 抑制剂,通过与dsDNA 结合域相互作用干扰cGAS-DNA 结合物产生。Vincent 等[68]通过对12 万个化合物进行高通量筛选,最终发现化合物RU.365 和RU.521 可以占据cGAS 的活性位点,降低cGAS 对底物ATP 和GTP 的亲和力。同时实验证明,RU.521 可以降低Trex1-/-小鼠BMDMs 中Ifnb1mRNA 的表达水平。尽管PF-06928125 在生化检测中显示可以与cGAS结合,但在细胞检测中抑制活性较低,可能与细胞内ATP 和GTP 水平较高有关。靶向cGAS 的cGASSTING 信号通路抑制剂总结见表1。

表1 靶向cGAS 的抑制剂Tab 1 Inhibitors targeting cGAS
3.2 靶向STING 蛋白的抑制剂
Mukai 等[72]发现STING 蛋白N 段半胱氨酸88/91 位(Cys88/91)的棕榈酰化对高尔基体上STING 多聚体的形成发挥了关键作用,因此,控制棕榈酰化可能是调控STING 活性的一种方法。通过基于细胞的化学筛选,Haag 等[73]鉴定了两种硝基呋喃衍生物(C-178、C-176),它们能与STING 蛋白Cys91 之间形成共价键,抑制STING 蛋白的棕榈酰化,从而阻止STING 蛋白组装成多聚体,阻断下游信号传导。该团队又通过其他筛选方式得到了化合物H-151,其作用机制与C-178 相同,可显著降低Trex1-/-小鼠的全身炎症反应[73]。在另一项研究中,Hansen 等[74]发现硝基脂肪酸(NO2-FAs)可以抑制cGAS-STING信号通路,NO2-FAs 是通过在病毒感染过程中向不饱和脂肪酸中加入二氧化氮(NO2)而产生的内源性物质,可以共价修饰STING 蛋白的Cys88和Cys91,抑制棕榈酰化,导致通路失活。此外,NO2-FAs 还能有效减少自免疫疾病患者成纤维细胞中IFN 的生成。
除此之外有一些作用于其他位点的化合物也被证明对cGAS-STING 信号通路有抑制作用。Li 等[75]从药用植物Aster tataricus中发现了环肽Astin C,Astin C 与STING 的C 端激活口袋和2’3’-cGAMP 竞争,特异性结合到STING 的C 端激活位点从而抑制IRF3 募集。正是由于上述机制,Astin C 使Trex1-/-小鼠的IFN 水平明显降低。Siu等[76]通过自动配体识别系统识别了另一种抑制剂Compound 18。Compound 18 与2’3’-cGAMP 结合位点结合,抑制2’3’-cGAMP 诱导的IFN-β分泌。
以STING 蛋白为靶点的cGAS-STING 信号通路抑制剂总结见表2。

表2 靶向STING 蛋白的抑制剂Tab 2 Inhibitors targeting STING proteins
4 总结与展望
通过对cGAS-STING 信号通路在神经系统中的作用机制研究,可以更好地理解该通路在神经退行性疾病中的重要作用。cGAS-STING 信号通路作为潜在的分子靶标,为相应疾病的药物研发提供新策略。大多数神经退行性疾病都伴有高水平的神经炎症,抑制cGAS-STING 信号通路为其治疗提供了新途径。例如在PD 和A-T 的病理过程中,由于DNA 修复机制缺陷等原因导致的小胶质细胞激活,诱导产生神经炎症,可以使用STING 抑制剂阻断cGAS-STING 信号通路,改善炎症信号,有望减轻神经细胞的损伤,从而改善神经退行性症状,恢复患者运动能力。而对于MS 和AD,尤其是在AD 的早期,神经炎症主要表现为对神经产生损伤,考虑到cGAMP 表现出IFN 依赖性免疫抑制作用可以减轻神经炎症,在未来研究中,或许可以借助cGAMP 等STING 激动剂来增强天然免疫这一思路,同时结合临床试验和已知治疗手段,明确cGAS-STING 信号通路在中枢神经系统的具体作用,为药物开发及临床治疗策略的制订奠定基础。
