乙肝病毒全S蛋白反式激活蛋白1相互作用蛋白的筛选和验证①
2022-11-15林丽华吴秀珍马菲菲黄绍娥卓德祥
林丽华 钱 锋 吴秀珍 马菲菲 黄绍娥 卓德祥
(福建医科大学附属三明第一医院检验科,三明 365000)
膀胱癌是泌尿系统中最常见的恶性肿瘤,近年来其发病率呈上升趋势。根据不同的临床表现和分子表达谱改变,膀胱癌可以分为两大类,非肌肉浸润性和肌肉浸润性,其中75%~80%是非肌肉侵袭性膀胱癌,复发率高达50%~70%[1]。目前临床上主要采用根治性膀胱切除术、保留膀胱的经尿道切除术、化学疗法和放射疗法治疗膀胱癌,但转移性膀胱癌的预后仍不理想。因此,有必要进一步深入了解膀胱癌发生、发展相关的分子机制,以期为膀胱癌的诊断和治疗提供新的思路和靶点。
乙肝病毒全S蛋白反式激活蛋白1(complete S transactivated protein 1,CSTP1)是近年发现的一个蛋白磷酸酶,其表达在膀胱癌组织中明显降低。先前研究结果显示,膀胱癌细胞中CSTP1过表达可以使Akt激酶第473位丝氨酸残基去磷酸化而失活,导致下游Foxo3A转录因子活化,活化后的Foxo3A转入细胞核,结合至IL-6基因启动子并抑制其表达,抑制肿瘤细胞增殖、促进细胞凋亡,进而抑制裸鼠体内肿瘤生长[2-3]。
为进一步了解CSTP1在肿瘤中的生物学功能,采用酵母双杂交实验筛选真核细胞中能与CSTP1相互结合的蛋白,从其可能的作用靶标入手,探讨其在肿瘤发生发展过程中的作用。
1 材料与方法
1.1 材料DNA聚合酶购自Thermo Fisher公司;人白细胞cDNA文库、淋巴组织cDNA文库、人胎肝cDNA文库、人胎脑cDNA文库、人肾cDNA文库、人脾cDNA文库、酵母双杂交试剂盒、酵母转化试剂盒、酵母质粒提取试剂盒购自上海睿星基因技术有限公司。
1.2 方法
1.2.1 诱饵质粒构建PCR扩增得到CSTP1基因编码区片段,引物序列分别为F:5'-TGACTGTATCGCCGGCCAATCCGGCCATGTCGGCTGCAGAGGCGGGGGGTGTTT-3';R:5'-GCGGCCGCTGCAGGGCCTCTAAGGCCTCATTTTTTCTTGATCAAATCCATG-3'。PCR产物胶回收酶切后连接入pGBKT7空载体得到诱饵质粒pGBKT7-CSTP1。真核表达质粒pcDNA3.1-3×Flag-CSTP1、pcDNA3.1-HA-RanBP9和pcDNA3.1-HA-PSMD7由湖南丰晖生物科技有限公司构建。
1.2.2 诱饵质粒毒性检测将pGBKT7-CSTP1和pGBKT7质粒分别转化Y2HGold菌,涂布SD/-Trp平板,观察酵母菌落生长情况;4 d后挑取菌落接种至5 ml SD/-Trp液体培养基,振荡培养,分光光度计检测OD600值,每5 h检测1次,共进行6次检测。
1.2.3 诱饵质粒自激活检测将pGBKT7-CSTP1诱饵质粒 和pGADT7(AD空载体)转化Y2HGold菌,涂 布SD/-leu-Trp和SD/-leu-Trp-his-ade+ABA+X-a-gal平板,30℃培养箱倒置培养;同时设pGBKT7-53和pGADT7-T为 阳性对照组,pGBKT7-Lam和PGADT7-T为阴性对照组,并将菌液涂布SD/-leu-Trp和SD/-leu-Trp-his-ade+ABA+X-a-gal平板,30℃倒置培养。
1.2.4 酵母双杂交挑取5个Y2HGold酵母菌(pGBKT7-CSTP1)于1 ml SD/-Trp液体培养基,混匀后转入150 ml SD/-Trp培养基,振荡培养至OD600=1.2(约20 h),将培养液转入YPDA中混匀,振荡培养5 h,低速离心收集菌体。离心收集的菌液用500 ml双蒸水洗涤1次,低速离心收集菌体。30 ml 1×TE/LiAC洗涤菌体,低速离心收集菌体。1×TE/LiAc重悬菌体,加入350μg混合cDNA文库质粒和已经预变性的Carrier DNA,轻轻混匀。加1×TE/LiAc/PEG,剧烈涡旋混匀。30℃,45 min,每15 min混匀1次。加DMSO,轻轻混匀。42℃热激20 min,每10 min混匀1次。冰浴5 min后低速离心收集菌体。加入1 000 ml YPDA,30℃振荡培养60 min,低速离心收集菌体。加入3 ml 0.9%NaCl重悬菌体。将菌液涂布于15 cm SD/-leu-Trp-his-ade+ABA+X-a-gal平板上(200μl/块)。第5天起观察菌落生长。
1.2.5 阳性克隆验证挑取阳性克隆扩菌抽提酵母质粒(含诱饵质粒和猎物质粒),转化DH5α感受态菌,涂布含氨苄青霉素的LB板,阳性克隆用LB液体培养基(Ampr)扩菌,提取质粒,部分用于测序,部分与诱饵质粒共转化Y190酵母菌,菌液涂布SD/-Trp/-Leu平板,同时 设 置PGBKT7-53和pGADT7-T共转为阳性对照及pGBKT7-Lam和pGADT7-T共转为阴性对照。30℃培养。待菌落长至2 mm后进行β-半乳糖苷酶显色实验。
1.2.6 免疫共沉淀CSTP1、RanBP9和PSMD7基因开放阅读区克隆真核表达质粒载体,得到pcDNA3.1-CSTP1(3×Flag标 签)、pcDNA3.1-RanBP9(HA标签)和pcDNA3.1-PSMD7(HA标签)表达质粒。将真核表达质粒pcDNA3.1-3×Flag-CSTP1分别和pcDNA3.1-HA-RanBP9或pcDNA3.1-HA-PSMD7共转膀胱癌EJ和RT4细胞;24 h后收集细胞于1.5 ml离心管,加预冷RIPA裂解液,冰上静置裂解15 min;4℃,14 000 r/min离心15 min;留取30μl细胞裂解液作阳性对照,转移其余上清到新的离心管;加沉淀抗体到上清液中,4℃缓慢摇动过夜;加Protein A琼脂糖珠,4℃缓慢摇动过夜;14 000 r/min离心5 s后收集沉淀物,用预冷磷酸缓冲液清洗3次,2×上样缓冲液将重悬沉淀物,煮沸变性5 min;anti-HA抗体蛋白印迹检测。
2 结果
2.1 构建诱饵质粒用特异性引物从混合文库中扩增目的基因编码区片段,扩增产物用琼脂糖电泳鉴定(图1A),胶回收后克隆入空载体pGBKT7。挑取3个阳性克隆进行酶切鉴定(图1B)和测序分析,3个克隆测序全部测通,在核苷酸722 bp位置均有1个相同的有义突变,核酸A-G,氨基酸lys-arg,判断为物种本来的原始序列,成功将CSTP1装入酵母表达载体中,可以进行下游蛋白质筛选实验。
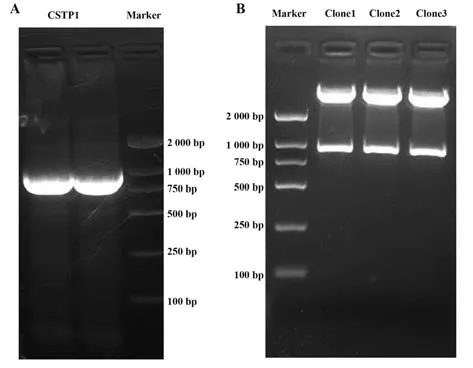
图1 诱饵质粒构建Fig.1 Construction of bait plasmids
2.2 诱饵质粒毒性检测将诱饵质粒pGBKT7-CSTP1与pGBKT7转入Y2HGold酵母菌,涂布SD/-Trp平板,观察酵母菌生长状态,结果显示,与转化pGBKT7质粒的酵母菌相比,表达诱饵蛋白的酵母生长状态、数量和大小基本一致。5 d后挑取单克隆酵母菌落接种至SD/-Trp液体培养基,振荡培养,分光光度计每6 h检测OD600nm值,含诱饵质粒pGBKT7-CSTP1的酵母与含空载体的对照酵母生长无显著差别(图2)。结果表明诱饵质粒表达的蛋白对酵母菌没有毒性。
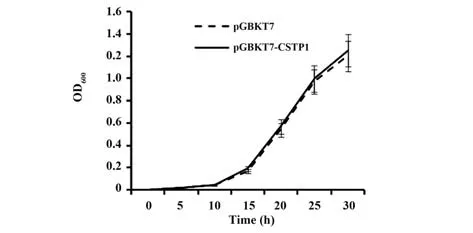
图2 转染了诱饵质粒和空载体的酵母细胞的生长曲线图Fig.2 Growth curves of yeast transformed with bait plasmids and empty vectors respectively
2.3 诱饵质粒自激活检测为检测诱饵质粒pGBKT7-CSTP1在酵母菌内是否具有自激活活性,将pGBKT7-CSTP1质粒和pGADT7空载质粒转化Y2HGold酵母菌,转化后的酵母菌涂布平板,观察菌落在选择性固体培养基上的生长情况。如图3所示,阳性对照的酵母菌落在SD/-leu-Trp和SD/-leu-Trp-his-ade+ABA+X-a-gal两种培养基上均能正常生长,但在后者培养基上菌落颜色变蓝;阴性对照在SD/-leu-Trp培养基上能正常生长,但在后者培养基上不能生长;含有诱饵蛋白的酵母能在SD/-leu-Trp培养基上正常生长,而无法在SD/-leu-Trp-his-ade+ABA+X-a-gal培养基上生长,提示基因PGB-CSTP1转入Y2HGold酵母菌后不能自激活酵母细胞携带的报告基因,该蛋白不存在自激活现象,可以进行下游筛选实验。

图3 诱饵质粒自激活检测Fig.3 Autoactivation detection of bait plasmids
2.4 酵母双杂交及阳性克隆测序分析 为筛选CSTP1相互作用蛋白,将6个人cDNA混合文库质粒转化表达诱饵蛋白的Y2HGold宿主菌,转化后的酵母菌涂布于选择性培养基,观察培养基上菌落的生长情况。如图4,固体培养基上有7个酵母克隆生长,从7个阳性克隆抽提质粒转化感受态细菌后涂布LB(ampr)平板,挑取阳性克隆扩增细菌质粒用于测序,得到2个宿主蛋白,分别是RAN结合蛋白9(RAN binding protein 9,RANBP9)及蛋白酶体26S非ATP酶调节亚基7(proteasome 26S subunit,non-ATPase 7,PSMD7)。
图4 酵母双杂交筛选CSTP1相互作用蛋白Fig.4 Screening of proteins interacting with CSTP1 by yeast two-hybrid assay
2.5 酵母双杂交系统验证蛋白相互作用为验证2种猎物质粒所表达的蛋白和CSTP1在酵母菌中相互作用,将猎物质粒pGADT7-RANBP9和pGADT7-PSMD7分别和诱饵质粒pGBKT7-CSTP1共转化酵母菌Y190。菌落β-半乳糖苷酶显色实验显示,阴性对照组β-半乳糖苷酶显色实验不显色,而阳性对照组β-半乳糖苷酶显色实验显蓝色,同时pGADT7-RANBP9和pGADT7-PSMD7实验组分别在1 h和3 h内快速显示蓝色(图5),结果提示,诱饵蛋白CSTP1和猎物蛋白RANBP9、PSMD7在Y190酵母菌中能够发生较强的相互作用,激活酵母菌Y190 LacZ报告基因。

图5 共转化验证诱饵蛋白和猎物蛋白相互作用Fig.5 Co-transformation of bait and prey plasmids to verify protein interaction
2.6 膀胱癌细胞内验证蛋白相互作用将pcDNA3.1-CSTP1质粒分别和pcDNA3.1-RanBP9或pcDNA3.1-PSMD7质粒共转染膀胱癌EJ细胞和RT4细胞,免疫共沉淀检测CSTP1是否和RanBP9或PSMD7蛋白相互作用。如图6结果显示,在用Flag抗体共沉淀得到的复合物中能检测到携带HA标签的RanBP9和PSMD7蛋白。
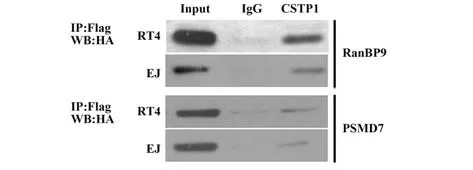
图6 免疫共沉淀CSTP1和RanBP9或PSMD7Fig.6 Coimmunoprecipitation between CSTP1 and Ran-BP9 or PSMD7
3 讨论
蛋白质磷酸化与去磷酸化是重要的信号转导分子活性调节机制之一,广泛参与肿瘤的发生、发展和转移。目前至少已经发现500多种蛋白激酶,如Akt、Ras、BRAF、PIM-1等,并且对其在肿瘤发生发展过程中的作用已经有较深入的研究,但关于蛋白磷酸酶的研究则相对较少[4-7]。研究显示,蛋白磷酸酶往往具有肿瘤抑制基因的特性,如PTEN,PP2A等[8-9]。先前研究结果证实CSTP1是一新的蛋白磷酸酶,并发现Akt激酶是其下游底物之一,为进一步探讨CSTP1在肿瘤发生发展过程中的作用,本研究采用酵母双杂交方法筛选并验证与CSTP1相互作用的蛋白,以期通过与其相互作用蛋白的功能线索来深入研究CSTP1的功能。
本研究中,首先在人正常组织cDNA文库中用PCR方法调取CSTP1基因序列,测序发现3个克隆在核苷酸722 bp位置均存在相同的一个有义突变,腺嘌呤(A)突变成鸟嘌呤(G),最终导致编码的氨基酸从赖氨酸突变成精氨酸,判断为物种本来的原始序列。以调取的CSTP1基因序列构建pGBKT7-CSTP1诱饵质粒,细胞生长毒性试验和自激活实验证实诱饵质粒对酵母细胞的生长不存在毒性,且诱饵质粒本身不能自激活酵母细胞携带的报告基因,说明CSTP1蛋白不存在自激活现象。用转化法酵母双杂交实验筛选人白细胞、淋巴组织、人胎肝、人胎脑、人肾组织、人脾组织cDNA混合文库,得到7个阳性酵母克隆,经测序分析得到2条基因序列分别为RANBP9和PSMD7。免疫共沉淀实验进一步证实在哺乳动物细胞内CSTP1能和RANBP9或PSMD7相互作用。
RANBP9最初是作为RAN的结合蛋白而发现的,参与微管成核现象,并因此而命名为RANBPM[10]。研究表明RANBP9参与结直肠癌、胃癌、骨肉瘤、肺癌和乳腺癌的发生发展,但其具体的分子机制尚未明确[11-16]。PSMD7是JAMM家族的去泛素化酶,位于19S蛋白酶体盖子亚复合体的核心部位[17]。PSMD7是否参与肿瘤的发生、发展目前尚不清楚,但已有报道其在食管鳞癌细胞EC9706和Eca109中呈高表达,并且敲除PSMD7表达抑制肿瘤细胞增殖,促进细胞凋亡,提示其可能参与了食管癌的发生、发展[18]。综上,通过酵母双杂交技术筛选并鉴定2个CSTP1相互作用蛋白,分别是RANBP9和PSMD7,为研究CSTP1在肿瘤发生发展过程中的作用提供了下一步的研究思路。
