沉默转录因子YY1表达对胶原诱导的关节炎小鼠肠道菌群的影响①
2022-11-15江仁权汤纪丰何毓珏俞子晴林锦骠福建医科大学附属第一医院检验科福建医科大学基因诊断研究中心福建省检验医学重点实验室福州350005
江仁权 汤纪丰 何毓珏 俞子晴 林锦骠(福建医科大学附属第一医院检验科,福建医科大学基因诊断研究中心,福建省检验医学重点实验室,福州 350005)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性自身免疫性疾病,其发病机制尚未完全阐明[1]。最新研究表明肠道菌群与RA的发生密切相关。我国学者通过对RA患者口腔和肠道微生物进行元基因组分析时发现,口腔和肠道微生物菌群的异常是RA病理生理过程中的重要环节。在RA患者中某种嗜血杆菌呈现相对缺失的状态,而乳杆菌在RA患者的牙菌斑、唾液和粪便中均显著富集,这在病情高度活动的患者中表现得尤为明显[2];另有研究人员通过比较RA患者和健康者粪便样本中的肠道细菌发现,RA初诊患者所携带的普氏菌数量较健康者或慢性、接受治疗的RA患者多[3];节状丝菌可通过与幼稚T细胞的TCR受体结合诱导小鼠固有层中Th17的极化和活化,继而诱发自身免疫反应和炎症性关节炎[4]。以上研究均表明肠道菌群失调是RA发病的重要因素。课题组的前期研究发现,转录因子YY1可通过炎症因子IL-6调控Th17分化参与RA发病[5]。那么在RA中,YY1发挥的作用是否与肠道菌群有关?本研究首先拟构建RA的疾病动物模型胶原诱导的关节炎(collagen-induced arthritis,CIA)小鼠,通过YY1干扰慢病毒处理CIA小鼠,采用RT-PCR、16S rRNA高通量测序和微生物多样性分析等方法探讨沉默YY1表达对CIA小鼠肠道菌群的影响,以期为阐明YY1在RA发病中的作用、完善RA的发病机制提供实验依据。
1 材料与方法
1.1 材料DBA/1J小鼠购自上海斯莱克公司;鸡Ⅱ型胶原(chicken typeⅡcollagen,CⅡ)购自Chondrex公司;弗氏完全佐剂和弗氏不完全佐剂购自美国Sigma-Aldrich公司;小鼠Ficoll分离液购自北京索莱宝公司;TRIzol Reagent购自美国Invitrogen公司;逆转录试剂盒购自美国Fermentas公司;SYBR GreenPremix Ex Taq PCR试剂购自日本TaKaRa公司;PCR引物由上海生工生物有限公司合成,引物序列见表1;YY1干扰慢病毒由上海吉玛制药技术有限公司提供,所使用的慢病毒载体为pGLVH1/GFP载体,shRNA序列见表2。

表1 基因引物序列Tab.1 Gene primer sequences

表2 慢病毒shRNA序列信息Tab.2 Sequence information of lentivirus shRNA
1.2 方法
1.2.1 CIA小鼠动物模型的建立采用CⅡ免疫6~8周的DBA/1J雄性小鼠,初次免疫在小鼠尾根部皮内注射CⅡ,总量为150μg/只。21 d后,避开初次免疫部位,尾根部皮内再次注射CⅡ进行加强免疫,总量为75μg/只。小鼠在加强免疫约10 d后陆续出现症状,按随机抽样法分为对照组(LV-NC处理)和YY1沉默组(LV-YY1-shRNA处理),6~8只/组,并通过尾静脉注射慢病毒(1×108TU/只)处理CIA小鼠。
1.2.2 CIA小鼠关节炎症评分和标本采集对CIA小鼠进行关节和关节外病变观察及关节炎评分,各关节病变程度按5级评分法。0分:无红肿;1分:关节红不肿;2分:关节轻度红肿;3分:关节中度红肿;4分:关节重度红肿伴功能障碍。关节炎分数(arthritis score,AS)为每只DBA/1J小鼠所有病变关节分数的总和,最高分为16分。在初次免疫后的第36~62天内采取双盲法每3 d评分1次,同时记录得分。在初次免疫62 d后,颈椎脱臼法处死所有小鼠,留取小鼠外周血和肠道粪便,并使用小鼠Ficoll分离液分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)进行mRNA表达检测,肠道粪便送华大基因进行16S rRNA高通量测序。
1.2.3 PBMCs提取小鼠外周血中加入等量生理盐水,轻轻混匀后将其加至小鼠Ficoll分离液的液面上,2 000 r/min离心20 min;离心后,离心管由上至下分为4层:第一层为血浆层,第二层为环状乳白色淋巴细胞层,第三层为透明分离液层,第四层为红细胞层。第二层环状乳白色淋巴细胞层即为小鼠PBMCs,吸管小心吸取后立即加入TRIzol进行RNA提取。
1.2.4 RT-PCR分析采用苯酚-氯仿法抽提取小鼠PBMCs的总RNA,通过逆转录试剂盒逆转录获取cDNA,逆转录条件为:在总RNA样本中加入Oligo(dT)引物后充分混匀,PCR仪65℃扩增5 min;待反应完成后按试剂盒说明书加入dNTP、逆转录酶及RNA酶抑制剂等在PCR仪上42℃反应60 min,70℃反应5 min后4℃保存。目标基因表达水平的检测采用SYBR Green法,以cDNA为模板,扩增条件:95℃预变性30 s;随后95℃变性10 s,62℃退火30 s,重复40个循环。以β-actin为内参基因,2-ΔΔCt法计算目标基因的相对表达水平。
1.2.5 肠道菌群测序根据试剂盒说明书,采用QIAamp®DNA Stool Mini Kit提取小鼠肠道粪便总基因组DNA,采用16S rRNA通用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行扩增。纯化后的扩增产物使用MiSeq测序仪进行测序。
1.2.6 肠道菌群多样性分析测序结果采用Microbial Ecology相关软件和数据库进行分析,包括Prinseq、FLASH、PEAR、Mothur、Usearch、Cytoscape、R和RDP classifier等软件,RDP、Silva和NCBI 16S database等数据库。Chao、ACE、Shannon和Simpson指数由Mothur软件计算产生[6]。菌属多样性分析采用RDP classifier分析软件。菌群分布采用STAMP软件分析。
1.3 统计学分析采用Graphad Prism 8.0软件进行统计分析及作图。正态分布的计量资料组间比较采用独立样本t检验。所有假设检验比较均为双侧,以P<0.05为差异具有统计学意义。
2 结果
2.1 沉默YY1表达可减轻CIA小鼠炎症反应采用YY1干扰慢病毒处理CIA小鼠观察YY1对其发病的影响。结果显示与对照组相比,沉默YY1表达后CIA小鼠炎症评分降低(图1A)。同时,检测小鼠PBMCs中TNF-α、IFN-γ、IL-6和IL-17等基因的相对表达量,结果显示沉默YY1表达后TNF-α、IFN-γ和IL-6基因表达量降低(图1B)。以上结果表明,在CIA小鼠中干扰YY1表达后可能通过降低炎症因子表达减轻关节炎症反应。

图1 沉默YY1表达可减轻CIA小鼠炎症反应Fig.1 Silencing expression of YY1 could attenuate inflammation in CIA mice
2.2 肠道菌群丰度和多样性分析ACE、Chao和Richness指数在NC组和YY1干扰慢病毒处理组间无明显差异(图2A~C、F~H);而相比NC组,YY1干扰慢病毒处理组小鼠中Shannon指数增加,Simpson指数降低(图2D、E、I、J)。该结果表明,YY1干扰慢病毒处理CIA小鼠不改变肠道菌群的丰度,但对菌群的多样性有一定影响。

图2 CIA小鼠肠道菌群丰度和多样性分析Fig.2 Analysis of abundance and diversity of gut flora in CIA mice
2.3 肠道菌群种属差异分析 分析小鼠肠道菌群的种属差异,观察YY1慢病毒干扰后对哪些菌群产生影响。结果显示,小鼠肠道菌群中占主要的菌属为Barnesiella、Escherichia/Shigella和Lactobacillus,在NC组分别为21.91%、20.08%和11.79%(图3A),而在YY1慢病毒干扰组分别为22.82%、9.10%和7.98%(图3B)。而Intestinimonas(P=0.040)和Acetobacteroides(P=0.040)菌属在NC组和YY1慢病毒干扰组之间差异有统计学意义(图4)。
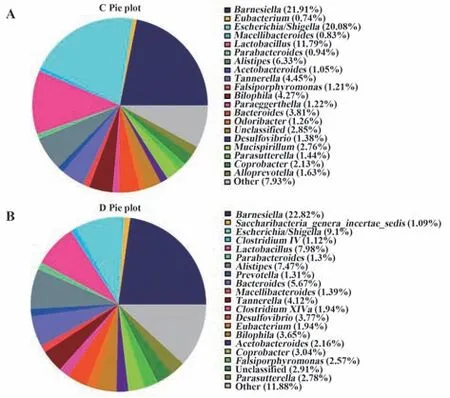
图3 CIA小鼠肠道菌群分布Fig.3 Distribution of gut flora in CIA mice
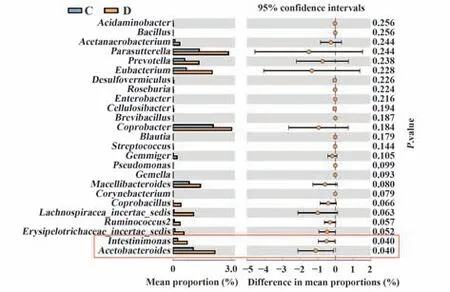
图4 肠道菌群分布差异图Fig.4 Difference maps of gut flora distributions
2.4 肠道菌群的功能差异预测分析已知沉默YY1表达可引起肠道菌群的分布差异,通过京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)对微生物基因组的基因功能构成进行分析,探究肠道菌群的改变是否会引起功能改变。结果显示磷酸代谢和丙二酚降解等功能在NC组和YY1慢病毒干扰组间存在差异(图5)。

图5 肠道菌群的功能差异图Fig.5 Difference maps of gut flora functions
3 讨论
肠道微生物基因组被称作人体的“第二基因组”,现有研究发现,肠道微生物群除了可将碳水化合物转化为短链脂肪酸外,还可调节宿主免疫功能和维持稳态,广泛参与人体的生理病理过程,与癌症发生、代谢综合征、心血管疾病、自身免疫病等均密切相关[7-11]。不仅如此,大量研究还提示肠道菌群参与机体免疫系统的调节与重塑。例如,脆弱拟杆菌(人体肠道中一种常见的共生菌)可通过一种特殊的分子polysaccharide A活化Toll样受体2(Toll-like receptors 2,TLR2)信号通路,抑制辅助性细胞(T helper)17分化,同时激活调节性T细胞(regulatory T cell,Treg),进而通过产生IL-10抑制炎症反应的发生来参与免疫调节[12]。梭菌属也有类似的诱导Treg分化的功能[13]。由此可见,肠道微生物群参与机体免疫调节和相应疾病的发生发展。
在肠道菌群与RA的相关研究中发现肠道菌群与RA的发生有关。研究者利用无菌小鼠模型,选择性地将不同种属的微生物注射到无菌环境培养的小鼠体内,并观察微生物对关节炎模型小鼠的影响。结果显示,革兰阴性的大肠埃希菌、拟杆菌对关节炎的发生具有保护作用,而革兰阳性的双歧杆菌、乳酸杆菌则会加重关节炎的进展[14]。另外,研究人员利用肠道共生菌Prevotellahisticola治疗关节炎小鼠,发现其可有效减轻小鼠的关节炎症状[15]。还有研究报道表明肠道微生物柯林斯氏菌(Collinsella)和小鼠关节炎症状直接相关,在患者发病早期阶段,打破肠道菌群的平衡会引起RA的发生[15]。表明肠道微生物的失调是RA发病的重要因素,调节肠道微生物菌群有望为RA治疗提供新思路[16]。
YY1是一种具有双重转录活性的核转录因子,在恶性肿瘤的发生发展和转移中起重要作用[17],但其在自身免疫病中的研究还较少。课题组的前期研究证实了转录因子YY1在RA患者中表达升高,其不仅可调控IL-6的转录表达促进Th17分化,还可调控IL-8表达促进中性粒细胞迁移,共同参与RA发病[5,18]。然而,YY1是否与RA中肠道菌群的变化有关尚不明确。为阐明YY1和肠道菌群在RA发病中的作用,课题组首先构建了RA的疾病动物模型CIA小鼠,并采用YY1干扰慢病毒处理CIA小鼠来沉默YY1表达。结果观察到沉默YY1表达后,CIA小鼠的关节炎症水平减轻,且相关的炎症因子TNF-α、IFN-γ和IL-6基因表达量降低,该结果表明在CIA小鼠中沉默YY1表达可减轻其炎症反应,延缓疾病进展。进一步探讨沉默YY1表达是否与CIA小鼠中肠道菌群的变化有关。采用16S rRNA高通量测序对CIA小鼠肠道粪便进行测序并分析,发现在CIA小鼠中沉默YY1表达后不改变肠道菌群丰度,但对菌群的多样性有一定影响。CIA小鼠的肠道菌群中以Barnesiella、Escherichia/Shigella和Lactobacillus菌属居多。相比对照组,沉默YY1表达的CIA小鼠肠道中的Intestinimonas和Acetobacteroides菌属增多。提示沉默YY1表达抑制CIA小鼠的炎症反应可能与肠道菌群的改变有关,干预肠道菌群有望成为治疗RA的新思路。
本研究尚存在一定的局限性,课题组虽然发现Intestinimonas和Acetobacteroides菌 属在沉默YY1表达的CIA小鼠中发生改变,但其是否与炎症因子的改变有关?沉默YY1表达具体是如何改变肠道菌群的?这些问题仍有待后续研究解决。
综上所述,在CIA小鼠中,沉默YY1表达可降低TNF-α、IFN-γ和IL-6等炎症因子表达,增加Intestinimonas和Acetobacteroides菌属丰度,从而延缓疾病进展,靶向干预YY1或者肠道菌群可为RA的治疗提供新方向。
